|
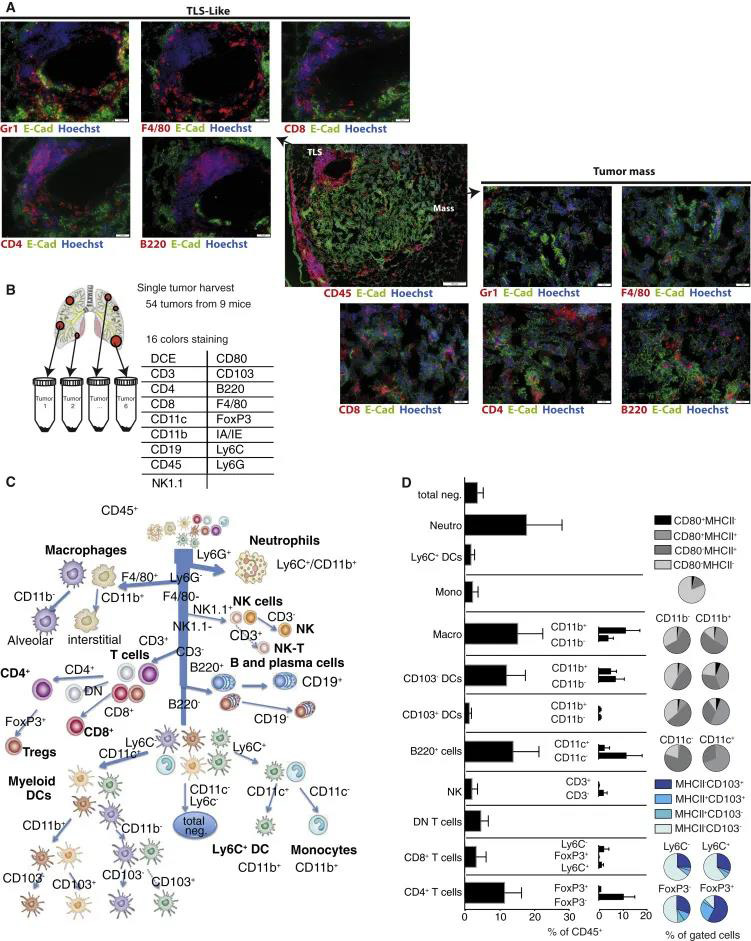
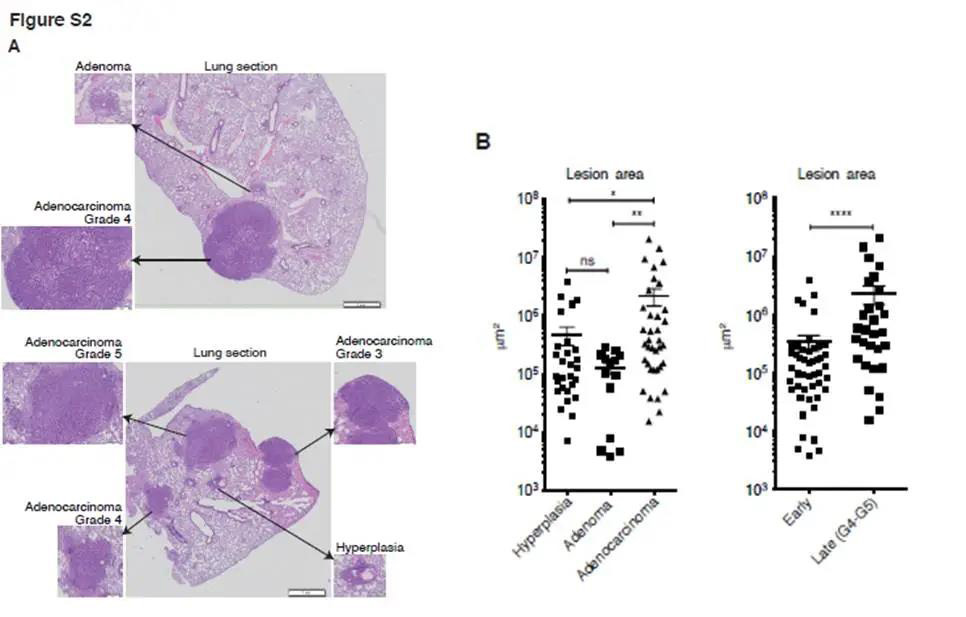
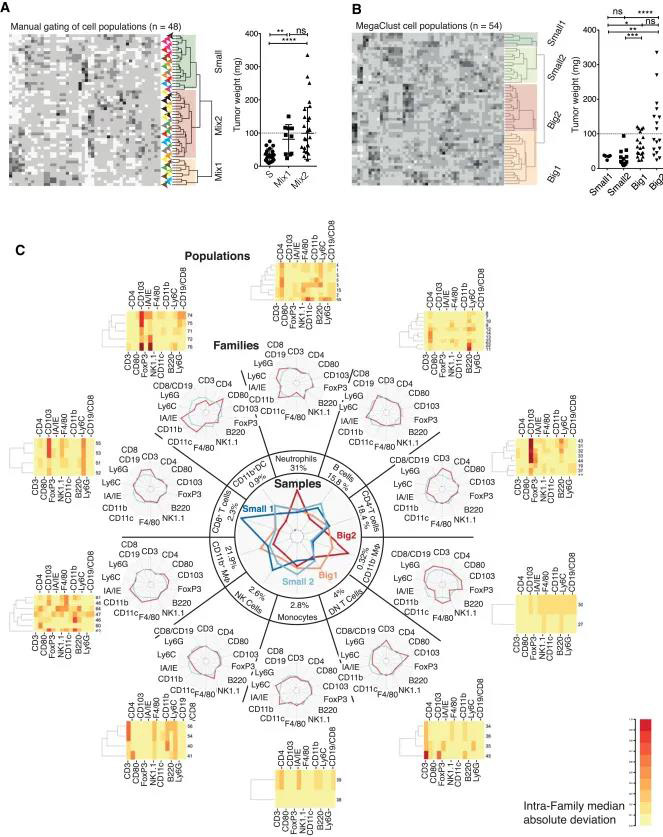
和大家一起学习肺癌的免疫环境的研究要如何设计以及开展,今天分享的文章是发表于《Cell Reports》标题为《Neutrophils and Snail Orchestrate the Establishment of a Pro-tumor Microenvironment in Lung Cancer 》。 作者使用了Kras(G12D)驱动的肺癌小鼠模型来建立免疫特征,并确定了Gr1+中性粒细胞对疾病进展的贡献。耗尽实验表明,Gr1+细胞(1)促进肿瘤生长,(2)减少T细胞归巢并阻止成功的抗PD1免疫疗法,以及(3)改变血管生成,导致缺氧和Snail在肺癌细胞中持续表达。反过来,Snail加快了疾病的进程并增加了肿瘤内Cxcl2分泌和中性粒细胞浸润。Cxcl2主要由嗜中性粒细胞自身产生,以响应表达Snail的肿瘤细胞分泌的因子。因此,作者提出了涵盖嗜中性粒细胞和Snail的恶性循环,以维持有害的肿瘤微环境。 KP肿瘤中的动态免疫反应 在KP小鼠中,适应性免疫控制疾病的进展。作者通过在Rag1缺陷小鼠与KP小鼠杂交获得的KP-Ragko肿瘤小鼠与正常KP肿瘤相比肿瘤增长速度增加。通过IF观察免疫细胞的定位,进而研究KP小鼠肿瘤的免疫微环境。结果显示免疫细胞在肿瘤组织外大量聚集,包括T细胞(CD4+和CD8+)、B细胞(B220+)、巨噬细胞(F4/80+)及Gr1(Ly6G-C)阳性细胞(图1A)。作者通过流式对KP肿瘤的免疫细胞进行了进一步分析,显示髓样细胞占优势(51%±10%),淋巴样细胞占37%±12%(图1B-D)。 图 1 KP小鼠的肺切片组织病理学分析说明病变的异质性,良性病变和晚期病变在同一动物中发现,晚期组织学分级(腺癌4级和5级)主要在最大的肿瘤组织中发现(图S2A-B)。因此作者进一步研究了识别与肿瘤进展和病灶间异质性相关的免疫特征变化。 在正常的KP肿瘤中,基于48个免疫细胞群的丰度,根据肿瘤的重量对肿瘤进行分类分为small [S]、Mix1和Mix2。作者接下来为了从复杂的细胞计数数据中识别细胞群,开发了MegaClust(http:// megaclust .vital-it.ch)算法,并对MegaClust识别的每个细胞群的质量进行了评估。在MegaClust的基础上对样本进行无监督分层聚类,分成了四个样本簇,其中两个仅包含小肿瘤(Small1;Small2),两个由大肿瘤组成(Big1 ; Big2)(图2B)。为了实现一个全局的解释,MegaClust识别的每个个体群体都在家庭中分组,基于它们在层次聚类中的相似性,每个分析级别(样本、家庭和群体)都在一个图表中表示。图来自54个KP肿瘤样本:(1)与Big1、Big2相比,Small1、Small2细胞富集NK细胞和B细胞;(2) Small1特有的高比例CD8+ T细胞;(3)在Big2中,中性粒细胞和CD11b- 巨噬细胞浸润多(图2C)。 除了有效预测源自相同致癌事件的肿瘤的肿瘤大小外,免疫信号还突出了最大肿瘤中中性粒细胞的富集。
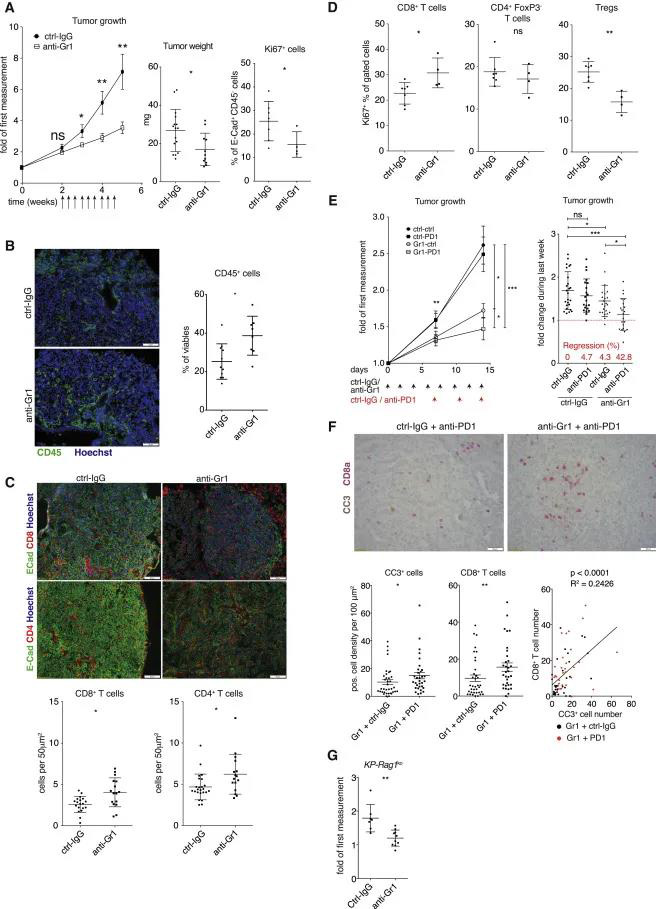
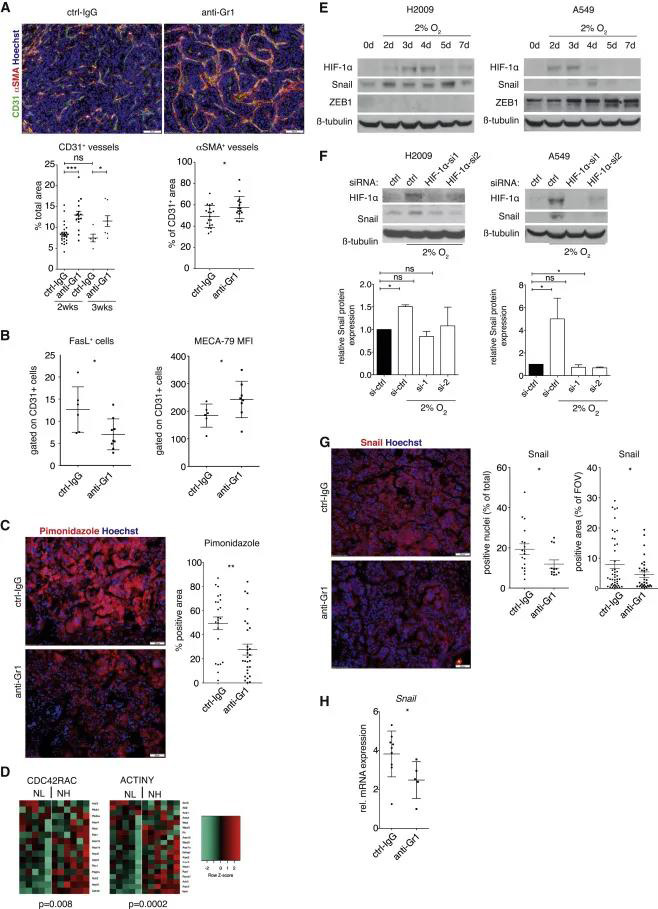
Gr1 +细胞耗竭抑制肺肿瘤的生长,恢复免疫排斥,并对抗PD1免疫疗法的病变敏感 为了解释中性粒细胞在肿瘤中的作用,作者用抗Ly6g或抗Gr1 (Ly6C/G)抗体来消耗中性粒细胞。每周的mCT显像显示Gr1+细胞耗尽显著抑制肿瘤生长;死亡时,癌细胞增殖减少,肿瘤重量减轻(图3A)。尽管中性粒细胞是肿瘤免疫中的主要种群,Gr1+细胞消耗实际上导致了CD45+细胞对肿瘤的浸润增加(图3B)。MegaClust分析证实抗Gr1治疗2周后中性粒细胞成功清除,而且图2C中显示CD11b+细胞(主要是F4/80+巨噬细胞)显着增加,说明抗Gr1抗体对循环单核细胞的影响并不干扰KP肿瘤中的巨噬细胞和DC归巢。IF结果说明肿瘤肿块中CD8+和CD4+T细胞浸润明显增强(图3C)。此外,抗Gr1处理后CD8+T细胞增殖更多,Treg减少(图3D)。结果表明,清除Gr1+细胞会触发免疫环境的改变,从而促进效应T细胞富集到肿瘤中,这表明中性粒细胞在建立KP肿瘤的免疫排斥中发挥作用。 作者进一步将Gr1+细胞清除与抗PD1治疗相结合。与仅用某一种方法相比,抗Gr1处理1周后的抗PD1治疗后肿瘤生长明显减少,并有42.8%的病变回归(图3 E);增加了癌细胞死亡和肿瘤中CD8+T细胞的数量(图3 F);CD8+T细胞产生的干扰素-γ(IFN-γ)明显增加。为了确定中性粒细胞的促肿瘤活性是否仅在于其建立免疫排斥的能力,我们用抗Gr1处理了KP-Rag ko小鼠。即使没有适应性免疫,Gr1+细胞的消耗仍然能够减少肿瘤的生长(图3 G)。因此,我们认为中性粒细胞通过其他机制促进疾病进展。
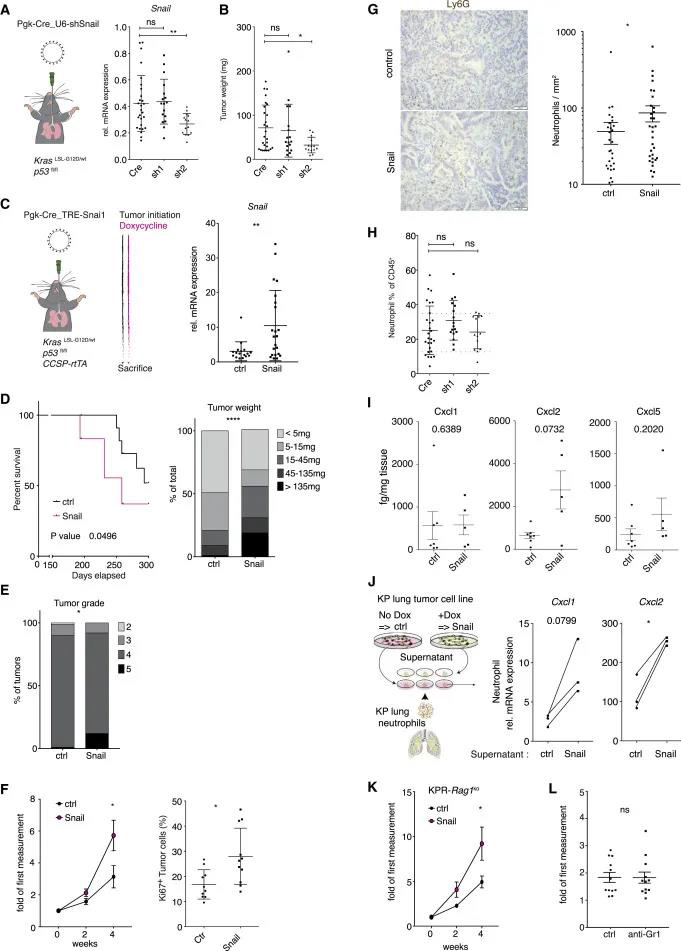
Gr1+细胞浸润与血管改变相关,导致肿瘤细胞缺氧增强和Snail持续表达 血管正常化是有效进行癌症免疫治疗的先决条件,我们研究了Gr1 +细胞清除后的血管丰度和功能。经过2和3周的抗Gr1治疗,我们观察到CD31 +内皮细胞富集,肿瘤中周细胞(αSMA+)的血管覆盖增加(图4A)。对内皮细胞表型的更详细分析显示,FasL减少且MECA-79染色强度增加,表明这些血管更易于免疫细胞外渗,这可以解释抗Gr1处理如何恢复免疫排斥(图4B)。由于肿瘤脉管系统受Gr1 +细胞耗竭的影响,我们推测中性粒细胞有助于建立低氧环境。因此,吡莫尼唑注射液显示Gr1 +细胞耗竭的肿瘤中的缺氧减少(图4C)。并且Gr1 +细胞浸润可增强细胞增殖(CDC42RAC)和运动性(ACTINY)(图4D)。 因为Gr1+细胞耗竭可以缓解KP肿瘤中的缺氧,所以我们评估了缺氧在体外对人肺癌细胞A549和H2009的影响。结果显示,HIF-1α敲低导致缺氧介导的Snail诱导减少(图4E-F)。 在体外实验中,抗Ga1处理的CD45+的细胞中作者发现Snail蛋白表达下降,IF中阳性率下降,mRNA水平表达降低(图4G-H)。这些结果表明,中性粒细胞浸润通过修饰血管导致缺氧HIF-1a稳定表达,最终增强肿瘤细胞Snail的表达。
Snail在癌细胞中的表达加速疾病进程并产生Big2样肿瘤 我们要确定肿瘤细胞中持续的Snail表达是否直接有助于疾病进展。作者在体外沉默了肿瘤细胞中的内源性Snail。与正常的KP肿瘤(Cre)相比, sh2显着降低Snail mRNA表达抑制了肿瘤的生长(图5A-B)。 作者进一步使用KPR小鼠,使用Cre和强力霉素诱导的Snail的慢病毒载体,在KPR和KP小鼠中启动肺肿瘤。从感染当天起,所有小鼠均接受强力霉素饮食,以促进Snail在KPR肺肿瘤中的表达(图5C)。Snail表达加速了疾病的发展(图5D-F);过表达Snail的肿瘤中中性粒细胞绝对数量增加(图5G)。在体内敲除实验中,对照组和sh1、sh2组没有出现强中性粒细胞浸润的肿瘤(图5H)。因此,肿瘤细胞中Snail的持续表达至少部分是由Gr1+细胞浸润介导的(图4G和4H);反过来,Snail在癌细胞中的表达会产生Big2样肿瘤。 为了阐明Snail表达如何导致肺肿瘤中嗜中性粒细胞浸润的增加,作者评估了募集中性粒细胞的几种趋化因子(Cxcl1,Cxcl2和Cxcl5)的表达。在表达Snail的肿瘤中Cxcl2和Cxcl5的分泌增加了(图5I )。 作者从健康的肺部纯化了中性粒细胞,表达Snail的细胞的条件培养基能够增加离体中性粒细胞的Cxcl1和Cxcl2 mRNA的丰度(图5J)。这表明表达蜗牛的肺癌细胞释放出可溶性因子,该因子可通过嗜中性粒细胞检测到,从而增强嗜中性粒细胞归巢趋化因子的产生。 作者进一步将KPR小鼠与Rag1缺陷型小鼠杂交,这表明持续的Snail诱导与KP肿瘤一样增加了中性粒细胞的募集,并在缺乏适应性免疫系统的小鼠中保留了促肿瘤活性(图5K)。此外,抗Gr1治疗未能降低Snail诱导的肿瘤的生长速率(图5L),表明Snail促进了除中性粒细胞募集和免疫排斥之外的肿瘤进展。
Big2 KP肿瘤与肺癌患者的预后有关 作者通过患者样本来分析了B细胞(CD20+),中性粒细胞(CD15+)和CD8+T细胞的丰度,以及Snail的表达。发现以B细胞和CD8+ T细胞比例低、中性粒细胞浸润高为特征的反映小鼠Big2的肿瘤患者(D组)的总生存率明显降低。相反,一组患者(A组)类似于Small1组,CD8+T细胞和B细胞以及嗜中性粒细胞的低浸润,有生存率提高的趋势(图6A-6D)。 与Big2小鼠肿瘤一样,D组患者活检时肿瘤更大(图6E),此外,中性粒细胞浸润与CD31染色呈负相关(图6F)。我们还证实,Snail表达与预后差相关(图6G)。说明KP小鼠模型转化为人肺腺癌后,约三分之一的肺腺癌患者表现为肿瘤组织大,中性粒细胞浸润高,且预后差。
结论:中性粒细胞,血管和癌细胞之间的有害对话,最终起到稳定肿瘤细胞中Snail的作用,并建立了有利于疾病进展的肿瘤微环境。
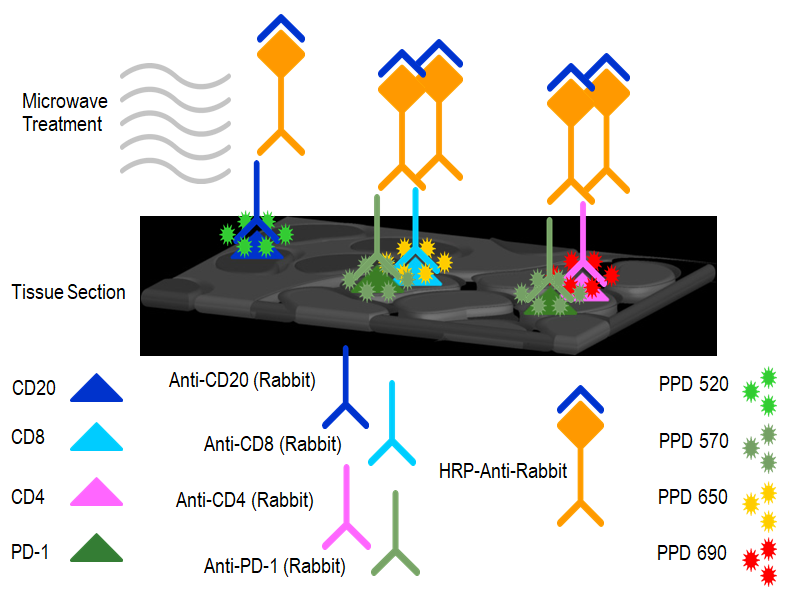
本文涉及技术: 流式检测分析 本文涉及技术: 多重免疫荧光组化 |















 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


