
研究背景:
胰腺癌作为恶性程度极高的消化系统肿瘤,其死亡率与发病率近乎持平的临床特征始终是医学领域的重大挑战。与多数癌症生存率稳步提升的趋势不同,胰腺癌的诊疗进展长期滞后 —— 超过 50% 的患者确诊时已处于疾病晚期,对传统放化疗方案呈现显著耐药性。据美国 2017 年流行病学数据显示,胰腺癌患者 5 年相对生存率仅 8%,尽管男性患者生存率呈现年均 0.3% 的微弱提升,但整体预后仍处于恶性肿瘤谱系的最底端,临床对创新治疗策略的需求已迫在眉睫。
斑蝥素作为中药斑蝥的主要活性成分,其抗肿瘤药理作用在我国临床实践中已得到广泛应用。该成分通过选择性抑制蛋白磷酸酶 2A(PP2A)发挥生物学效应 ——PP2A 作为 ERK、JNK、PKC 及 NF-κB 等多条致癌激酶通路的负调控因子,在细胞周期调控、凋亡信号传导及细胞命运决定中扮演关键角色。研究证实,斑蝥素介导的 PP2A 抑制可通过激活 JNK 和 NF-κB 通路发挥癌细胞生长抑制作用,这一发现颠覆了 "激酶激活必然促进肿瘤进展" 的传统认知。此外,体外实验已明确斑蝥素可通过诱导 G2/M 期细胞周期阻滞、促进细胞凋亡、抑制迁移侵袭能力及削弱肿瘤细胞干性等多重机制抑制胰腺癌细胞生物学行为。然而,其抗肿瘤效应的体内验证仍处于空白状态,该文研究旨在通过胰腺癌异种移植瘤模型,系统探究斑蝥素的体内抗肿瘤作用及潜在分子机制。
研究结果:
1. 斑蝥素加速皮下及原位移植胰腺癌的进展
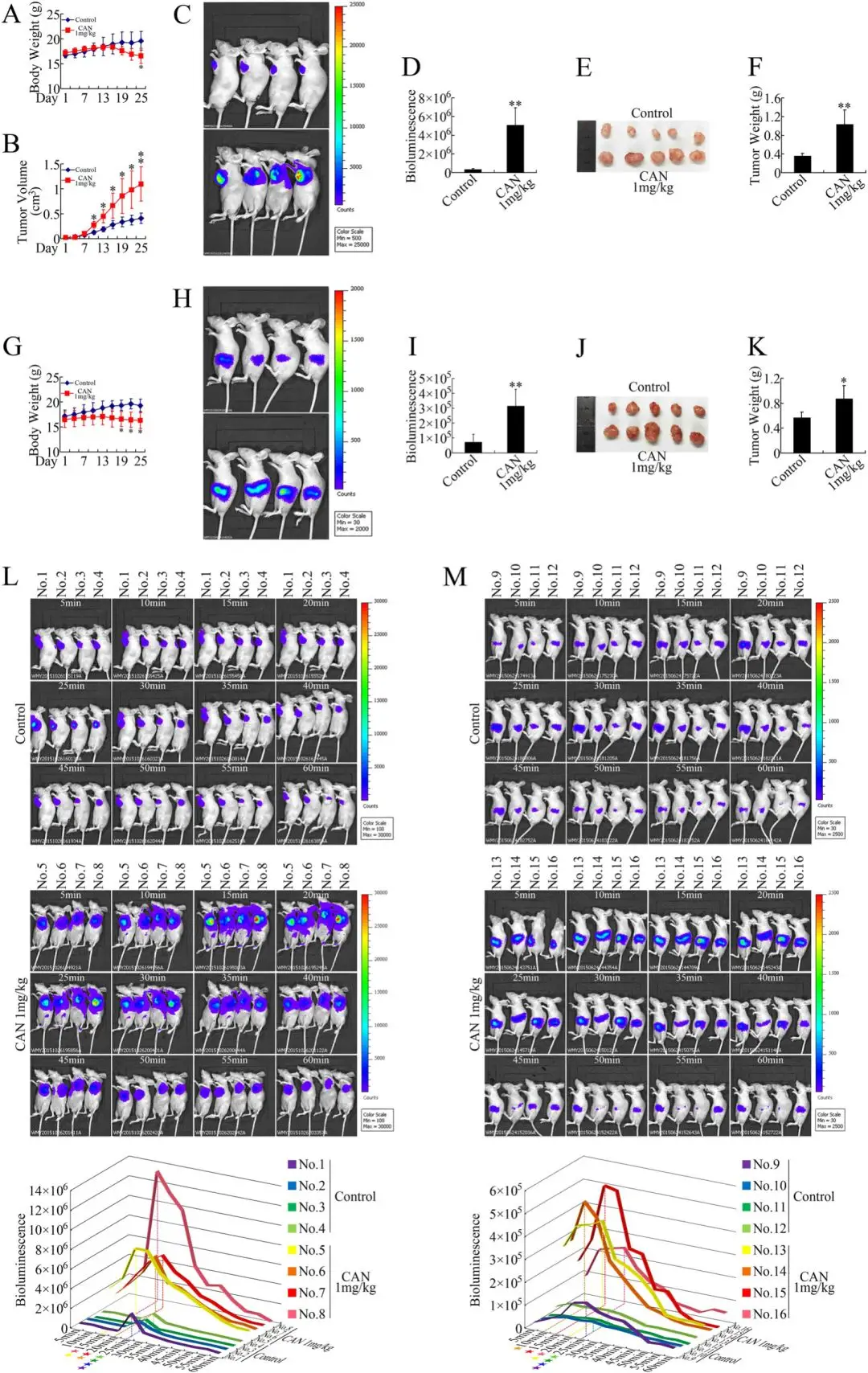
如图 1a、b 所示,与对照组相比,斑蝥素处理组小鼠体重呈现显著下降趋势,而肿瘤体积则呈现扩张态势。活体成像技术检测显示,斑蝥素处理组皮下移植瘤的生长速率显著高于对照组(图 1c-f)。值得注意的是,尽管体外实验表明斑蝥素对 NCI-H292 肺癌细胞和 LoVo 结直肠癌细胞具有生长抑制作用,但体内异种移植模型显示,斑蝥素反而促进了这两种癌细胞的移植瘤生长,这一现象提示斑蝥素的促增殖效应不具有癌种特异性。
在原位异种移植模型中,研究人员观察到了一致的实验结果(图 1g-k)。通过活体生物发光成像分析(图 1l、m)发现,斑蝥素处理组的生物发光峰值出现时间较对照组显著提前,且其生物发光信号衰减速率更快,这一现象暗示斑蝥素在体内具有快速分布的特性。结合斑蝥素处理组移植瘤的生长特征,研究人员推测该药物可能通过促进肿瘤血管生成,为移植瘤提供丰富的血供环境,从而加速肿瘤进展。
2、斑蝥素驱动胰腺癌模型血管新生的分子机制
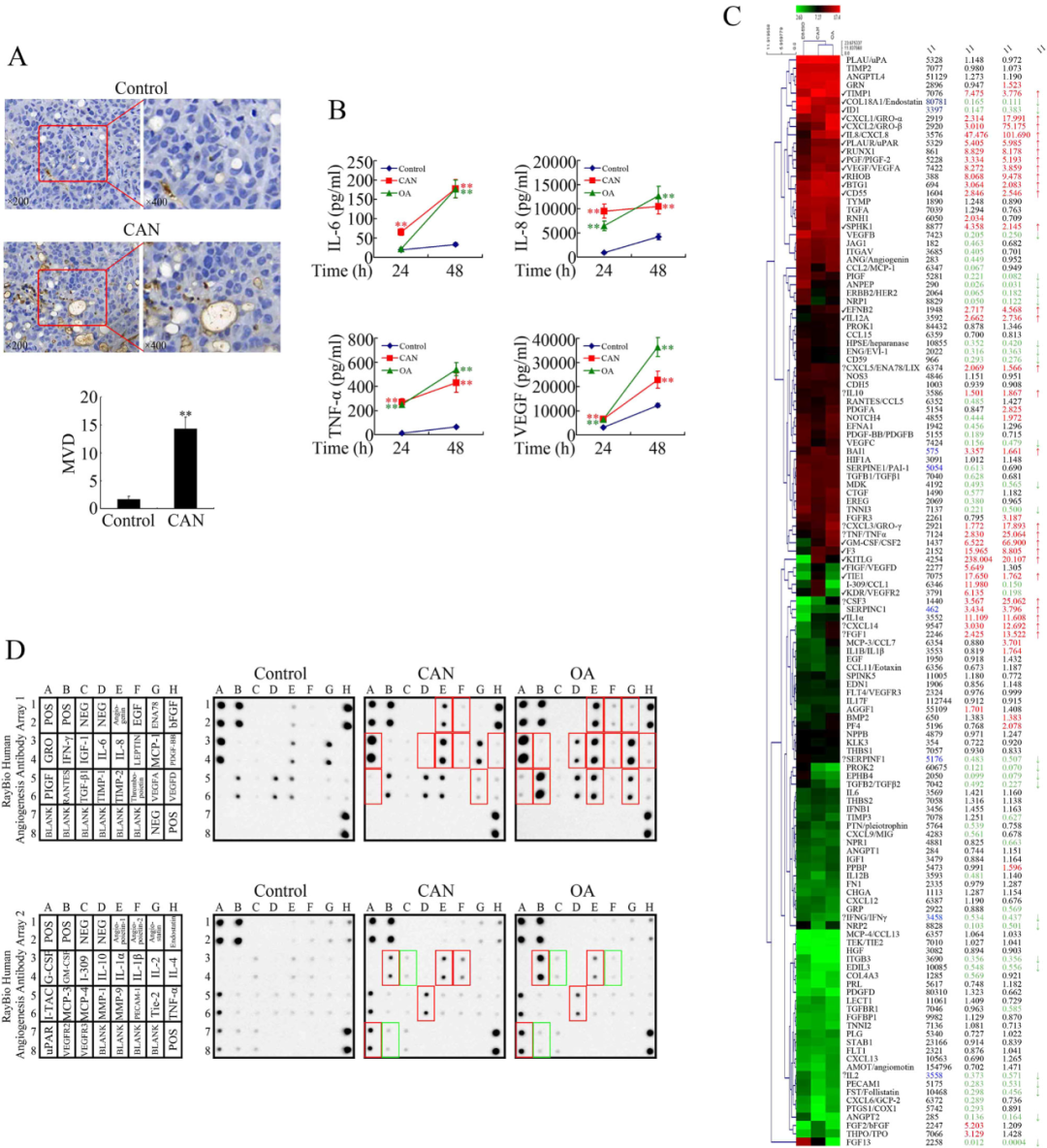
采用免疫组化技术检测斑蝥素处理的胰腺原位移植小鼠血管内皮标志物 CD34 的表达情况。如图 2a 所示,基于微血管密度(MVD)的量化分析显示,斑蝥素组的促血管生成效应显著强于对照组。相同的实验现象在肺癌(NCI-H292 细胞)和结直肠癌(LoVo 细胞)的异种移植模型中重复出现,证实斑蝥素的促血管生成作用不依赖于癌种类型。
机制研究表明,斑蝥素通过抑制蛋白磷酸酶 2A(PP2A)激活 JNK、ERK、PKC 和 NF-κB 等多条激酶通路,而这些通路均受 PP2A 的负性调控。既往研究已证实斑蝥素可通过抑制 PP2A 激活 ERK、JNK、PKC 及 NF-κB 等通路,据此推测其促血管生成效应可能源于 PP2A 的抑制性调控。为验证该假设,研究者对比分析了斑蝥素与典型 PP2A 抑制剂冈田酸(OA)对血管生成相关因子分泌及基因表达的影响。
利用 多因子检测技术分析斑蝥素或 OA 处理后的 PANC-1 细胞培养上清,发现两种试剂均可呈时间依赖性增强 IL-6、IL-8、TNF-α 及 VEGF 等促血管生成因子的分泌(图 2b)。通过基因芯片分析检测斑蝥素或 OA 处理后 PANC-1 细胞的血管生成相关基因转录水平,结果显示(图 2c):TIMP1、CXCL1/GRO-α、CXCL2/GRO-β、IL-8/CXCL8 等多种促血管生成基因被显著诱导,而抗血管生成基因 COL18A1/Endostatin 的表达呈现下调。
进一步采用抗体芯片检测血管生成相关蛋白的表达变化,结果显示(图 2d):斑蝥素与 OA 均可显著提升 Angiogenin、EGF、GRO、IL-6、IL-8 等因子的表达水平。交叉分析芯片数据发现,二者在转录和翻译水平均显著增强 IL-8/CXCL8、CXCL1/GRO-α、VEGF/VEGFA 等分子的表达。上述结果表明,斑蝥素与 OA 可能通过协同调控多维度血管生成相关基因的表达,介导其促血管生成效应。
3、ERK/JNK/PKC/NF-κB 激酶网络介导斑蝥素的促血管生成基因调控
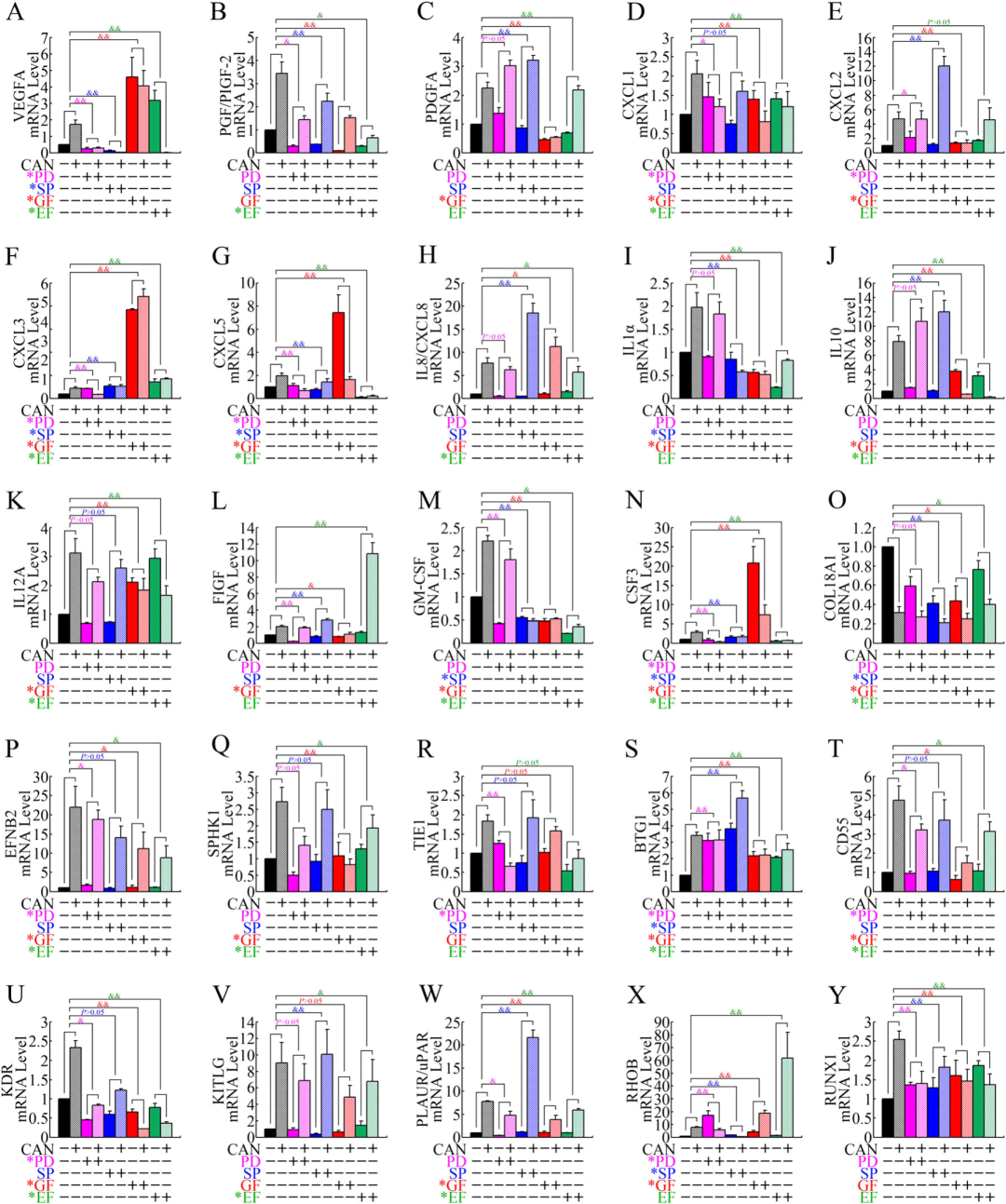
鉴于斑蝥素通过抑制 PP2A 触发 ERK、JNK、PKC 及 NF-κB 通路的激活,研究者推测这些激酶信号网络参与了促血管生成基因的转录调控。
实验采用 ERK 抑制剂 PD98059、JNK 抑制剂 SP600125、NF-κB 抑制剂 EF-24 及 PKC 抑制剂 GF109203X 对 PANC-1 细胞进行预处理,随后施以斑蝥素刺激。通过 RT-PCR 检测发现,上述通路抑制剂可显著拮抗斑蝥素诱导的 VEGF、IL-8 等促血管生成基因的表达上调(图 3)。这一结果证实四条激酶通路均参与斑蝥素的血管生成调控,其中 NF-κB 和 PKC 通路抑制剂在多数靶基因的诱导表达中发挥主导作用,提示这两条信号轴可能是斑蝥素促血管生成效应的核心驱动通路。
4、斑蝥素联合人参皂苷 Rg3 或三苯氧胺(TAM)展现协同抗癌效应
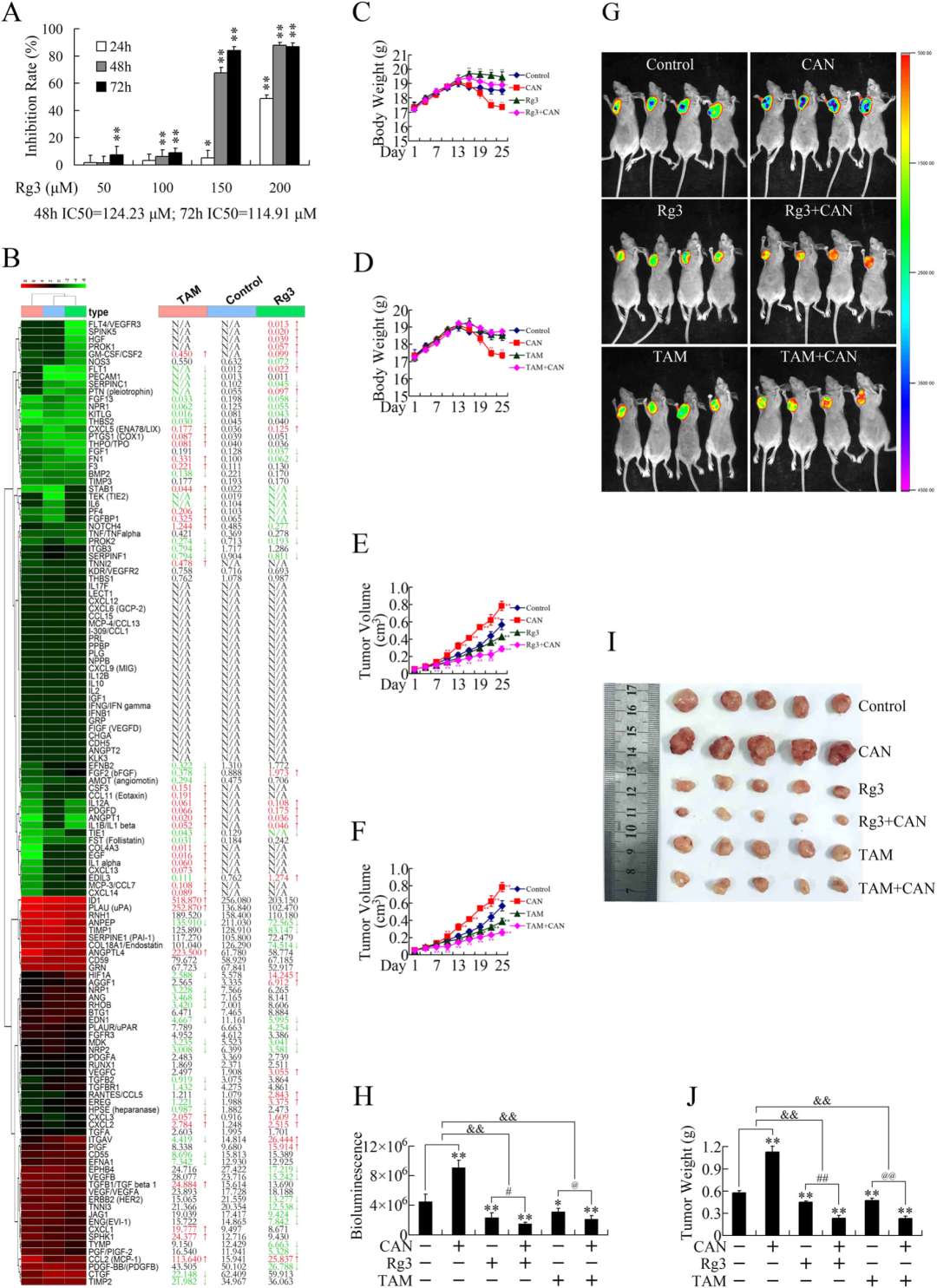
斑蝥素在体外研究中呈现出显著的抗肿瘤活性,但因其促血管生成的副作用限制了临床应用。研究者基于 “消除促血管生成作用以释放体内抗癌潜力” 的假设,尝试将斑蝥素与抗血管生成药物联用,探索其体内协同抗癌效果。人参皂苷 Rg3 作为人参提取物的关键活性成分,体外实验证实其可通过损伤内皮祖细胞功能,抑制 VEGF 介导的 p38/ERK 与 Akt/eNOS 信号通路,从而阻断肿瘤血管新生;临床研究也表明其安全性高、不良反应少。三苯氧胺(TAM)作为经典的非甾体类抗雌激素药物,不仅用于内分泌治疗,还可通过抑制 PKC 信号通路抑制胰腺癌细胞增殖。鉴于 Rg3 与 TAM 在临床中良好的耐受性,且其作用靶点与斑蝥素促血管生成机制密切相关,研究者进一步探究二者是否能拮抗斑蝥素的促肿瘤作用。
为明确 Rg3 对胰腺癌细胞的直接杀伤效应,研究者首先开展 MTT 实验(图 4a),结果显示 Rg3 对 PANC-1 细胞的增殖抑制作用呈时间与浓度依赖性。随后,通过 RNA 测序分析 Rg3 或 TAM 处理后的 PANC-1 细胞基因表达谱(图 4b),发现二者均可显著下调多个血管生成相关基因。更重要的是,联合用药实验表明,Rg3 与 TAM 均能有效逆转斑蝥素的促肿瘤效应,与斑蝥素联用时展现出显著的协同抗癌活性(图 4c-j),证实了多药联合策略在胰腺癌治疗中的潜在价值。
5、抗血管生成药物对斑蝥素体内促血管生成效应的拮抗作用
研究者选取三种典型抗血管生成药物(图 5a)开展联合用药研究:贝伐单抗(靶向 VEGF 的人源化单克隆抗体)、阿帕替尼(选择性抑制 VEGFR2 ATP 结合位点的小分子抑制剂)及恩度(重组人内皮抑素蛋白)。实验结果(图 5b-e)显示,斑蝥素分别与贝伐单抗、阿帕替尼或恩度联用时,可显著抑制胰腺癌皮下移植瘤的生长。这一发现证实,通过联合应用抗血管生成药物拮抗斑蝥素的促血管生成副作用后,其体内抗癌活性得以有效释放,为斑蝥素类药物的临床转化提供了新思路。
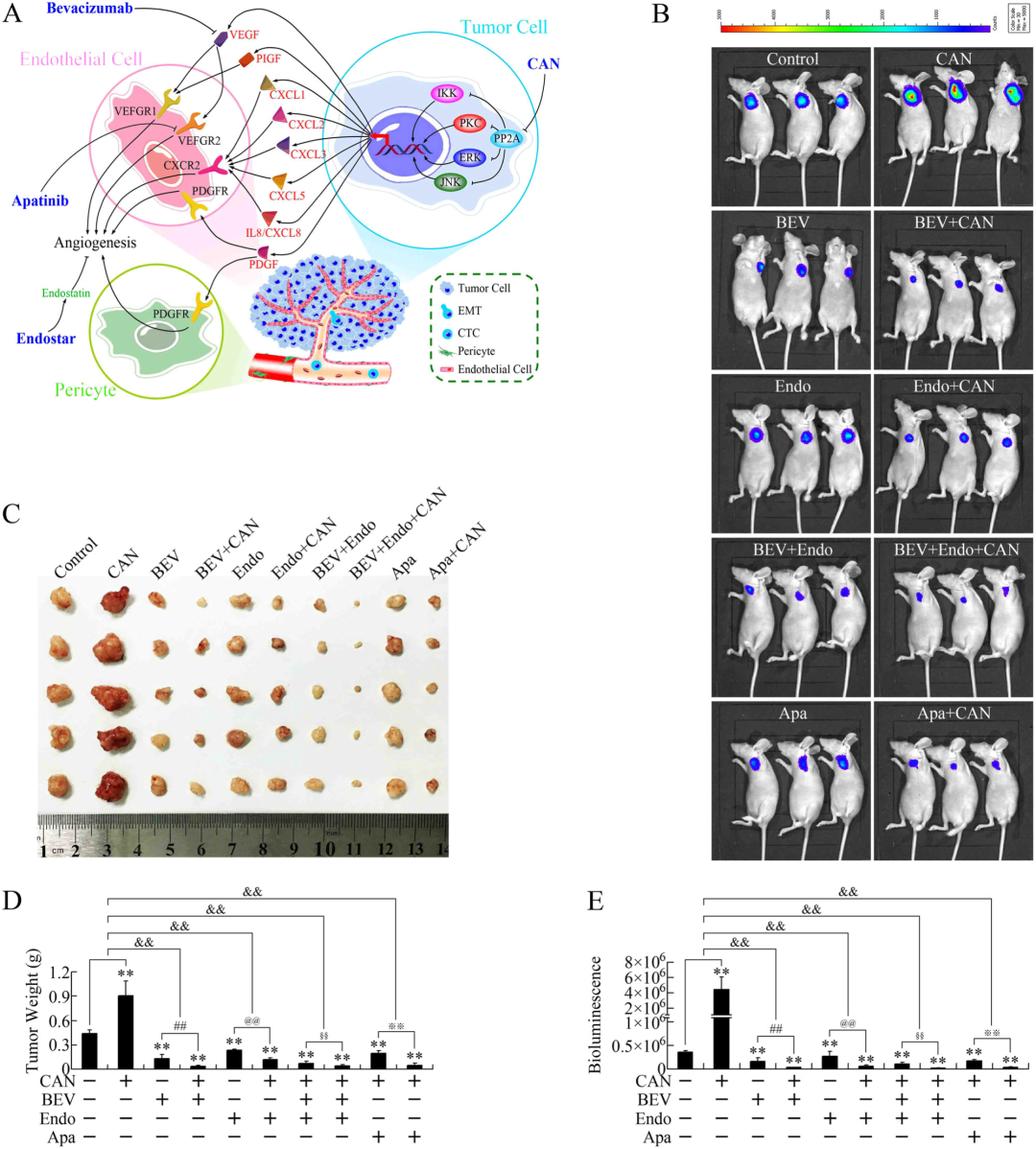
6、斑蝥素衍生物的体内促瘤效应及贝伐单抗的逆转作用
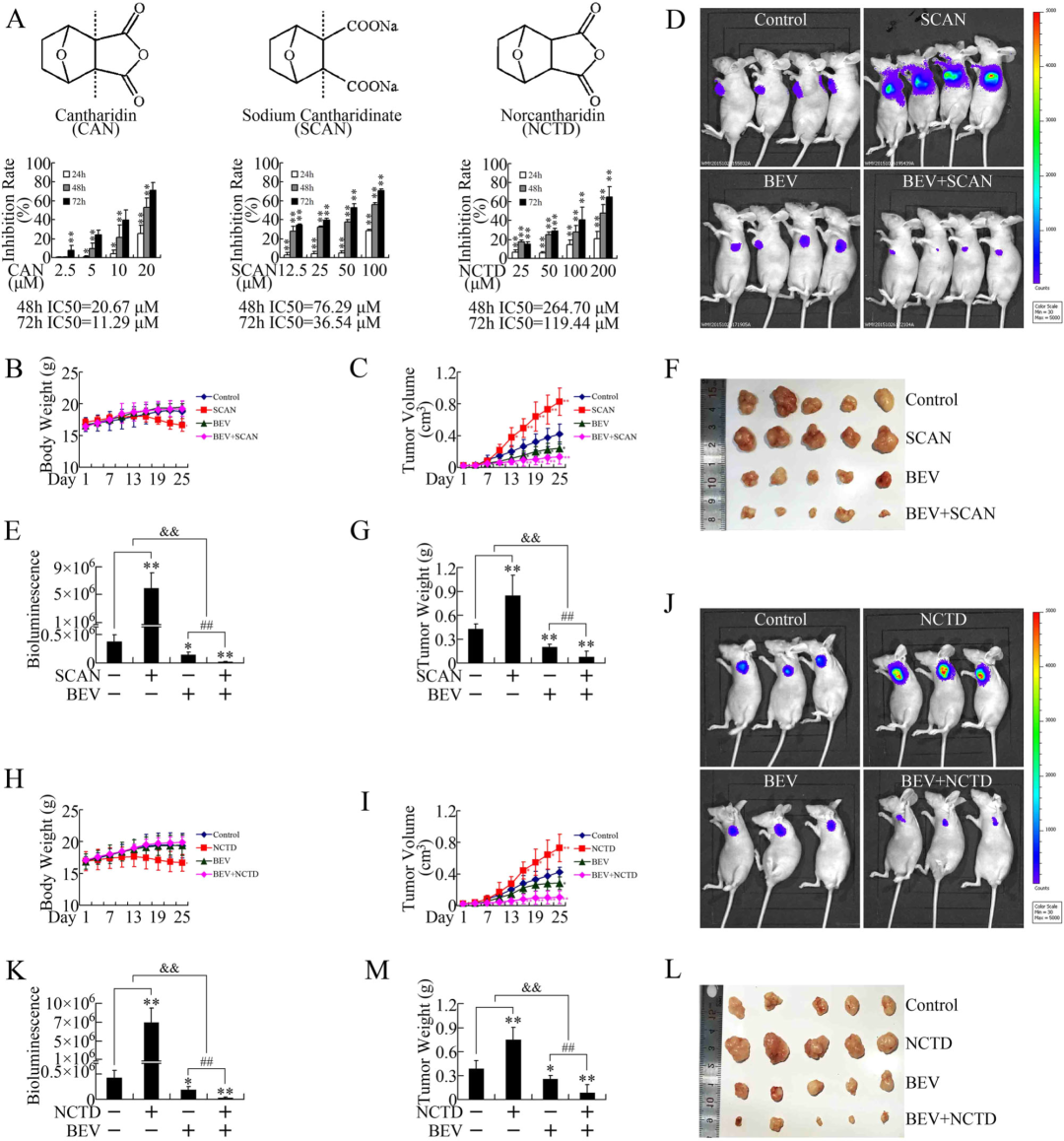
鉴于斑蝥素在临床应用中表现出肾脏毒性等显著副作用,其衍生物的研发已成为重要方向。目前临床研究中应用最广泛的衍生物为斑蝥酸钠(SCAN)和去甲斑蝥素(NCTD)(图 6a)。通过 MTT 法检测两种衍生物对胰腺癌细胞的体外杀伤活性,结果显示,SCAN 与 NCTD 对胰腺癌细胞的生长抑制作用呈剂量与时间依赖性,但其抗肿瘤活性较母体化合物有所降低(图 6a)。
与斑蝥素的体内效应一致,SCAN 和 NCTD 均可促进异种移植瘤的生长,而抗血管生成药物贝伐单抗能够逆转这一效应(图 6b-j)。值得注意的是,SCAN 与 NCTD 的体内耐受性显著优于斑蝥素,这一特性使得斑蝥素衍生物与抗血管生成药物的联合应用成为更具临床可行性的治疗策略。
乐备实是国内专注于提供高质量蛋白检测以及组学分析服务的实验服务专家,自2018年成立以来,乐备实不断寻求突破,公司的服务技术平台已扩展到单细胞测序、空间多组学、流式检测、超敏电化学发光、Luminex多因子检测、抗体芯片、PCR Array、ELISA、Elispot、多色免疫组化等30多个,建立起了一套涵盖基因、蛋白、细胞以及组织水平实验的完整检测体系。
我们可提供从样本运输、储存管理、样本制备、样本检测到检测数据分析的全流程服务。凭借严格的实验室管理流程、标准化实验室操作、原始数据储存体系以及实验项目管理系统,已经为超过3000家客户单位提供服务,年检测样本超过100万,受到了广大客户的信任与支持。











 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


