在细胞学研究领域,细胞分离纯化始终是核心课题 —— 当聚焦特定细胞的功能机制时,获取高纯度目的细胞群是开展深度研究的必要条件。这一需求使得细胞分选技术成为连接样本制备与功能分析的关键桥梁。
细胞分选(cell sorting)的本质,是基于细胞物理特性或生物学标记的差异,从混合细胞样本中精准捕获目标亚群的技术体系。作为细胞生化分析与功能研究的前置环节,其分离效率直接决定后续实验数据的可靠性与研究结论的准确性。
细胞分选常见问题有哪些?
Q1:何时选择流式分选而非批量分离技术(如磁珠法)?
答:当存在以下需求时优先选择流式分选:
- 目标细胞群需达到极高纯度(95%-100%)
- 分离表面受体密度低的细胞群体
- 按表面受体表达量梯度富集细胞亚群
- 基于多色荧光标记进行细胞分选
- 需结合胞内染色(如 DNA 含量、胞内抗原)分选
Q2:流式分选会损伤细胞吗?
答:通常不会。只要将细胞维持在适宜的温度、pH 值及培养基环境中,分选过程本身对细胞的损伤可忽略。
Q3:若原细胞群含 10% 目标细胞,需准备多少起始细胞才能分选出 1×10⁶个目标细胞?
答:理论计算为:1×10⁶ = 10% 目标细胞 × 50% 回收率 × 起始细胞数,即需准备 20×10⁶个起始细胞。实际回收率受以下因素影响:
- 细胞黏附管壁导致的损耗
- 分选速率(速率越高回收率越低)
- 仪器分选精度
- 分选模式(浓缩分选回收率高于纯度分选)
Q4:如何提高分选回收率?
答:可采取以下优化措施:
- 全程使用聚丙烯材质耗材(处理管、收集管)
- 洗涤后准确计数细胞
- 用 Hank's 液替代 PBS 作为鞘液
- 收集管预先加入含 20% 血清的培养基(填充 1/3 以上体积)
- 优化分选温度(4℃、15℃或室温)
- 每小时颠倒收集管一次
- 收集管满或分选结束后立即处理
- 离心时间控制在 10 分钟左右
Q5:单克隆抗体标记细胞时,是否需严格按常规染色比例计算抗体用量?
答:无需严格遵循。经验表明:在 0.5 ml 缓冲液中孵育 2-3×10⁷个细胞时,抗体用量只需理论值的 1/4-1/5。
Q6:流式分选的常规耗时如何?
答:标准流程耗时约:
- 仪器调试:1 小时
- 分选区域设置:15 分钟
- 分选后分析:30 分钟
分选 20×10⁶个细胞通常需 2-4 小时,具体受目标细胞占比、纯度要求等因素影响。无菌分选的仪器准备时间约 90 分钟。
Q7:能否同时分选阳性和阴性细胞?
答:可以。阳性细胞和阴性细胞可分别收集至左右分选管,也可将靶细胞与剩余细胞(含废液)分置不同收集管。
Q8:流式分选的实际回收率是多少?受哪些因素影响?
答:通常回收率约为理论值的 50%,具体受 Q3 中所述因素(细胞黏附、分选速率等)影响。
Q9:如何保证分选过程中的细胞活力?
答:优化要点包括:
- 使用富营养培养基(建议高血清浓度,抵消鞘液稀释影响)
- 收集管维持适宜温度,含细胞活力保护培养基
- 分选完成后尽快处理细胞
Q10:推荐的细胞重悬培养基及浓度是多少?
答:常用配方:含 25 mmol Hepes 和 2%-10% 血清的 RPMI 1640,细胞密度 6-8×10⁶/ml(低压力分选可提高分辨率)。易聚集细胞可降至 4-5×10⁶/ml。
Q11:FACStar 流式细胞仪的最大分选速率是多少?
答:仪器最大事件发生率为 10,000 个 / 秒,高纯度分选建议控制在 2,500 个 / 秒。
Q12:流式分选的最高纯度是多少?受哪些因素影响?
答:最高可达 99%-100%,分群清晰的细胞群通常可实现 95%-100% 纯度。纯度主要依赖仪器稳定性和分选门设置(需与研究者共同确认门控策略)。
Q13:能否进行无菌分选并培养分选后的细胞?
答:可以。建议将分选细胞分至多个培养瓶,降低单瓶污染导致的样本损失风险。
Q14:能否分选占比 < 1% 的稀有细胞群?是否需要预富集?
答:可进行稀有事件分选,但纯度和得率较低。建议优先通过浓缩分选或其他方法预富集目标细胞。
Q15:加入碘化丙啶(PI)排除死细胞是否会对活细胞产生毒性?
答:低浓度 PI 可用于活细胞分选(死细胞染色阳性)。PI 通过被动结合死细胞 DNA 发挥作用,对活细胞毒性可忽略,且可通过洗涤去除。7-AAD 等死活鉴别染料同理。
Q16:FACStar 流式细胞仪支持多少参数同时分选?
答:当前可支持 6 参数分选:4 个荧光参数、前向散射(FSC)和侧向散射(SSC)。未来可能增加荧光面积 / 宽度、参数比例等分选维度。
Q17:如何验证分选细胞的纯度?
答:对分选后的细胞重新上样,通过流式细胞仪分析目标细胞占比。
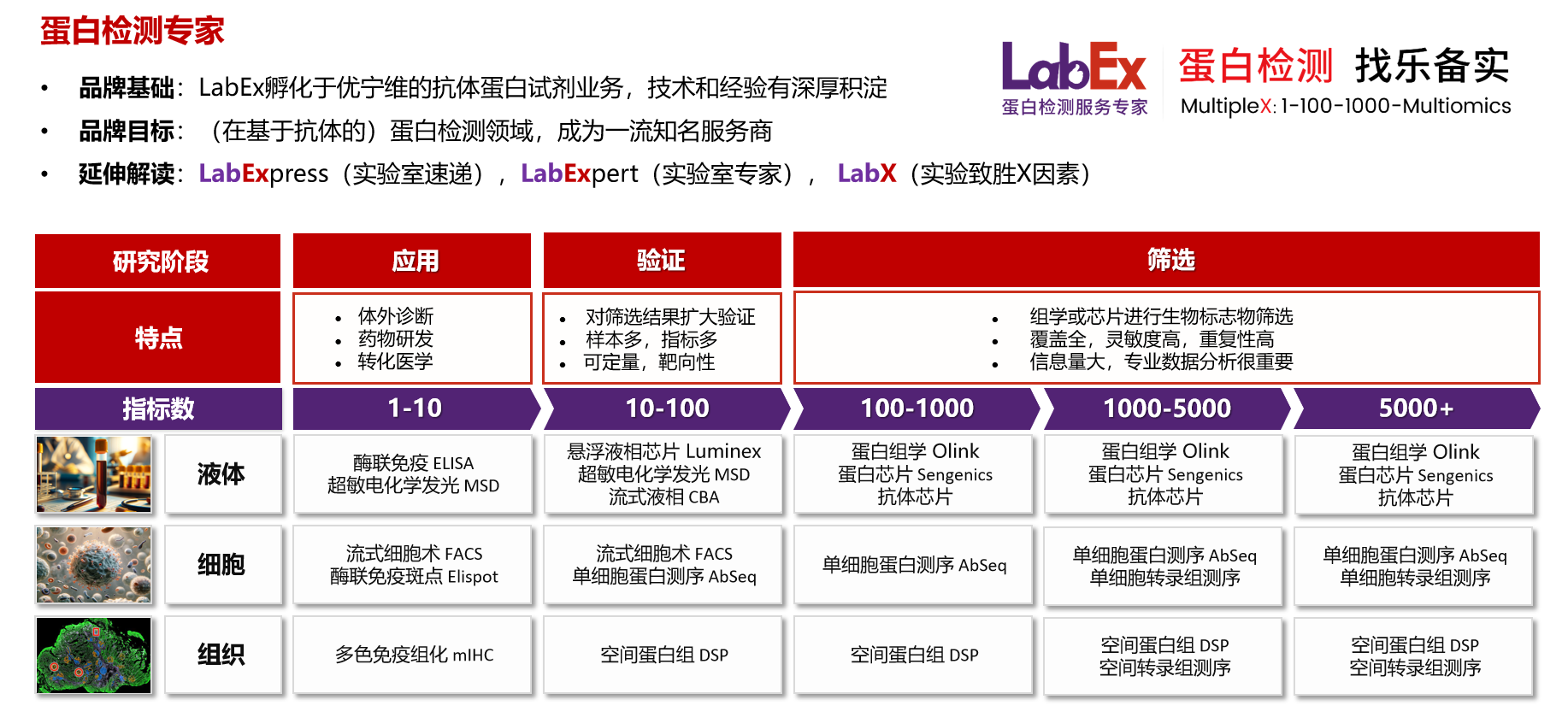
乐备实是国内专注于提供高质量蛋白检测以及组学分析服务的实验服务专家,自2018年成立以来,乐备实不断寻求突破,公司的服务技术平台已扩展到单细胞测序、空间多组学、流式检测、超敏电化学发光、Luminex多因子检测、抗体芯片、PCR Array、ELISA、Elispot、多色免疫组化等30多个,建立起了一套涵盖基因、蛋白、细胞以及组织水平实验的完整检测体系。
我们可提供从样本运输、储存管理、样本制备、样本检测到检测数据分析的全流程服务。凭借严格的实验室管理流程、标准化实验室操作、原始数据储存体系以及实验项目管理系统,已经为超过3000家客户单位提供服务,年检测样本超过100万,受到了广大客户的信任与支持。











 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


