摘要
精原干细胞(SSCs)的自我更新与定向分化平衡是哺乳动物持续精子发生的核心基础。维甲酸(RA)作为维生素 A 的活性代谢形式,是调控 SSCs 分化及减数分裂启动的关键信号分子。本文综述了 RA 在睾丸中的代谢规律、其对 SSCs 分化的具体作用,以及通过 RA-KIT、RA-STRA8、RA-Rec8 等信号通路调控分化的分子机制,最后总结当前研究局限并展望未来方向,为阐明精子发生调控机制及男性生殖疾病研究提供参考。
1 前言
精子发生是 SSCs 经增殖、减数分裂及形态重塑最终形成成熟精子的复杂过程,而 SSCs 在自我更新维持干细胞库与分化启动生精程序间的平衡,依赖于睾丸微环境的精密调控 。作为微环境中的核心调控因子,RA 的作用已得到明确:维生素 A 缺乏(VAD)小鼠的生殖细胞阻滞于未分化阶段,而外源性 RA 可驱动其同步进入分化 。尽管 RA 诱导 SSCs 分化的核心作用已被证实,但其下游信号网络及时空调控机制仍有待深入解析。本文系统梳理 RA 调控 SSCs 分化的研究进展,为理解精子发生的分子机制提供理论基础。
2 精子发生与 SSCs 分化的生物学基础
精子发生始于曲细精管基底膜上的 SSCs,历经三个核心阶段:精原细胞增殖、精母细胞减数分裂及精子形成。SSCs 通过不对称分裂产生两种子代细胞:一种维持干细胞特性(自我更新),另一种进入分化程序(定向分化)。在小鼠中,未分化精原细胞包括单个 A 型(As)、成对 A 型(Apr)及链状 A 型(Aal),其中 As 被普遍认为是 SSCs 的主要来源;分化阶段则依次形成 A1-A4 型、中间型(In)及 B 型精原细胞,最终 B 型精原细胞启动减数分裂,经初级精母细胞、次级精母细胞发育为单倍体精子细胞 。
SSCs 的命运决定高度依赖微环境(niche)的调控。支持细胞作为微环境的核心组分,可分泌胶质细胞源性神经营养因子(GDNF)维持 SSCs 自我更新,同时合成 RA 驱动其分化 ;间质细胞分泌的睾酮及管周肌样细胞的旁分泌信号也参与调控网络 [6]。血睾屏障将生精上皮分隔为基底室(容纳未分化精原细胞)与近腔室(支持减数分裂及精子形成),这种空间划分与 RA 的时空分布协同,确保精子发生的有序进行 。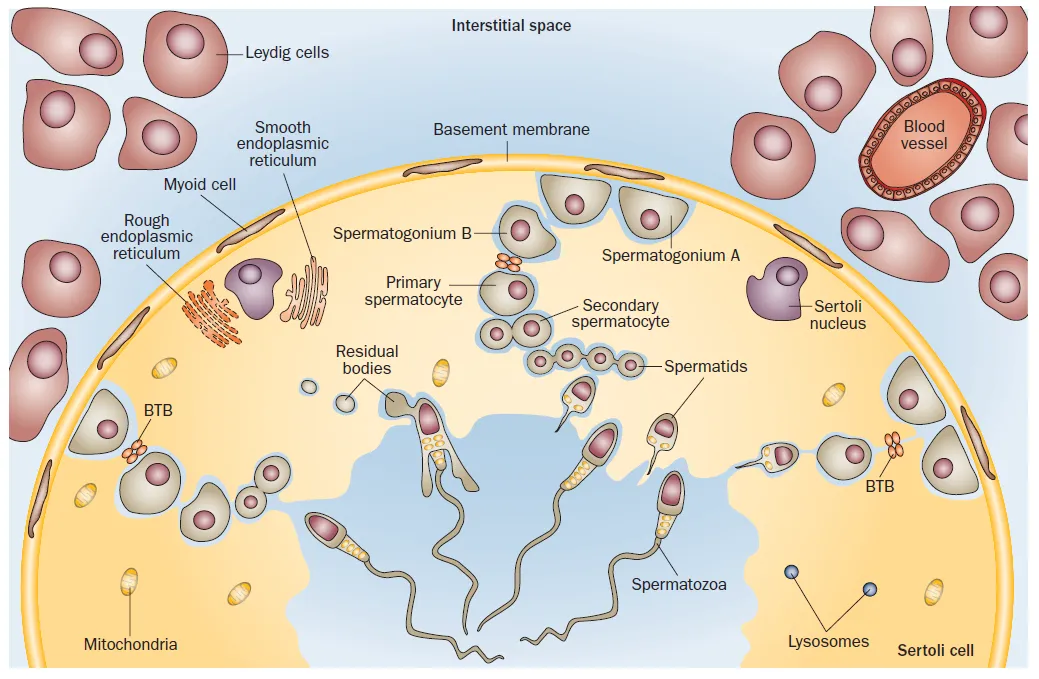

3 维甲酸的代谢特征及其在睾丸中的动态调控
3.1 RA 的合成与降解途径
RA 是维生素 A(视黄醇)经两步氧化的活性产物:视黄醇先经醇脱氢酶(ADH)或视黄醇脱氢酶 10(RDH10)转化为视黄醛,再由视黄醛脱氢酶(RALDHs)催化生成 RA 。RALDH 家族中,ALDH1A1、ALDH1A2、ALDH1A3 是 RA 合成的关键酶,其中支持细胞主要通过 ALDH1A1 合成 RA,而生精细胞则依赖 ALDH1A2 。RA 的降解由细胞色素 P450 家族(CYP26A1、CYP26B1、CYP26C1)介导,其中 CYP26B1 在睾丸中起主导作用,通过及时降解 RA 避免信号过度激活 。
3.2 RA 的周期性浓度变化
睾丸中 RA 浓度呈现与生精上皮周期同步的动态波动:生精周期 I-VI 期,因 RALDHs 表达较低,RA 维持低水平;VII-VIII 期,ALDH1A1 活性激增使 RA 浓度达峰值,此时恰好发生 Aal 向 A1 精原细胞的分化转变;VIII-XI 期,CYP26B1 高表达降解 RA,使其浓度回落 。这种周期性变化与 SSCs 分化、减数分裂启动的时空需求高度吻合,提示 RA 是精子发生的 “时间调控器”。
4 RA 对 SSCs 分化的调控作用
4.1 驱动未分化精原细胞向分化表型转变
RA 是 SSCs 分化的 “开关” 分子。VAD 模型中,未分化精原细胞(As、Apr、Aal)无法向 A1 型转化,生精过程停滞;补充 RA 可快速激活分化程序,使精原细胞同步表达分化标志物 。基因敲除实验进一步证实:特异性敲除支持细胞中 RALDHs(如 Aldh1a1-/-)会导致 RA 合成缺陷,SSCs 分化完全阻滞,表型与 VAD 小鼠一致,而外源性 RA 可逆转该表型。体外实验也显示,RA 可诱导培养的未分化精原细胞表达 Kit、Stra8 等分化相关基因,证明其直接调控作用 。
4.2 启动生殖细胞减数分裂
RA 是减数分裂启动的核心诱导因子。在 RA 作用下,前细线期精母细胞表达减数分裂关键基因 Stra8,进而激活 Sycp3(联会复合体组分)、Dmc1(重组酶)等下游分子,推动同源染色体联会与重组 。Stra8 敲除小鼠中,生殖细胞无法进入减数分裂前期,证实其必要性 。值得注意的是,RA 对减数分裂的诱导具有细胞特异性:仅作用于处于 “感受态” 的生殖细胞(如 A1 型精原细胞向初级精母细胞转化阶段),这种特异性可能与细胞周期状态及 RA 受体(RARs)表达模式相关 。
5 RA 调控 SSCs 分化的分子机制
5.1 RA-KIT 信号轴
原癌基因 c-Kit(酪氨酸激酶受体)是 SSCs 分化的关键标志物,其表达受 RA 多层级调控。在转录水平,RA 通过 RAR/RXR 异二聚体结合 Kit 启动子区域的 RA 反应元件(RARE),直接激活转录;同时,RA 诱导 SALL4A、SOHLH1/2 等转录因子表达,协同增强 Kit 启动子活性 。在翻译水平,RA 通过激活 PI3K/AKT/mTOR 通路磷酸化 4E-BP1,解除其对 eIF4E 的抑制,促进 Kit mRNA 高效翻译;此外,RA 下调 miR-221/222(Kit mRNA 的负调控因子),进一步增强翻译效率 。Kit 与其配体 SCF 结合后,激活下游 MAPK/ERK 通路,最终推动 Aal 向 A1 精原细胞的形态与功能转变 。
5.2 RA-STRA8 信号轴
Stra8 是 RA 直接靶基因,其启动子含典型 RARE,可被 RAR/RXR 异二聚体识别并激活 。RA 诱导的 Stra8 表达具有严格的时空特征:生精周期 VII 期 RA 峰值时,Stra8 在 A1 型精原细胞中剧烈上调,随后在减数分裂前期持续高表达 。除经典核受体途径外,RA 还可通过非经典通路调控 Stra8:激活 ERK1/2 激酶磷酸化 ELK1 等转录因子,增强 Stra8 启动子活性,这种非经典途径在胎儿生殖细胞减数分裂启动中尤为重要 。
5.3 RA-Rec8 通路的独立调控
减数分裂重组蛋白 Rec8 是 RA 的另一靶标,其表达与 Stra8 同步但调控机制独立。Rec8 作为 cohesion 复合物组分,维持姐妹染色单体黏连,确保减数分裂 I 期同源染色体正确分离 。RA 通过 RARγ 介导的转录激活诱导 Rec8 表达,且该过程不依赖 Stra8(Stra8-/- 小鼠中 Rec8 仍可被 RA 诱导)。这提示 RA 通过平行通路调控减数分裂的关键事件,体现其调控网络的复杂性。
6 小结与展望
RA 通过调控 KIT、STRA8、Rec8 等关键分子,经转录激活、翻译调控及信号通路交叉对话,在 SSCs 分化及减数分裂启动中发挥核心作用。然而,现有研究仍存在诸多待解问题:RA 在生精周期中的时空分布如何被精确调控(如支持细胞与生精细胞合成 RA 的协同机制);RA 与 GDNF 等因子的拮抗平衡(维持 SSCs 自我更新与分化)的分子基础;以及 RA 信号异常与男性不育(如无精症)的关联机制。
乐备实是国内专注于提供高质量蛋白检测以及组学分析服务的实验服务专家,自2018年成立以来,乐备实不断寻求突破,公司的服务技术平台已扩展到单细胞测序、空间多组学、流式检测、超敏电化学发光、Luminex多因子检测、抗体芯片、PCR Array、ELISA、Elispot、多色免疫组化等30多个,建立起了一套涵盖基因、蛋白、细胞以及组织水平实验的完整检测体系。
我们可提供从样本运输、储存管理、样本制备、样本检测到检测数据分析的全流程服务。凭借严格的实验室管理流程、标准化实验室操作、原始数据储存体系以及实验项目管理系统,已经为超过3000家客户单位提供服务,年检测样本超过100万,受到了广大客户的信任与支持。











 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


