一、信号通路的生物学意义
TGFβ/SMAD通路的定义是什么?是细胞传递信号的关键通路,调节细胞增殖与分化。转化生长因子 β(Transforming Growth Factor-β,TGF-β)超家族作为一类高度保守的细胞因子家族,在多细胞生物的生长发育、组织稳态维持及疾病发生发展中发挥着至关重要的调控作用。该家族信号通路通过精准的分子调控网络,参与细胞增殖、分化、凋亡、迁移及胞外基质形成等多种生物学过程,其信号转导的异常与肿瘤发生、纤维化疾病、心血管疾病及骨骼发育异常等多种病理状态密切相关。TGF-β/Smad 信号通路作为该超家族中研究最为深入的信号转导途径之一,其分子机制的解析为理解生命活动的调控规律及相关疾病的防治提供了重要理论基础。
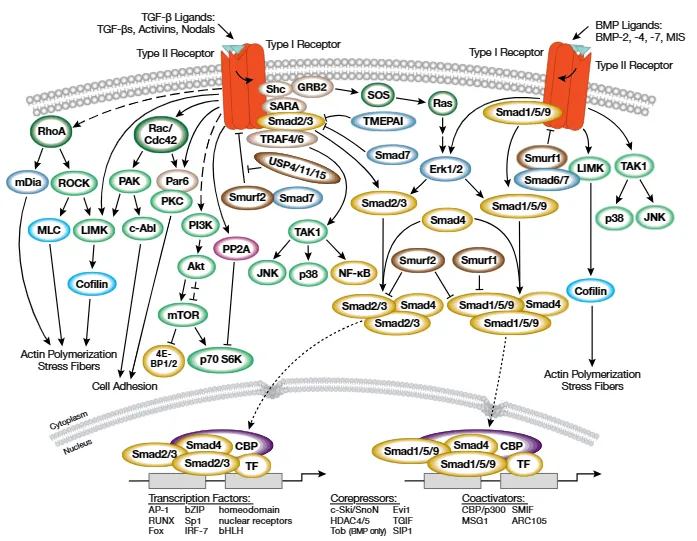
二、信号通路的起始与核心分子激活
TGF-β 超家族信号转导的起始依赖于配体与细胞膜表面受体的特异性结合。当配体(如 TGF-β、活化素或骨形态发生蛋白 BMP 等)与相应受体结合后,会诱导丝氨酸 / 苏氨酸受体激酶发生寡聚化构象变化,进而激活受体的激酶活性。在 TGF-β/ 活化素通路中,活化的受体可特异性磷酸化胞浆内的信号转导分子 Smad2 和 Smad3;而在 BMP 通路中,受体则选择性磷酸化 Smad1、Smad5 和 Smad9(此类 Smads 因直接被受体磷酸化而称为受体调控 Smads,即 R-Smads)。
R-Smads 的磷酸化位点位于其羧基端的保守丝氨酸残基,这一修饰是启动下游信号转导的关键事件。磷酸化后的 R-Smads 分子构象发生改变,使其能够与共同信号转导因子 Smad4(又称共同通路 Smad,Co-Smad)形成稳定的异源多聚体复合物。该复合物通过核孔复合体转运进入细胞核,从而将胞外信号传递至核内,启动转录调控过程。
三、信号通路的负反馈调节机制
为避免信号过度激活导致细胞功能紊乱,TGF-β/Smad 信号通路存在精密的负反馈调节机制,其中抑制性 Smads(I-Smads)发挥核心作用。Smad6 和 Smad7 作为典型的 I-Smads,可通过多种方式拮抗 R-Smads 的激活:一方面,它们可直接与活化的受体结合,阻断受体对 R-Smads 的磷酸化;另一方面,它们能与 R-Smads 竞争结合 Smad4,抑制功能性复合物的形成。
值得注意的是,I-Smads 的表达本身受 TGF-β/ 活化素和 BMP 信号的诱导,形成一个典型的负反馈调节回路。当通路激活时,I-Smads 表达增加,从而抑制信号的持续传导;当信号减弱时,I-Smads 的表达随之降低,确保通路能够对新的信号刺激做出响应。这种动态平衡机制是维持细胞内环境稳定的重要保障。
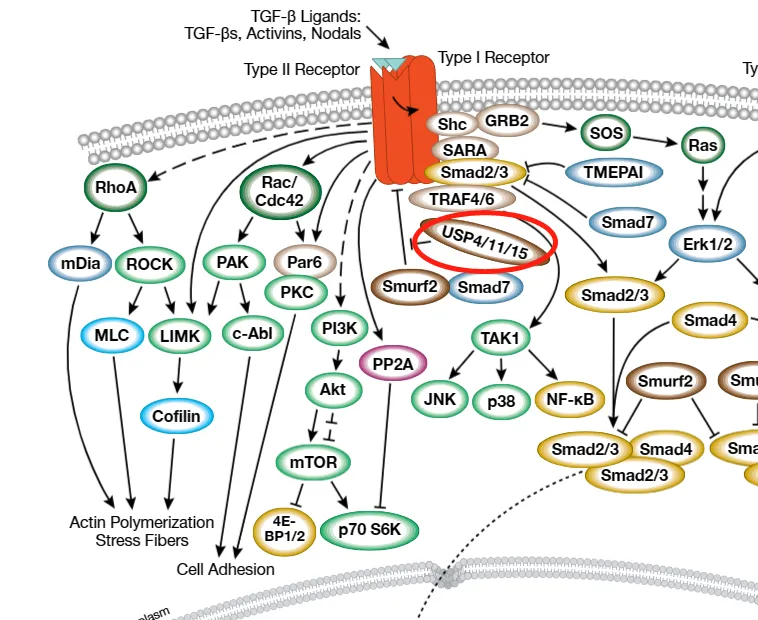
四、信号通路的交叉调控与扩展机制
TGFβ/SMAD通路的功能有哪些?调控细胞生长、分化、凋亡及免疫应答等过程。TGF-β/Smad 信号通路并非孤立存在,而是与其他细胞信号通路存在广泛的交叉调控。在分子稳定性调控方面,Smurf 家族 E3 泛素连接酶可通过介导 TGF-β 家族受体及 Smads 的泛素化修饰促进其降解,而 USP4、USP11 和 USP15 等去泛素化酶则通过去除泛素链修饰维持这些分子的稳定性,二者共同调控通路关键分子的蛋白水平。
此外,MAPK 信号通路(如 Erk、p38 和 JNK 等)可在多个水平调节 TGF-β/ 活化素和 BMP 通路的活性,例如通过磷酸化 Smads 或受体分子改变其功能活性。在某些生理或病理条件下,TGF-β 信号还可激活 Smad 非依赖通路,包括 Erk、SAPK/JNK 和 p38 MAPK 通路,进一步扩展了其生物学效应。
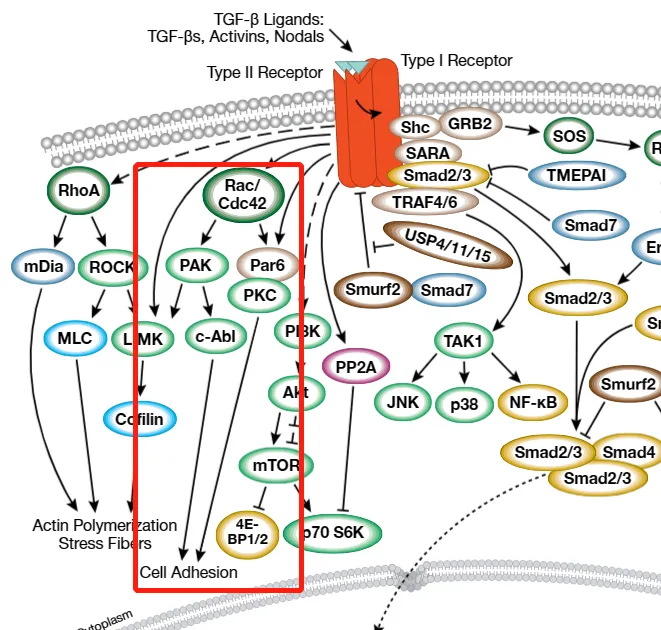
同时, Rho 家族 GTPase(如 RhoA、Cdc42 和 Rac)通过调节细胞骨架重构和细胞黏附等过程参与 TGF-β 信号的调控。例如,RhoA 可通过下游靶蛋白 mDia 和 ROCK 影响细胞伸展与生长;Cdc42/Rac 则通过 PAK、PKC 和 c-Abl 等效应器激酶调节细胞黏附状态,间接影响 TGF-β 信号的激活效率。这些交叉调控机制使 TGF-β/Smad 信号能够整合多种细胞外信号,精确调控细胞的生物学行为。
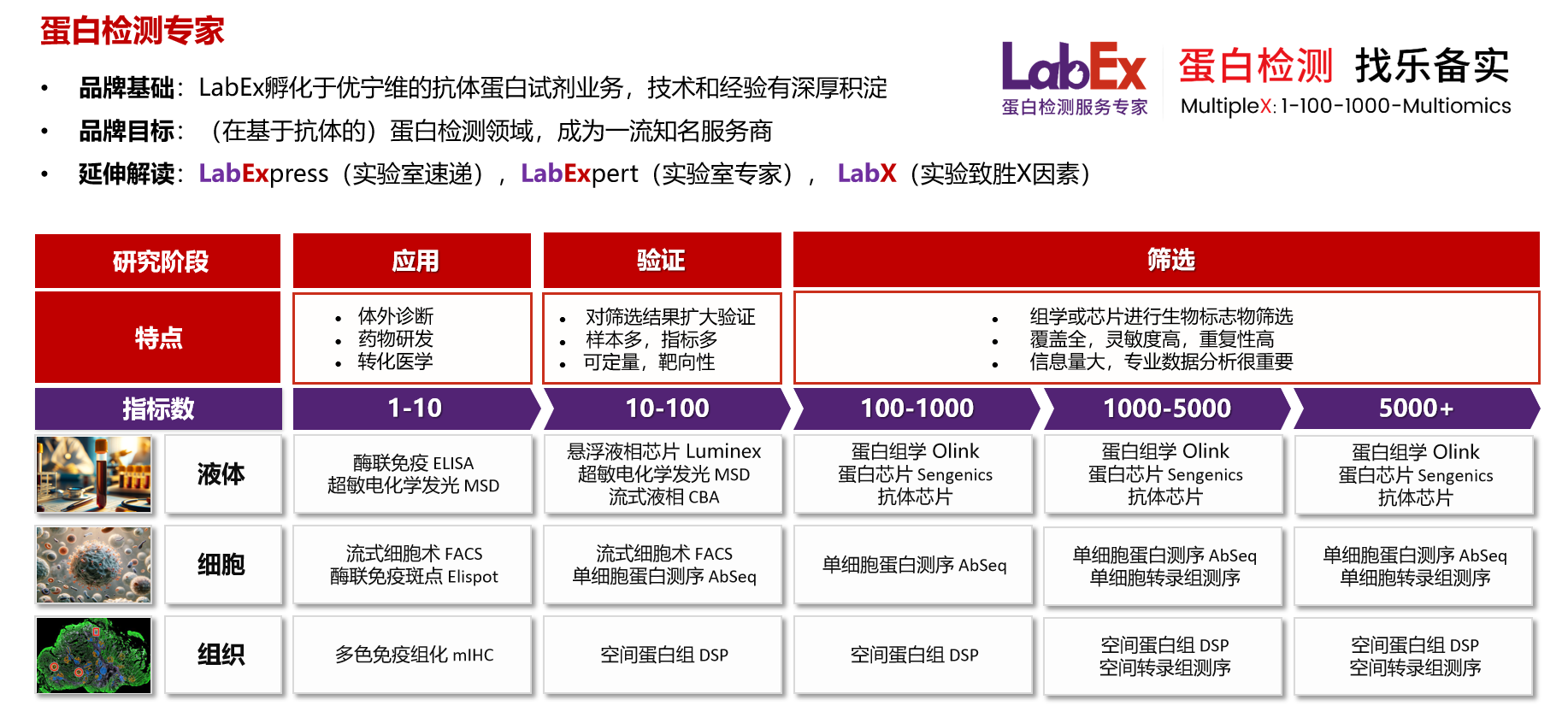
乐备实是国内专注于提供高质量蛋白检测以及组学分析服务的实验服务专家,自2018年成立以来,乐备实不断寻求突破,公司的服务技术平台已扩展到单细胞测序、空间多组学、流式检测、超敏电化学发光、Luminex多因子检测、抗体芯片、PCR Array、ELISA、Elispot、多色免疫组化等30多个,建立起了一套涵盖基因、蛋白、细胞以及组织水平实验的完整检测体系。
我们可提供从样本运输、储存管理、样本制备、样本检测到检测数据分析的全流程服务。凭借严格的实验室管理流程、标准化实验室操作、原始数据储存体系以及实验项目管理系统,已经为超过3000家客户单位提供服务,年检测样本超过100万,受到了广大客户的信任与支持。











 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


