一、引言
细胞死亡是维持机体稳态的重要机制。近年来,研究发现多种细胞死亡方式,包括铁死亡、坏死性凋亡和焦亡等新型细胞死亡模式,其分子机制在肿瘤发生发展和治疗中的作用日益凸显。本综述系统阐述这三种程序性细胞死亡途径的分子机制及其在免疫介导的肿瘤清除中的作用,并探讨靶向细胞死亡通路与免疫治疗联合策略的潜在价值。
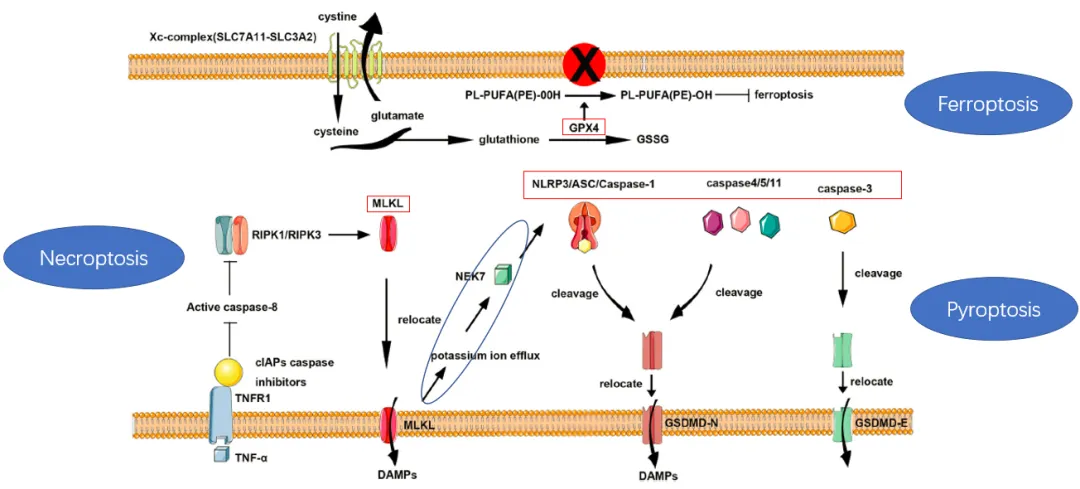
二、细胞死亡方式的分子机制
(一)铁死亡的调控机制
铁死亡是一种铁依赖性、脂质过氧化驱动的细胞死亡形式。其发生主要与以下通路相关:
Xc⁻系统负责胱氨酸摄取,用于合成谷胱甘肽(GSH)。GPX4利用GSH还原脂质过氧化物,抑制ROS积累。铁代谢紊乱通过芬顿反应促进脂质过氧化,诱发铁死亡。这一过程体现了细胞死亡与免疫微环境的密切关系。
(二)焦亡的分子通路
焦亡是炎症性程序性细胞死亡,主要通过以下通路激活:
经典炎症小体通路(NLRP3/ASC/caspase-1/GSDMD)和非经典通路(caspase-4/5/11/GSDMD)均可切割GSDMD,形成膜孔道。Caspase-3/GSDME通路也可诱导焦亡,为细胞死亡靶向治疗提供新思路。
(三)坏死性凋亡的信号传导
坏死性凋亡是受调控的坏死样细胞死亡。当caspase-8活性被抑制时,TNF-α刺激促使RIPK1-RIPK3-MLKL信号复合物组装。磷酸化MLKL易位至质膜引发膜损伤,导致细胞内容物释放和炎症反应,这种细胞死亡免疫原性为肿瘤治疗提供新靶点。
三、细胞死亡方式与抗肿瘤免疫的相互作用
(一)坏死性凋亡与免疫应答
研究表明,癌细胞中RIPK3表达下调与其不良预后相关。坏死性凋亡细胞释放DAMPs(如HMGB1、ATP),促进树突细胞成熟和抗原呈递,激活T细胞免疫应答,这为细胞死亡诱导疗法提供依据。
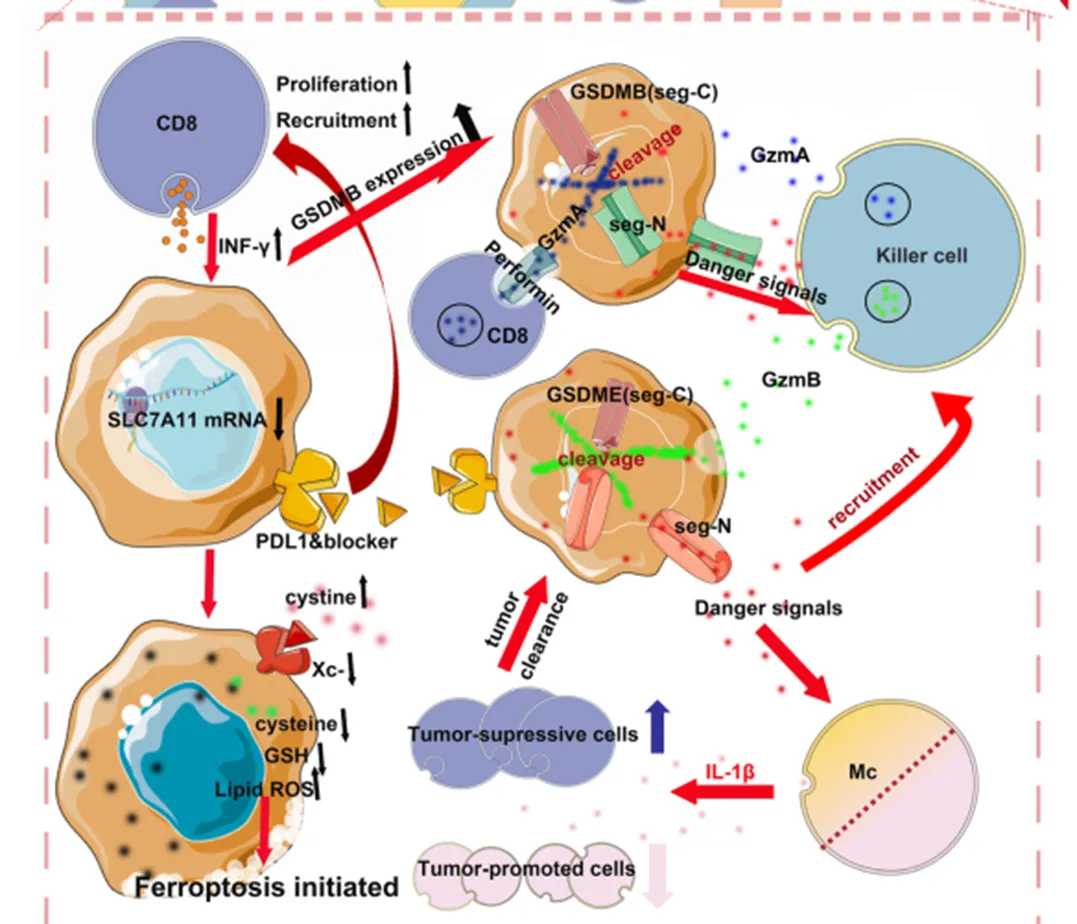
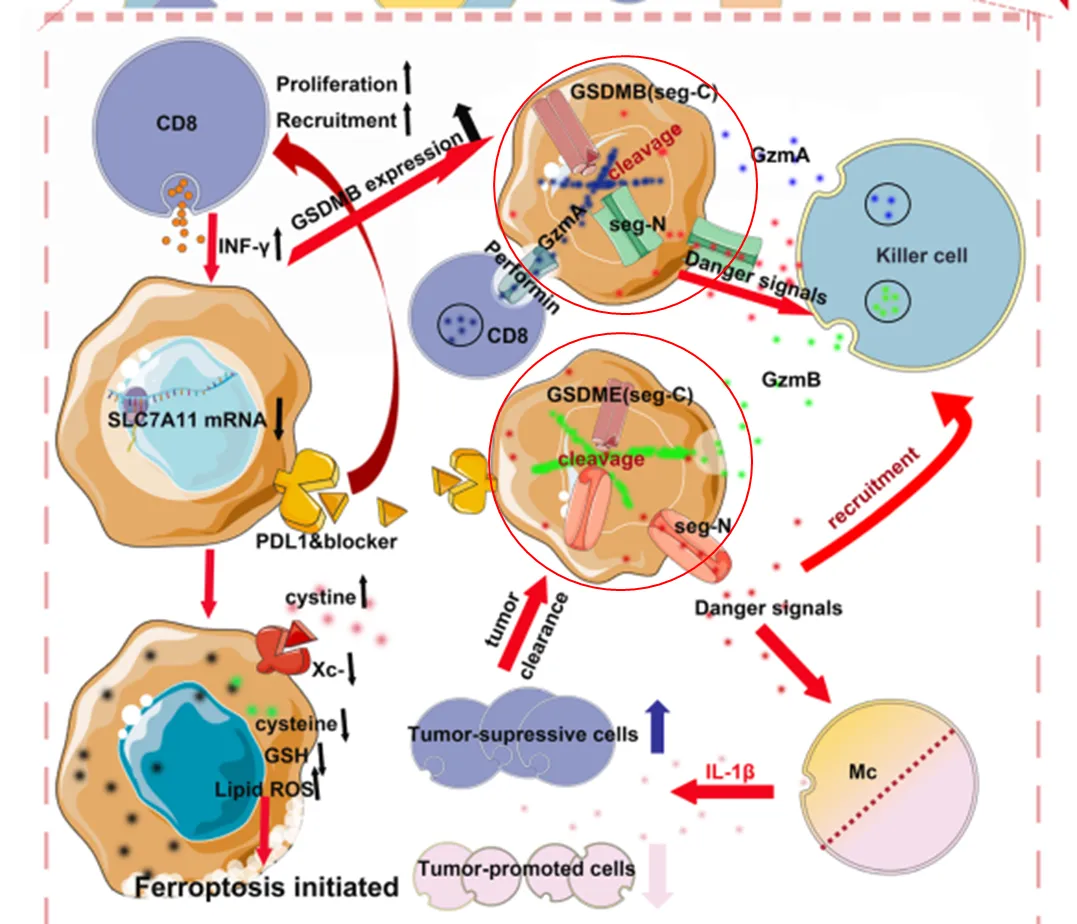
(二)铁死亡与免疫系统
CD8⁺ T细胞通过分泌IFN-γ抑制SLC7A11表达,增强肿瘤细胞对铁死亡的敏感性。STAT1缺失可逆转该效应,表明T细胞驱动的铁死亡是免疫治疗的重要效应机制。
(三)焦亡与免疫激活
焦亡细胞释放IL-1β、IL-18等炎性因子,强烈激活免疫反应。即使少量肿瘤细胞发生焦亡,也足以激发免疫系统清除整个肿瘤。免疫细胞通过分泌颗粒酶诱导肿瘤细胞焦亡,而焦亡微环境中细胞毒性免疫细胞浸润增加,MDSCs减少,这种细胞死亡表型分析为治疗评估提供重要指标。
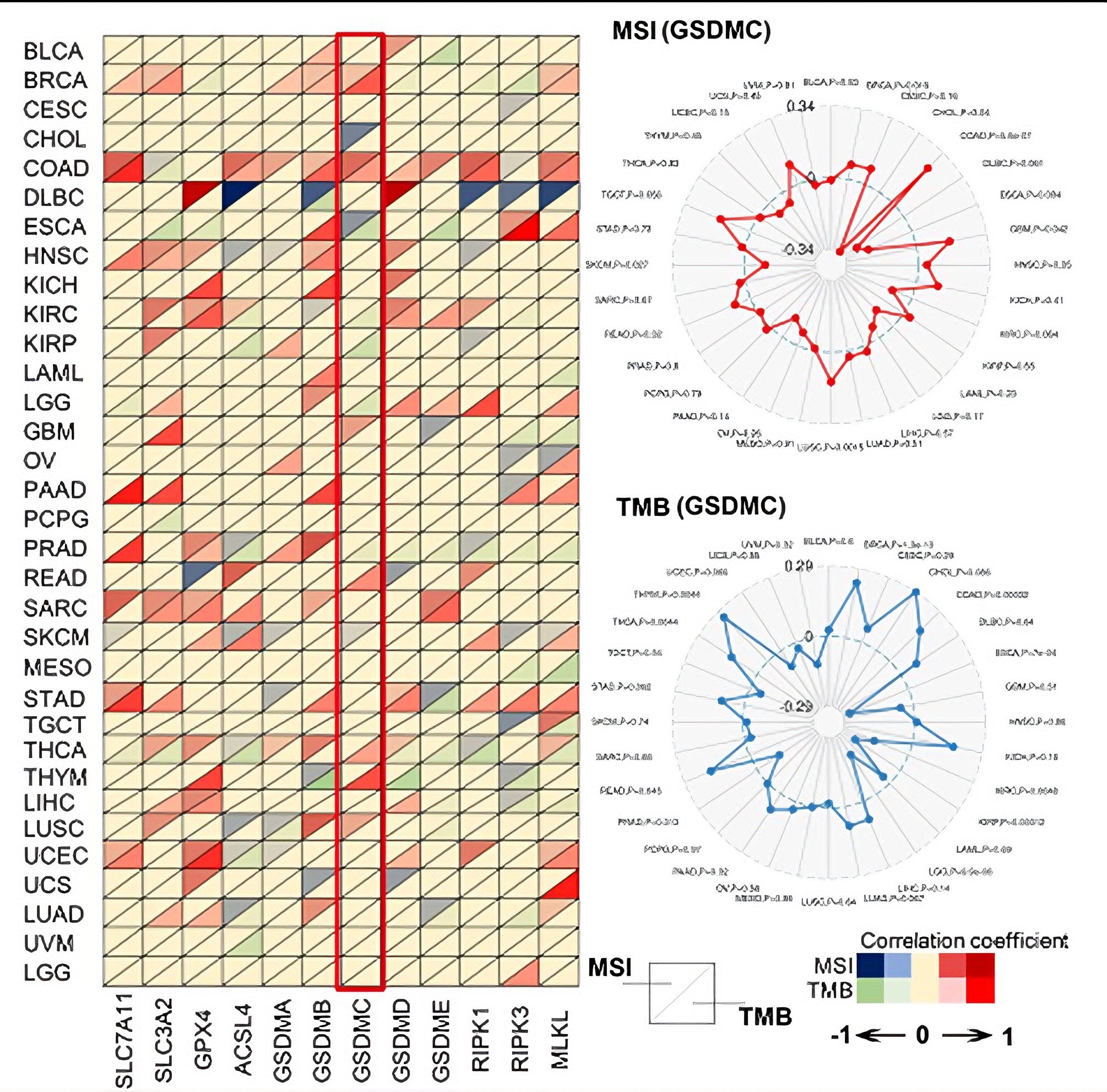
四、靶向治疗与联合策略
诱导铁死亡、坏死性凋亡或焦亡的药物与免疫检查点抑制剂联用展现协同潜力。通过TIDE评分、CD8⁺ T细胞浸润等生物信息学分析证实,这些死亡通路相关基因的表达与免疫治疗响应正相关,这些细胞死亡生物标志物为精准医疗提供工具。探索细胞死亡通路交互关系将成为未来重要研究方向。
五、总结与展望
多种细胞死亡方式与免疫系统存在复杂对话,不仅直接杀伤肿瘤细胞,更通过调节肿瘤微环境增强抗肿瘤免疫。诱导免疫原性细胞死亡成为有前景的治疗策略,但开发高效、特异性靶向药物仍面临挑战。未来研究应聚焦于细胞死亡方式调控机制、特异性诱导化合物的开发,以及基于细胞死亡标志物的临床预测模型建立,为肿瘤治疗提供新策略。
乐备实是国内专注于提供高质量蛋白检测以及组学分析服务的实验服务专家,自2018年成立以来,乐备实不断寻求突破,公司的服务技术平台已扩展到单细胞测序、空间多组学、流式检测、超敏电化学发光、Luminex多因子检测、抗体芯片、PCR Array、ELISA、Elispot、PLA蛋白互作、多色免疫组化、DSP空间多组学等30多个,建立起了一套涵盖基因、蛋白、细胞以及组织水平实验的完整检测体系。
我们可提供从样本运输、储存管理、样本制备、样本检测到检测数据分析的全流程服务。凭借严格的实验室管理流程、标准化实验室操作、原始数据储存体系以及实验项目管理系统,已经为超过3000家客户单位提供服务,年检测样本超过100万,受到了广大客户的信任与支持。












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


