泛素化修饰是一种广泛存在于真核细胞中的蛋白质翻译后修饰过程,在调控多种关键生命活动中扮演核心角色,包括但不限于蛋白质降解、细胞内吞作用、细胞周期进程以及免疫应答等。该过程依赖于三酶级联反应体系,即E1(激活酶)、E2(结合酶)和E3(连接酶)的顺序作用,并以ATP与镁离子作为必需辅因子。在此系统中,泛素(ubiquitin)的C末端甘氨酸通过异肽键共价连接至底物蛋白的赖氨酸残基上,形成单泛素化或多聚泛素链,进而决定靶蛋白的命运。
长期以来,研究者普遍认为所有泛素化修饰——无论是宿主细胞内源性发生的,还是病原体介入的——均严格依赖上述E1-E2-E3级联机制。这一经典框架为理解泛素化在细胞信号转导和质量控制中的功能奠定了基础。
病原菌对宿主泛素化系统的干预策略
在与宿主长期共进化的过程中,多种病原微生物发展出复杂机制以干预宿主的泛素化修饰系统,从而增强其侵染能力并逃逸免疫识别。其中尤为值得注意的是,某些病原菌分泌的效应蛋白可模拟或操纵宿主的泛素化过程。例如,一部分效应蛋白本身具有E3连接酶或去泛素化酶(deubiquitinase, DUB)活性,通过这些活性直接改写宿主的泛素化状态。
然而,在2016年,一项突破性研究改变了人们对泛素化修饰机制的固有认知。普渡大学罗招庆课题组在《Nature》杂志报道了来自嗜肺军团菌(Legionella pneumophila)的一类新型泛素化修饰酶家族——SidE家族(包括SidE、SdeA、SdeB和SdeC),该家族催化泛素化修饰的过程完全不依赖于经典的E1-E2-E3酶级联反应。
SidE家族介导的非经典泛素化修饰机制
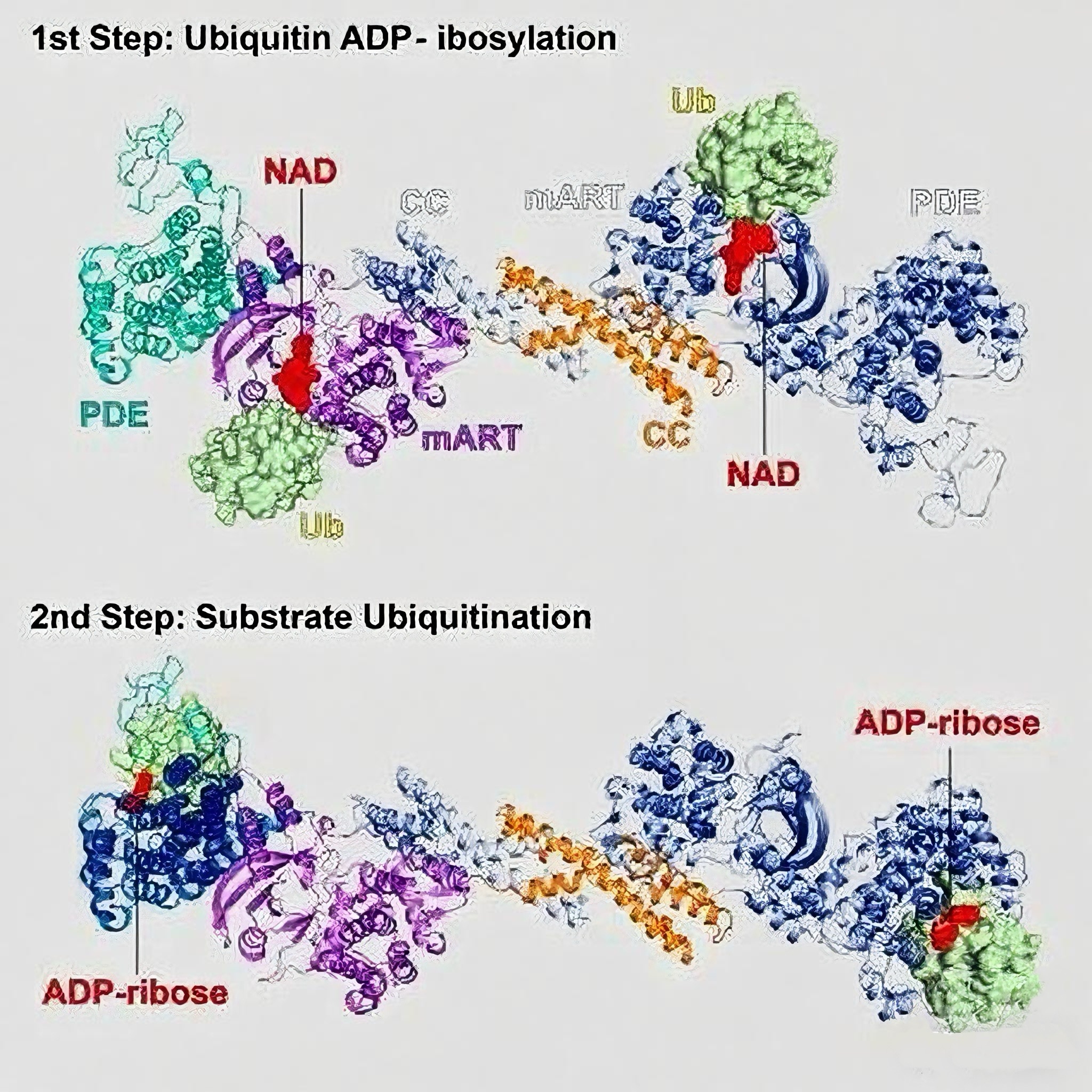
SidE家族蛋白具有多结构域架构,从其N端到C端依次为:去泛素化酶(DUB)结构域、磷酸二酯酶(PDE)结构域、单ADP-核糖基转移酶(mART)结构域和 coiled-coil(CC)结构域。研究揭示,该家族蛋白可通过单一多肽链完成对宿主蛋白的泛素化修饰,其机制与经典途径截然不同。
该修饰过程分为两个连续的酶促反应步骤:首先,mART结构域以NAD⁺作为底物,将其ADP-核糖基团转移至泛素分子第42位精氨酸(Arg42)上,生成ADP-核糖化泛素(ADPr-Ub);随后,PDE结构域切割ADPr-Ub中的磷酸二酯键,产生磷酸核糖化泛素(Pr-Ub),并将Pr-Ub共价连接至底物蛋白的丝氨酸残基。这种修饰方式不仅扩展了泛素化的化学类型,也揭示了非经典泛素化修饰机制在病原体-宿主互作中的重要作用。
尽管如此,mART结构域如何特异性识别并结合泛素,以及PDE结构域如何水解ADPr-Ub并完成丝氨酸连接的分子细节,在当时仍属未知。
对SidE催化机制的结构生物学阐释
2018年5月3日,一项在《Cell》上发表的重要研究通过解析SidE蛋白与泛素及各类配体的多个复合物晶体结构,揭示了这一非经典泛素化酶的作用机制。
该研究成功解析了SidE处于多种状态下的高分辨率结构,包括未结合底物的apo状态、mART结构域与泛素及NAD的复合物状态(对应第一步反应),以及PDE结构域与泛素及ADP-核糖的复合物状态(对应第二步反应)。SidE的apo结构显示,其mART和PDE结构域在空间上相距较远,催化中心朝向各异,表明两者在功能上相对独立。然而,这两个结构域之间又通过一段保守序列发生紧密互作,这种相互作用对于维持它们的催化活性至关重要。
在mART–Ub–NAD复合物结构中,泛素主要通过其C末端尾部与mART表面一个高度保守区域结合,其中精氨酸Arg72和Arg74嵌入mART一侧的酸性口袋中,起到稳定过渡态的作用。NAD分子的烟酰胺基团则指向泛素的Arg42,为修饰该残基提供几何基础。尽管Arg72在空间上也接近反应中心,生化实验证实只有Arg42是实际修饰位点,说明Arg72可能主要起支架作用,协助稳定催化微环境。
另一方面,PDE–Ub–ADP-核糖复合物结构表明,泛素分子结合于PDE催化口袋的一侧,其Lys6–Thr9区域和His68是主要互作残基。与之前通过同源建模推测的结合模式不同,这一真实结构揭示了PDE与配体之间新颖的结合方式,凸显了结构生物学在分子机制研究中的不可替代性。
通过系统性的点突变实验,研究验证了参与催化及泛素结合的关键残基。值得注意的是,突变mART或PDE中与其各自功能相关的残基,只会影响对应步骤的催化活性,进一步支持了“两步骤相互独立”的模型。此外,该研究还阐明了为何泛素C末端甘氨酸对SidE活性非必需,以及多种连接类型的双泛素(如Lys63、Lys48、Lys11和Met1)也能够被SidE有效修饰
底物识别特性与工具开发潜力
除了结构机制的揭示,该研究还发现SidE家族蛋白对底物的识别不依赖于特定三维结构或序列模体。只要底物蛋白表面存在可进入其催化口袋的丝氨酸残基,即可能发生泛素化修饰。这一宽泛的底物选择性为开发新型蛋白质功能调控工具提供了分子基础,未来或可基于此设计出用于特定丝氨酸修饰的泛素化酶工程化应用工具。
总结与展望
SidE家族的发现及其催化机制的阐明,不仅突破了对泛素化修饰的传统认知,也展示了病原菌效应蛋白在干预宿主信号转导中的进化创新性。该非经典泛素化路径为研究蛋白质翻译后修饰的化学与功能多样性提供了新范式,同时在技术和工具开发方面展现出广阔前景。进一步解析其调控机制及病理意义,将深化我们对感染生物学和免疫调节的理解。
乐备实是国内专注于提供高质量蛋白检测以及组学分析服务的实验服务专家,自2018年成立以来,乐备实不断寻求突破,公司的服务技术平台已扩展到单细胞测序、空间多组学、流式检测、超敏电化学发光、Luminex多因子检测、抗体芯片、PCR Array、ELISA、Elispot、多色免疫组化等30多个,建立起了一套涵盖基因、蛋白、细胞以及组织水平实验的完整检测体系。
我们可提供从样本运输、储存管理、样本制备、样本检测到检测数据分析的全流程服务。凭借严格的实验室管理流程、标准化实验室操作、原始数据储存体系以及实验项目管理系统,已经为超过3000家客户单位提供服务,年检测样本超过100万,受到了广大客户的信任与支持。












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


