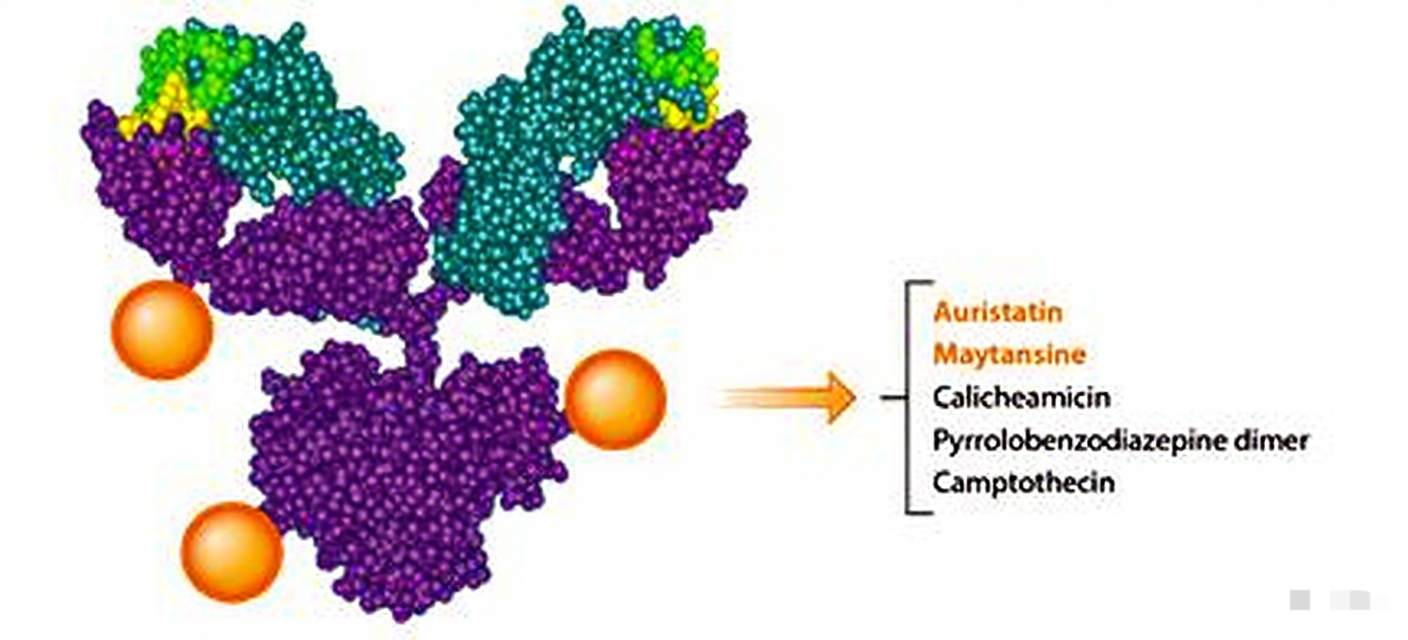
一、ADC药物技术概述
抗体-药物偶联物是通过化学连接子将高效细胞毒性药物与特异性单克隆抗体共价结合的新型靶向治疗药物。其设计理念基于抗体的靶向识别能力,能够选择性将细胞毒性药物递送至肿瘤细胞,在提高疗效的同时显著降低系统性毒性。ADC药物由三个核心组成部分构成:特异性靶向抗体、高效细胞毒性载荷以及可裂解或不可裂解的连接子。
二、已获批ADC药物的临床应用
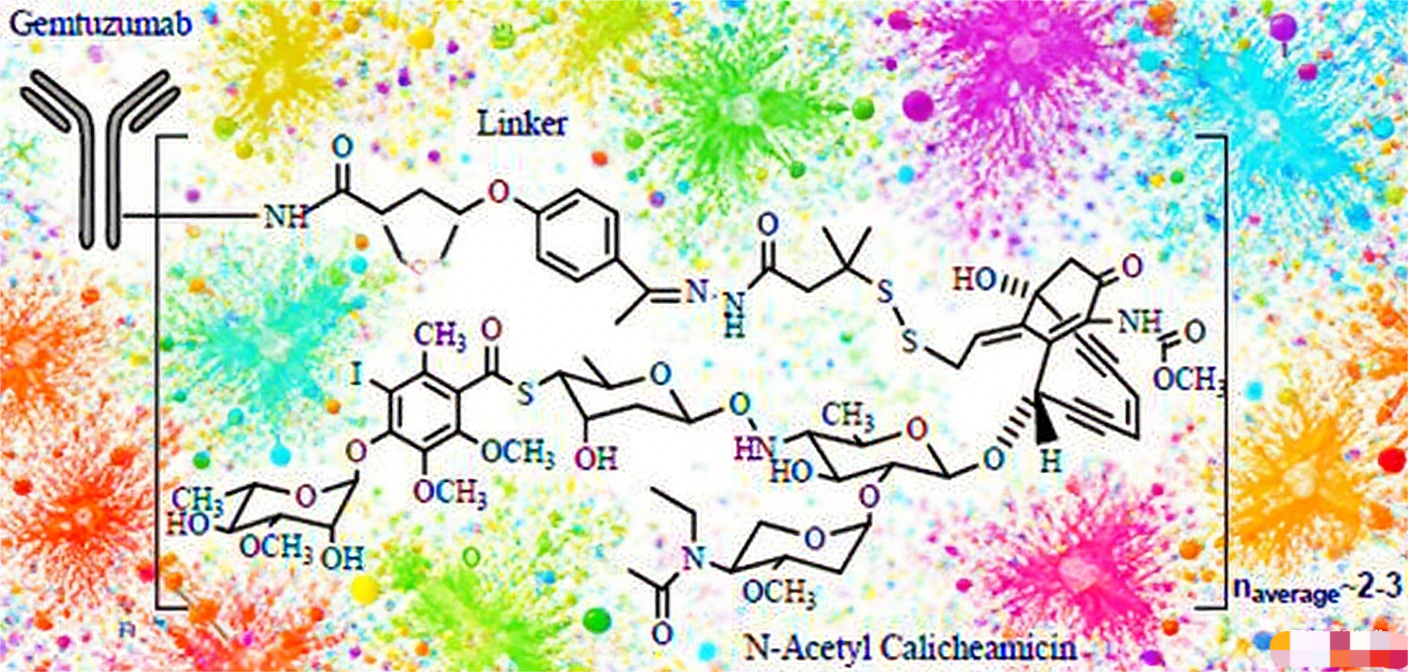
Gemtuzumab Ozogamicin(GO)
作为首个针对急性髓系白血病的ADC药物,GO靶向CD33抗原,通过双功能连接子与卡奇霉素偶联。该药物经历曲折发展历程:2000年获加速批准,后因验证性试验未达终点而撤市,经剂量优化和给药方案调整后于2017年重新获批。临床研究显示,采用分次给药方案(3 mg/m²)可显著提高具有良好和中等细胞遗传学特征AML患者的总生存期,同时降低肝静脉闭塞性疾病发生率。
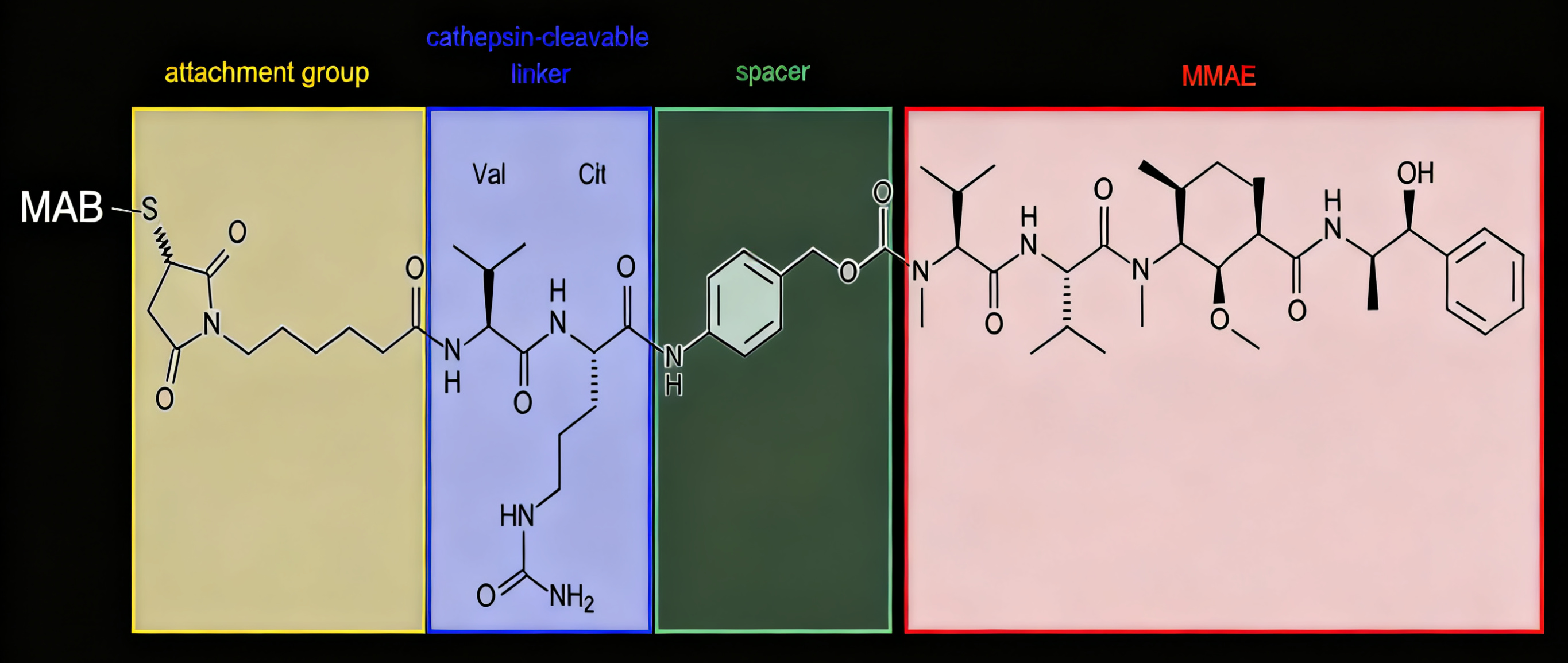
Brentuximab Vedotin(BV)
BV靶向CD30抗原,通过蛋白酶可裂解连接子与单甲基奥瑞斯他汀E(MMAE)偶联。在复发难治性霍奇金淋巴瘤和系统性间变性大细胞淋巴瘤中展现出卓越疗效,客观缓解率分别达75%和86%。基于III期临床试验证据,BV现已扩展至联合化疗用于晚期霍奇金淋巴瘤的一线治疗,并在皮肤T细胞淋巴瘤中证实其临床价值。
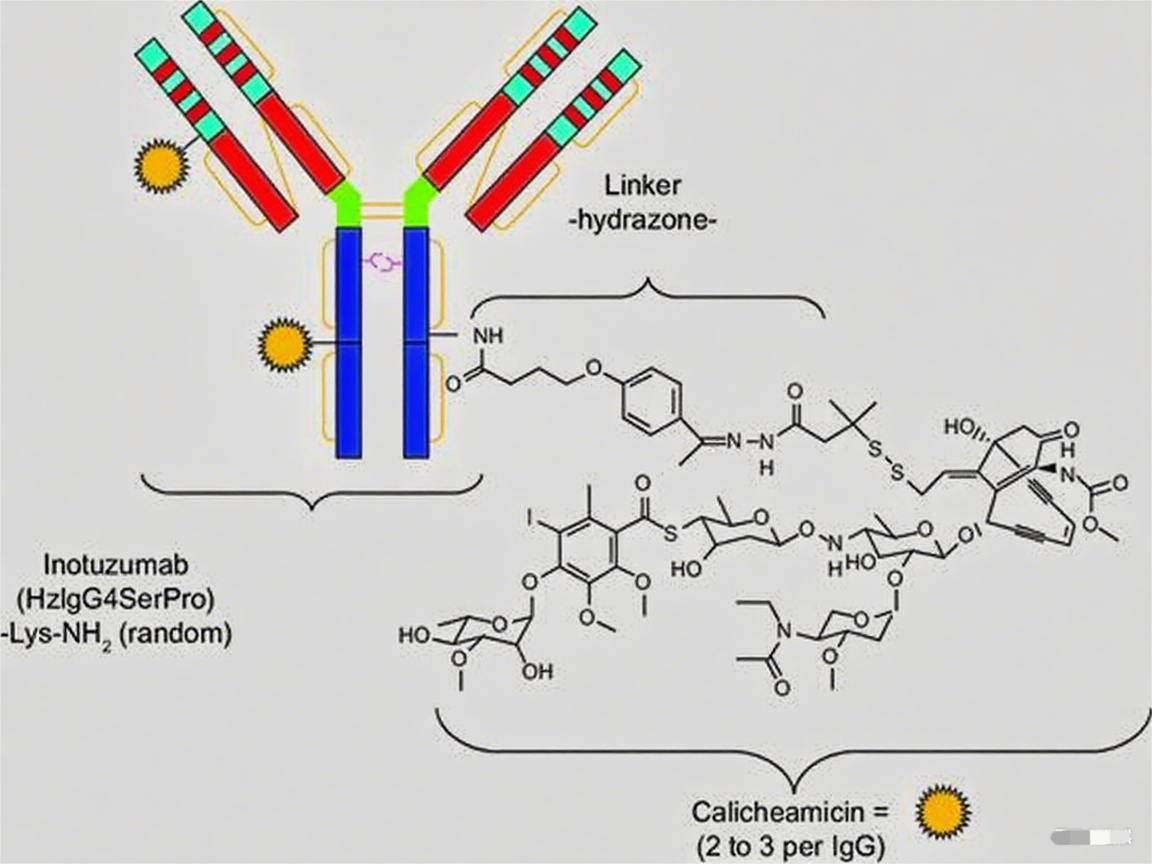
Inotuzumab Ozogamicin(InO)
该药物靶向B细胞抗原CD22,同样采用卡奇霉素作为细胞毒性载荷。在复发难治性急性淋巴细胞白血病的III期试验中,InO组完全缓解率(包括不完全血细胞恢复的完全缓解)达80.7%,显著优于传统化疗。然而,肝静脉闭塞性疾病仍是其最值得关注的不良反应,提示该毒性特征与卡奇霉素载荷密切相关。
三、临床研发中的ADC药物
Vadastuximab Talirine(SGN-CD33A)
此药物采用工程化半胱氨酸抗体技术,实现位点特异性偶联,确保药物抗体比值的均一性。其独特之处在于使用吡咯并苯二氮卓二聚体作为细胞毒性载荷,通过可裂解连接子与抗CD33抗体结合。早期临床试验显示单药治疗急性髓系白血病具有显著抗白血病活性,完全缓解率达33%。然而,在与低甲基化药物联合的III期研究中,因感染相关死亡率增加而终止研发,凸显了联合治疗方案优化的重要性。
四、ADC药物的作用机制与关键技术特征
靶向递送与细胞内化
ADC药物通过抗体部分特异性识别肿瘤细胞表面抗原,形成复合物后经内吞作用进入细胞。在溶酶体蛋白酶作用下,连接子发生裂解释放细胞毒性药物,进而诱导DNA损伤或微管功能紊乱,最终导致肿瘤细胞死亡。
连接子技术进展
连接子的稳定性直接影响ADC药物的安全性和疗效。可裂解连接子(如腙键、二肽序列)依赖细胞内特定环境(如酸性pH、蛋白酶)触发药物释放;不可裂解连接子则需抗体完全降解后才能释放活性药物,这种设计可能改善治疗窗口。
载荷药物的选择
理想的细胞毒性载荷应具备极高的 potency(IC50在pmol/L级别),同时保持足够的亲水性以确保良好的药代动力学特性。目前常用的载荷包括微管蛋白抑制剂(如MMAE、DM1)和DNA损伤剂(如卡奇霉素、吡咯并苯二氮卓类)。
五、挑战与未来发展方向
毒性管理
肝静脉闭塞性疾病、骨髓抑制和周围神经病变是ADC药物常见剂量限制性毒性。通过优化给药方案、剂量调整和预防性措施,可有效管理这些不良反应。
耐药机制
肿瘤细胞可通过多种机制对ADC药物产生耐药,包括靶抗原下调、内吞过程缺陷、药物外排增加以及凋亡通路改变。联合用药策略和新型ADC设计是克服耐药的重要方向。
未来展望
下一代ADC药物的发展重点包括:开发新型靶点抗原、优化连接子技术以提高稳定性、探索创新载荷机制、推进联合治疗策略以及建立精准的患者选择生物标志物。随着对ADC药物药理特性理解的深入,其在血液系统恶性肿瘤治疗中的地位将进一步提升。
六、乐备实(LabEx)助力血液瘤研究的多因子检测产品
| 货号 | 技术平台 | 产品名称 | 核心检测因子 | 适配研究方向 |
|---|---|---|---|---|
| LXLBH12-1 | 液态流式(Luminex) | 人 Treg 细胞 - 12 因子 Panel | IL-2、IL-10、IL-12(p40)、IL-12(p70)、IL-19、IL-20、IL-22、IL-26、IL-27(p28)、IL-28A/IFN-λ2、IL-29/IFN-λ1、IL-35 | 1. 血液瘤(如淋巴瘤、白血病、多发性骨髓瘤)中 Treg 细胞功能调控研究:通过检测 IL-10、IL-35 等 Treg 细胞特征性抑制因子,分析其对肿瘤微环境中效应 T 细胞(如 CD8+T 细胞)的免疫抑制作用,明确 Treg 细胞在血液瘤免疫逃逸中的机制; 2. 免疫治疗疗效监测:评估免疫检查点抑制剂(如 PD-1/PD-L1 抑制剂)或 CAR-T 细胞治疗后,患者外周血 / 骨髓样本中 Treg 细胞相关细胞因子的表达变化,判断治疗是否重塑免疫微环境(如 IL-2 升高提示效应 T 细胞活化增强,IL-10 降低提示免疫抑制减弱); |
| LXLTH14-3 | 液态流式(Luminex) | 人免疫肿瘤学检查点 14 因子 Panel | TIM-3、CD152/CTLA4、BTLA、CD28、IDO/IDO1、LAG-3、PD-1、PD-L2、CD27、CD137(4-1BB)、GITR、HVEM、CD80、PD-L1 | 1. 血液瘤免疫检查点分子表达谱分析:检测淋巴瘤、白血病患者肿瘤细胞或免疫细胞(如 T 细胞、巨噬细胞)表面 PD-1、PD-L1、CTLA4、LAG-3 等检查点分子的表达,明确患者是否适合免疫检查点抑制剂治疗(如 PD-L1 高表达患者可能更易从 PD-1 抑制剂治疗中获益); 2. 免疫治疗耐药机制研究:针对免疫治疗后进展的患者,分析其样本中检查点分子的动态变化(如 TIM-3、LAG-3 表达升高可能提示出现替代性免疫抑制通路,导致 PD-1 抑制剂耐药),为联合治疗方案(如 PD-1 抑制剂 + LAG-3 抑制剂)提供依据; |
乐备实是国内专注于提供高质量蛋白检测以及组学分析服务的实验服务专家,自2018年成立以来,乐备实不断寻求突破,公司的服务技术平台已扩展到单细胞测序、空间多组学、流式检测、超敏电化学发光、Luminex多因子检测、抗体芯片、PCR Array、ELISA、Elispot、PLA蛋白互作、多色免疫组化、DSP空间多组学等30多个,建立起了一套涵盖基因、蛋白、细胞以及组织水平实验的完整检测体系。
我们可提供从样本运输、储存管理、样本制备、样本检测到检测数据分析的全流程服务。凭借严格的实验室管理流程、标准化实验室操作、原始数据储存体系以及实验项目管理系统,已经为超过3000家客户单位提供服务,年检测样本超过100万,受到了广大客户的信任与支持。












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


