免疫逃逸堪称肿瘤 “躲避免疫追杀” 的核心绝技 —— 它让肿瘤细胞成功挣脱免疫系统的监视与攻击,更是免疫治疗遇阻、患者预后不理想的关键症结。想要破解这一抗癌难题,必先摸清其底层逻辑与前沿突破。2025 年 7 月,《Signal Transduction and Targeted Therapy》(STTT)杂志重磅刊发题为《Immune evasion in cancer: mechanisms and cutting-edge therapeutic approaches》的综述,系统梳理了肿瘤免疫逃逸的核心机制、关键信号通路,更聚焦于极具潜力的前沿治疗策略,为这场 “抗癌攻防战” 提供了全面的理论导航。

一、肿瘤免疫逃逸六大核心机制:从主动抑制到巧妙伪装的 “避险” 策略
肿瘤从不是被动 “躲藏” 的弱者,而是主动出击的 “操盘手”—— 它会通过多重精准策略改造免疫微环境、直接削弱免疫细胞的杀伤能力,从而顺利逃避免疫攻击。其核心逃逸策略可归纳为以下六类:

1. 肿瘤诱导免疫抑制:打造 “免疫荒漠” 微环境
肿瘤会主动释放抑制性分子、招募抑制性细胞,直接瘫痪免疫系统功能,构建不利于免疫杀伤的 “荒漠” 环境。具体表现为:大量分泌 TGF-β、IL-10、VEGF 等抑制性细胞因子,既抑制 T 细胞和 NK 细胞的杀伤活性,又阻碍树突状细胞的抗原呈递功能;同时招募调节性 T 细胞(Treg)和髓系来源抑制细胞(MDSC),进一步强化免疫抑制效应;此外,肿瘤代谢产生的乳酸堆积会导致微环境酸中毒,直接损害 T 细胞功能,异常氨代谢还会诱导 T 细胞死亡。
2. 劫持免疫检查点:给免疫细胞强行 “踩刹车”
原本负责维持机体免疫平衡的检查点分子,却被肿瘤 “劫持” 为逃避免疫攻击的关键 “武器”。在 PD-1/PD-L1 经典通路中,肿瘤细胞主动上调 PD-L1 表达,与 T 细胞表面的 PD-1 结合后,直接导致 T 细胞功能耗竭、彻底丧失杀伤能力;LAG-3、TIM-3、TIGIT 等其他检查点分子会形成协同效应,尤其在 PD-1 抑制剂耐药后常代偿性激活,成为肿瘤逃逸的 “后备防线”;更狡猾的是,肿瘤还会高表达 CD47 蛋白,释放 “别吃我” 的伪装信号,成功误导巨噬细胞放弃吞噬,进一步加固自身的免疫逃逸屏障。
3. 肿瘤微环境(TME)共谋:构筑物理 + 代谢双重逃逸屏障
肿瘤微环境堪称免疫逃逸的 “帮凶”,通过物理阻隔与代谢干扰双重手段,全方位阻碍免疫攻击。癌相关成纤维细胞(CAF)会大量分泌胶原蛋白和透明质酸,编织致密的物理屏障,直接阻挡 T 细胞向肿瘤核心浸润;肿瘤细胞疯狂抢夺葡萄糖等营养物质,让免疫细胞陷入 “饥饿” 状态而失能,同时营造的缺氧环境会进一步抑制免疫反应活性;更关键的是,微环境还会诱导免疫细胞 “叛变”—— 巨噬细胞极化为抑制性 M2 型,中性粒细胞转为促瘤的 N2 型,共同助长免疫抑制氛围,为肿瘤逃逸保驾护航。
4. 抗原提呈失灵:让免疫细胞 “视而不见”
免疫细胞对肿瘤的攻击,始于精准识别 —— 而肿瘤恰恰瞄准这一关键环节,让抗原提呈系统彻底 “失灵”。它会通过基因突变或表观沉默,大幅下调 MHC-I 分子表达,直接降低自身 “辨识度” 以躲避免疫监视;抗原加工与呈递相关的核心分子(如 TAP、LMP)功能异常,会导致肿瘤抗原 “可见性” 显著下降,即便免疫细胞靠近也无法识别;更有甚者,在免疫系统的长期 “免疫编辑” 压力下,高免疫原性的肿瘤细胞会被清除,最终留下低免疫原性的肿瘤克隆,实现 “低调” 逃逸。
5. 基因 + 表观遗传调控:肿瘤改写免疫 “游戏规则”
在基因与表观遗传层面,肿瘤会主动篡改免疫调控逻辑,从根源上瓦解免疫防御。KRAS、p53、PTEN 等关键驱动基因突变,会通过下游信号通路间接改变免疫相关分子的表达模式,削弱免疫应答;而 DNA 甲基化、组蛋白修饰及非编码 RNA 调控等表观遗传机制,则会直接让免疫激活基因陷入 “沉默” 状态,从分子底层为免疫逃逸铺路。
6. 肿瘤异质性:治疗困境中的“暗礁”
肿瘤异质性是导致治疗耐药的核心症结,更是免疫逃逸的 “隐形屏障”。同一肿瘤内部不同区域的免疫特性存在显著差异,形成复杂的空间异质性;而在治疗压力下,肿瘤还会持续进化迭代,不断获得新的逃逸机制,呈现出动态变化的时间异质性,双重特性共同制造了治疗盲区,让精准干预难上加难。
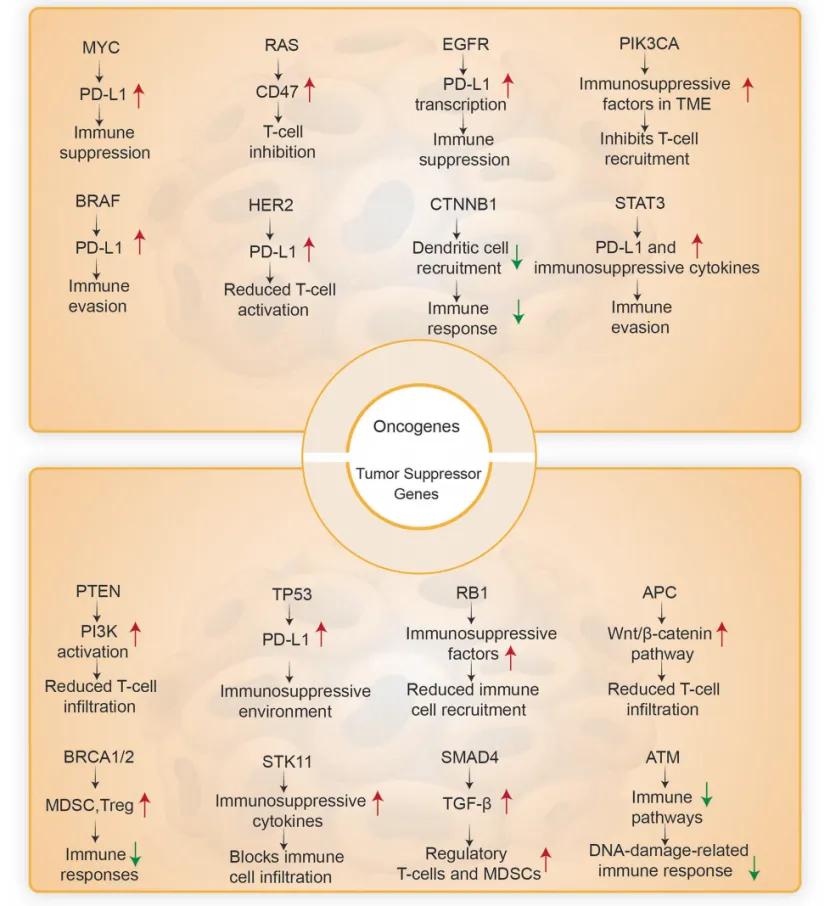
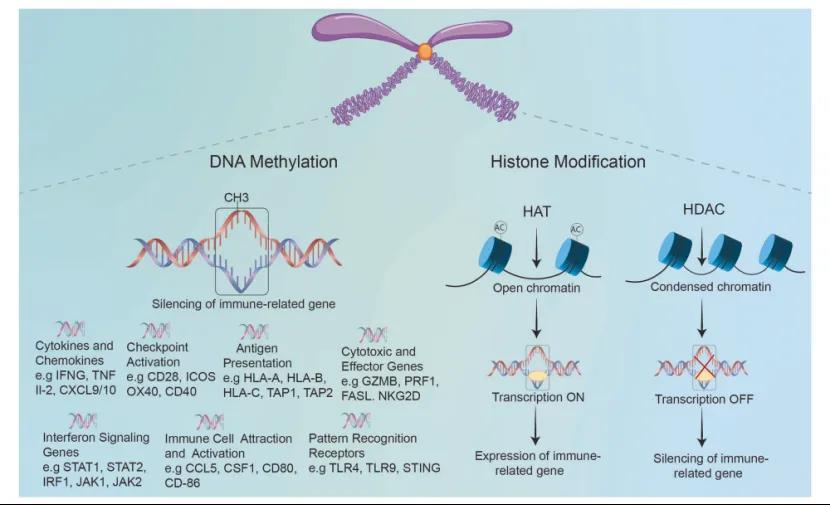
二、七大关键信号通路:解码免疫逃逸的 “幕后操盘手”
这些信号通路既是调控肿瘤生长的关键节点,更是介导免疫逃逸的核心分子机制,具体包括 PD-1/PD-L1、CTLA-4、TGF-β、IL-10/JAK-STAT3、NF-κB、cGAS-STING 及 PI3K/AKT/mTOR 等七大通路。它们通过各自独特的分子调控逻辑抑制免疫应答、助力肿瘤逃逸,同时也因核心作用成为免疫治疗中极具潜力的靶向突破口。

三、五大治疗策略:攻坚免疫逃逸的现实突破口
目前临床已针对肿瘤免疫逃逸开发出多种精准攻坚策略,具体包括:
1. 免疫检查点抑制剂:以 PD-1/PD-L1 抗体、CTLA-4 抑制剂为代表,通过阻断免疫抑制信号,帮助耗竭的 T 细胞恢复杀伤活性;
2. 过继细胞治疗:如 CAR-T、TILs、TCR-T 等疗法,对免疫细胞进行体外 “精准改造” 后回输体内,使其定向识别并攻击肿瘤细胞;
3. 癌症疫苗:通过治疗性疫苗或个体化新抗原疫苗,主动训练免疫系统精准识别肿瘤特异性抗原,激发特异性免疫应答;
4. 表观遗传药物调控:借助 DNMT 抑制剂、HDAC 抑制剂等药物,解除免疫激活基因的表观沉默,重启机体免疫防御;
5. 靶向肿瘤微环境:通过清除 Treg、MDSC 等抑制性细胞、降解致密物理屏障、改善缺氧缺营养的代谢环境,重构利于免疫攻击的微环境。
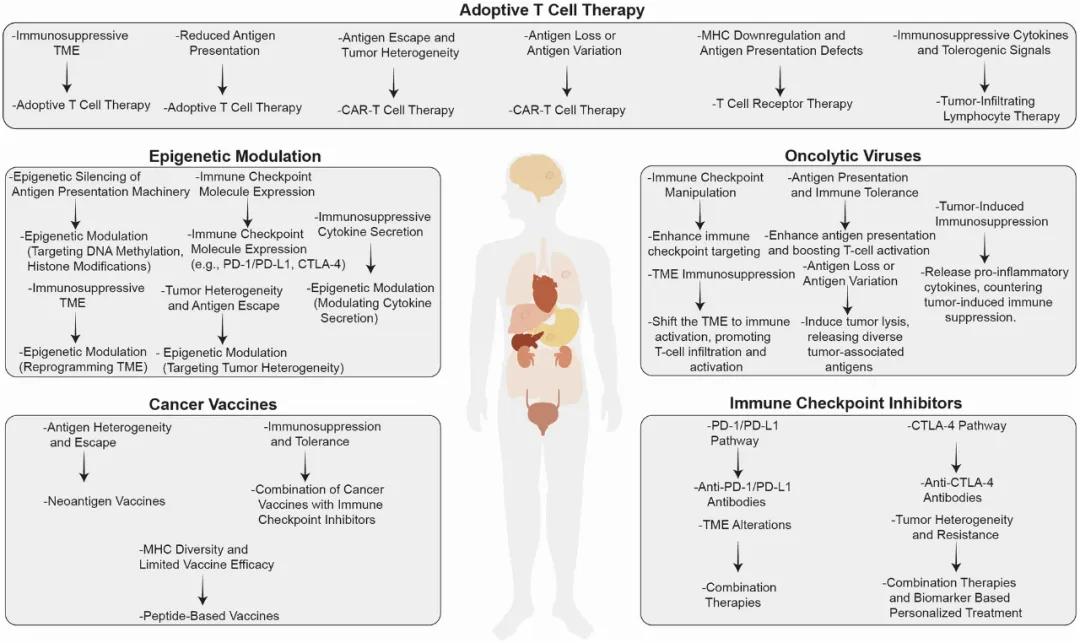
四、四大前沿方向:下一代免疫治疗的突破新可能
1. 双特异性抗体疗法:以同时靶向 CD19与 CD3 的 blinatumomab 为代表,通过双向结合机制直接架起 T 细胞与肿瘤细胞的 “桥梁”,强制激活 T 细胞的肿瘤杀伤效应;
2. 纳米递药系统:借助纳米载体的靶向递送特性,精准提升药物在肿瘤部位的富集浓度,同时降低药物对正常组织的系统毒性,实现 “增效减毒”;
3. 免疫激动剂疗法:通过 OX40、4-1BB 等共刺激分子激动剂,主动激活免疫细胞的正向调控信号,强化 T 细胞增殖与杀伤活性,放大抗肿瘤免疫应答;
4. 肿瘤代谢干预:针对肿瘤代谢异常特征,靶向乳酸代谢、糖酵解等关键通路,改善肿瘤微环境的代谢紊乱状态,恢复 T 细胞等免疫细胞的功能活性。
五、挑战与展望:下一代免疫治疗的攻坚方向与未来图景
当前肿瘤免疫逃逸研究仍面临异质性解析、微环境调控机制、通路交叉互作等核心难题,精准靶点挖掘与疗效预测亟需技术支撑。未来研究需聚焦多维度机制探索,依托多因子检测等核心技术,深度解析免疫分子网络调控规律,为新型逃逸靶点发现、联合治疗方案优化提供数据支撑。
乐备实深耕蛋白检测服务,致力于发展一站式生物标志物发现服务平台,助力生命科学发展,为人类健康做贡献。将持续助力科研人员精准捕获免疫微环境中细胞因子、趋化因子等关键分子变化,加速 “机制 - 靶点 - 疗法” 转化研究。通过技术赋能科研,推动免疫逃逸研究实现突破性进展,助力开发更精准的肿瘤免疫治疗策略,为攻克肿瘤难题注入科研动力。












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


