中性粒细胞作为机体固有免疫系统的核心组成部分,传统认知聚焦于其吞噬病原体、介导炎症反应的防御功能。而近年来研究发现,中性粒细胞可通过一种特殊的细胞应答方式——NETosis(中性粒细胞胞外陷阱形成)释放网状结构,在肿瘤微环境中扮演着“双面角色”。这种由DNA与活性蛋白构成的胞外陷阱,既可能参与抗肿瘤免疫,更常被肿瘤细胞“劫持”,成为促进肿瘤进展、转移及血管生成的关键推手。本文将系统梳理NETosis的核心机制、分型特征及其在肿瘤领域的研究进展,为相关科研与转化应用提供参考。
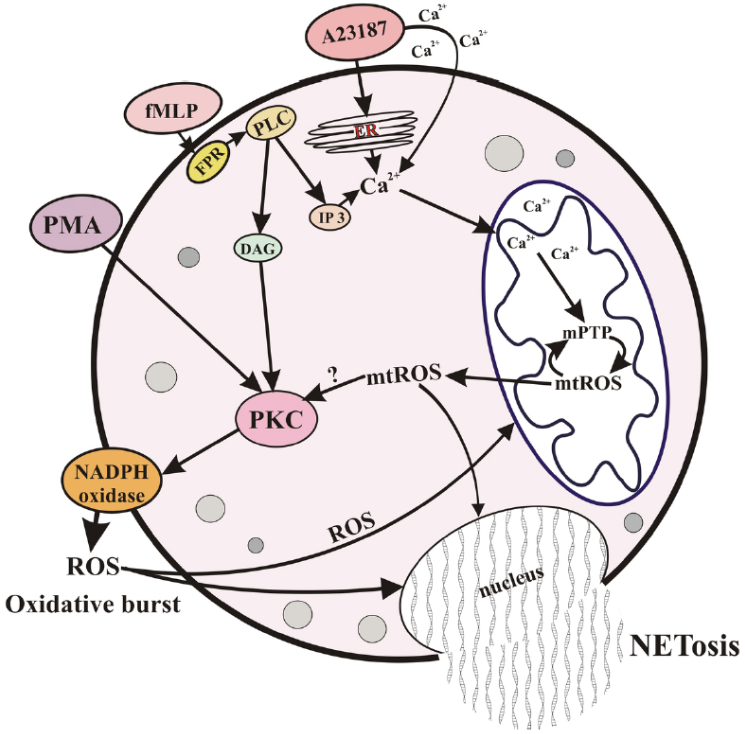
NETosis诱发机制示意图
Vorobjeva NV, Chernyak BV. NETosis: Molecular Mechanisms, Role in Physiology and Pathology. Biochemistry (Mosc). 2020 Oct;85(10):1178-1190.
doi: 10.1134/S0006297920100065. PMID: 33202203; PMCID: PMC7590568.
一、NETosis的核心特征与分型机制
NETosis是中性粒细胞区别于凋亡和坏死的独特生物学过程,其核心产物为中性粒细胞胞外陷阱(NETs)——以染色质DNA为骨架,镶嵌髓过氧化物酶(MPO)、中性粒细胞弹性酶(NE)、基质金属蛋白酶9(MMP9)等多种活性蛋白的网状复合物。根据细胞存活状态与信号通路差异,NETosis主要分为两种核心分型:
(一)经典途径:自杀型NETosis(Suicidal NETosis)
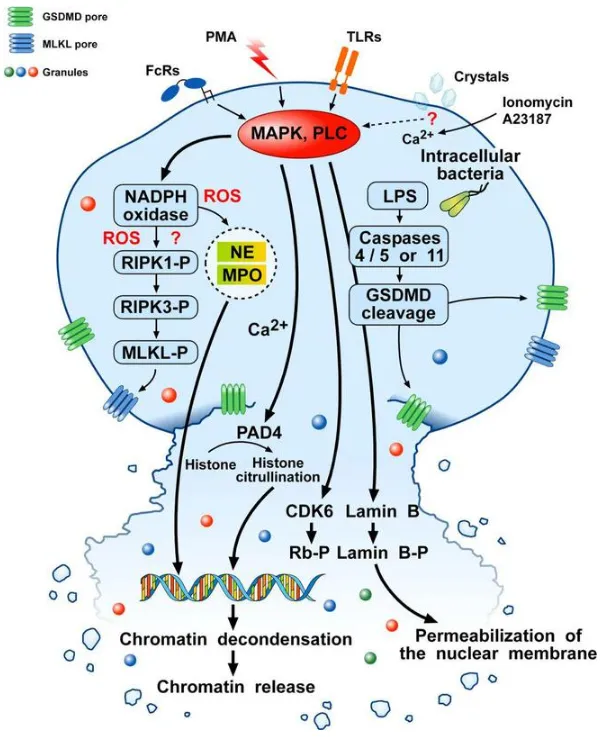
Suicidal NETosis机制示意图
Fang Q, Stehr AM, Naschberger E, Knopf J, Herrmann M, Stürzl M. No NETs no TIME: Crosstalk between neutrophil extracellular traps and the tumor immune microenvironment. Front Immunol. 2022 Dec 23;13:1075260. doi: 10.3389/fimmu.2022.1075260. PMID: 36618417; PMCID: PMC9816414.
该途径以中性粒细胞死亡为代价,是NETs形成的主要方式。其核心机制如下:
- 胞外刺激(如PMA、LPS、细菌等)激活胞内丝裂原活化蛋白激酶(MAPK)和蛋白激酶C(PLC),通过Raf-MEK-ERK-MAP激酶通路与PKC通路放大信号;
- 信号下游引发NADPH氧化酶激活,产生活性氧(ROS),进而激活受体交互蛋白激酶3(RIPK3)和混合系激酶域样蛋白(MLKL),启动程序性死亡;
- ROS同时激活NE和MPO,增强核膜通透性并促进染色质解凝,核内Ca²⁺依赖的肽基精氨酸脱氨酶4(PAD4)介导组蛋白瓜氨酸化,进一步推动染色体解聚;
- CDK4/6、网膜母细胞瘤蛋白(Rb-P)和核纤层B(lamin B)介导核膜破裂,LPS激活的Caspases4/5或Caspases11促进成孔蛋白Gasdermin D(GSDMD)引发质膜破裂,DNA-蛋白质复合物释放形成NETs,最终中性粒细胞死亡。
(二)非经典途径:活力型NETosis(Vital NETosis)
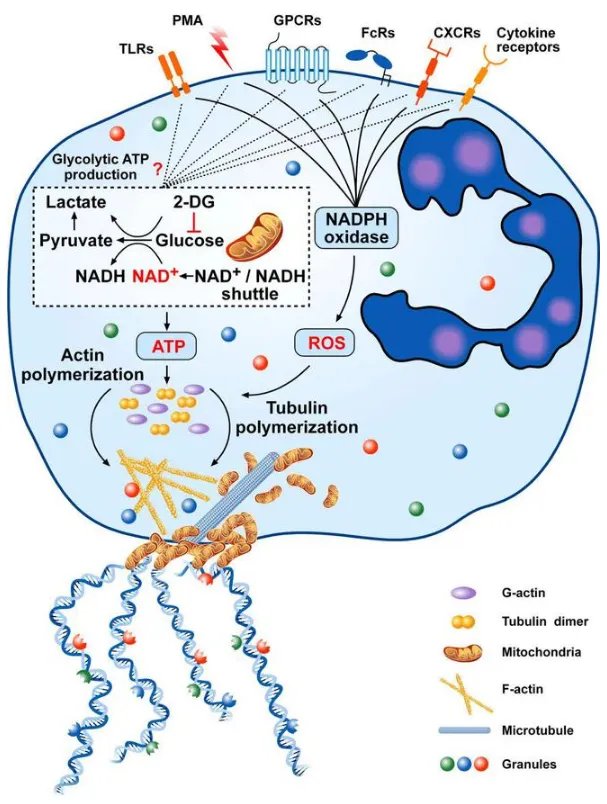
Vital NETosis机制示意图
Fang Q, Stehr AM, Naschberger E, Knopf J, Herrmann M, Stürzl M. No NETs no TIME: Crosstalk between neutrophil extracellular traps and the tumor immune microenvironment. Front Immunol. 2022 Dec 23;13:1075260. doi: 10.3389/fimmu.2022.1075260. PMID: 36618417; PMCID: PMC9816414.
该途径的核心特征是中性粒细胞释放NETs后仍保持存活,核膜与质膜结构完整,可继续发挥炎症调控功能:
- 胞外刺激(如细胞因子、GPCRs激活等)触发PAD4活化,无需NADPH氧化酶复合物参与;
- PAD4介导组蛋白瓜氨酸化与染色质去凝集,形成的DNA-蛋白质复合物被包裹于囊泡中; 囊泡与细胞膜融合后将复合物排出胞外,形成NETs,中性粒细胞保留无核细胞质,维持后续生物学功能;
- 该过程依赖糖酵解提供ATP,伴随肌动蛋白与微管蛋白聚合,保障囊泡运输与NETs释放。
两种分型的关键差异在于是否伴随细胞死亡、是否依赖NADPH氧化酶及ROS产生,其选择取决于刺激信号类型与微环境状态,共同构成中性粒细胞的功能调控网络。
二、肿瘤相关中性粒细胞(TANs)与NETosis的功能关联
肿瘤微环境(TME)募集的中性粒细胞被称为肿瘤相关中性粒细胞(TANs),其具有高度可塑性,可分为抗肿瘤表型(N1)与促肿瘤表型(N2),而NETosis主要由N2型TANs介导,成为其促癌功能的核心执行机制:
(一)TANs的表型特征与NETosis调控
- N1型TANs高表达TNFα、CCL3和ICAM-1,低表达精氨酸酶,通过产生ROS、MPO等细胞毒性介质杀伤肿瘤细胞,其NETosis活性受抑制;
- N2型TANs上调CCL2、CXCL1、CXCL8等趋化因子,高表达VEGF、MMP9等促癌分子,在肿瘤趋化因子诱导下大量活化并发生NETosis;
- 干扰素β(IFN-β)可诱导N1型TANs向N2型转化,增强NETs生成,而分泌性糖蛋白HRG等分子可通过结合TANs表面的FCγR1,抑制其募集与NETosis活性。
(二)NETs的促癌功能机制
NETs通过多重途径参与肿瘤进展,其核心机制包括:
- 促进血管生成:NETs中的活性蛋白可刺激内皮细胞增殖、迁移及小管形成,上调ANGPT2等血管生成相关分子,激活AKT/mTOR信号通路,在胃癌等肿瘤中已证实NETs浸润与微血管密度正相关;
- 加速肿瘤转移:NETs的网状结构可捕获循环肿瘤细胞,减少其凋亡,同时降解细胞外基质(ECM),为肿瘤细胞侵袭开辟通道,在肝癌肺转移模型中,抑制NETosis可显著降低转移灶形成率;
- 调控肿瘤坏死:在恶性黑色素瘤中,NETs可诱导肿瘤细胞铁死亡,导致转移灶坏死增加,且NETs浸润程度与转移灶大小高度相关;
- 重塑免疫微环境:NETs可抑制抗肿瘤免疫细胞活性,促进免疫抑制性微环境形成,削弱机体对肿瘤的免疫监视。
三、NETosis在不同肿瘤中的研究进展
NETosis的促癌作用已在多种肿瘤中得到验证,其功能具有肿瘤类型特异性,为精准靶向治疗提供了方向:
(一)胃癌:血管生成的关键驱动因素

胃癌组织中存在广泛的TANs浸润与NETs生成,且与患者不良预后相关。体外实验证实,NETs可促进胃癌细胞侵袭、转移及上皮间质转化(EMT),并刺激内皮细胞释放组织因子激活凝血途径;体内小鼠皮下荷瘤模型显示,NETs可显著增强肿瘤血管生成,蛋白质组学研究已筛选出多个NETs调控内皮细胞功能的差异表达蛋白,为开发抗血管生成新靶点提供了依据。
(二)肝癌:肺转移的重要调控介质

肺转移是肝细胞癌(HCC)死亡的主要原因,NETs在肝癌转移前生态位形成中发挥关键作用。研究发现,肝癌细胞分泌的趋化因子可募集中性粒细胞至肺部,诱导NETs生成,为肿瘤细胞定植创造条件;而HRG蛋白可通过FCγR1抑制中性粒细胞募集与NETosis,显著减少肝癌肺转移,证实NETosis是肝癌转移的可靶向调控节点。
(三)恶性黑色素瘤:坏死与预后的关联标志物

黑色素瘤转移灶中TANs浸润与不良预后相关,NETs水平与转移灶大小、坏死程度高度相关。机制研究表明,中性粒细胞被募集至坏死肿瘤部位后,通过NETs诱导肿瘤细胞铁死亡,加剧组织坏死;抑制NETosis可驱使TANs向N1型转化,抑制肿瘤生长,提示NETs可作为黑色素瘤免疫治疗之外的潜在靶点。
四、中性粒细胞研究相关因子检测服务哪个公司有?
NETosis 作为肿瘤微环境中调控肿瘤进展的关键机制,其分型特征、分子逻辑及促癌功能的深入探索,离不开多维度技术平台的支撑与系统化科研服务的保障。LabEx 作为专注于生物标志物发现的一站式服务平台,凭借多因子检测、单细胞多组学、DSP 空间多组学、免疫组化等 30 + 核心技术,以及累计 100 万 + 样本的检测经验,可为 NETosis 相关研究提供从分子机制验证、肿瘤组织标志物筛选到临床样本关联分析的全流程支持。无论是 NETs 相关因子的高通量定量、TANs 亚群的单细胞解析,还是肿瘤组织中 NETs 的空间定位与功能关联,LabEx 均能以标准化操作与专业数据分析,助力科研人员高效挖掘核心机制、筛选潜在靶点。未来,LabEx 将持续秉持专业严谨的服务理念,以全面的技术体系与深厚的行业积淀,为 NETosis 及肿瘤免疫相关研究提供精准赋能,推动基础科研向临床转化的关键突破,为肿瘤精准治疗研究添砖加瓦。












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


