网络药理学以 “多靶点、多通路” 为核心,通过生物信息学、系统生物学等技术,整合药物成分、靶点、疾病通路之间的关联,实现:
1、预测药物潜在作用靶点与分子机制(如中药复方的协同作用解析);
2、揭示疾病发生发展的核心通路网络,发现新的治疗靶点;
3、指导药物组合筛选、老药新用及副作用预测;
4、为基础实验(如细胞、动物实验)提供明确的验证方向,减少盲目性。
1、靶点 / 通路验证:同步检测关键信号通路中多个蛋白因子(如细胞因子、炎症因子、激酶、受体等)的表达水平,验证网络药理学预测的靶点或通路是否真实激活 / 抑制;
2、疾病分型与机制解析:量化疾病模型与正常组的多因子差异表达谱,为网络药理学构建 “疾病 - 靶点 - 因子” 关联网络提供实验数据支撑;
3、药物疗效评价:检测药物干预后,多靶点相关因子的表达变化,验证药物是否通过预测通路发挥作用(如抗炎、抗肿瘤、免疫调节等);
4、协同作用验证:针对复方药物或联合治疗方案,通过多因子同步检测,揭示不同成分 / 药物在调控网络中的协同或拮抗效应;
5、生物标志物筛选:结合网络药理学预测的核心节点,通过多因子检测发现具有诊断或预后价值的潜在生物标志物(如肿瘤微环境中的细胞因子组合)。
简言之,网络药理学负责 “精准预测”,多因子检测负责 “高效验证”,二者结合可大幅提升科研效率,助力从 “理论网络” 到 “实验证据” 的转化。下面用1篇文献展开介绍:
肝癌(HCC)位列全球癌症死亡率第三,预后欠佳,亟需有效治疗手段。Small 期刊(IF:11.459)2020 年 1 月发表的 “人参皂苷 Rg3 纳米颗粒偶联物抑制 HCC 的发生和转移” 一文,通过 Fe@Fe3O4 纳米颗粒与人参皂苷 Rg3 偶联制备出高适配性纳米药物 NpRg3,该药物可改善体内肠道菌群与代谢失衡,进而抑制 HCC 进展及转移,为肿瘤治疗提供了全新策略。
题目:Nanoparticle Conjugation of Ginsenoside Rg3 Inhibits Hepatocellular Carcinoma Development and Metastasis译名:人参皂苷 Rg3 纳米颗粒偶联物抑制 HCC 的发生和转移期刊:SmallIF:11.459发表时间:2020.1,DOI 号:10.1002/smll.201905233
1、人参皂苷 Rg3 纳米颗粒的偶联和表征
为增强人参皂苷 Rg3 的抗肿瘤活性,本研究对其结构进行优化并合成 NpRg3:通过程序微流控工艺制备 Fe@Fe3O4 纳米粒子,借助自主开发的偶联流程实现两者结合,并明确了 NpRg3 的分子结构(图 1a)。透射电子显微镜观察显示,Fe@Fe3O4(I 和 II)与 NpRg3(III 和 IV)均呈核壳结构,且 NpRg3 的有机偶联特征显著,颗粒间距更短(图 1b)。傅里叶变换红外光谱分析证实 NpRg3 含大量 - OH 基团及 CH2/CH 基团(对应纳米粒子与人参皂苷 Rg3 的表面 - OH),且相比 Fe@Fe3O4,NpRg3 出现 2 个人参皂苷 Rg3 特有的双吸收峰(图 1c)。此外,研究还检测了两者的流体动力尺寸、Zeta 电位及稳定性:NpRg3 因氨基存在,Zeta 电位显著高于 Fe@Fe3O4,稳定性更优;合成过程中经 2 次干燥以去除杂质、校准产物,受干燥团聚及磁吸引影响,干燥状态下两者的流体动力尺寸均大于分散状态,且 NpRg3 因偶联作用,流体动力尺寸大于 Fe@Fe3O4(图 1d-f)。通过检测不同质量比反应后溶液中残留的人参皂苷 Rg3,确定最佳偶联比例为 1:1(图 1g),高效液相色谱进一步验证,人参皂苷 Rg3 与 NpRg3 均在约 12 min 达到基线分离(图 1h)。生理条件下,人参皂苷 Rg3 从复合物中的释放量随时间推移逐步上升。

2、人参皂苷 Rg3 纳米偶联物可延长原位 HCC 小鼠的存活周期
研究采用二甲基亚硝胺(DEN)诱导 2 周龄小鼠构建原位 HCC 模型(图 2a),结果显示 DEN 诱导的 HCC 呈动态进展趋势:小鼠注射 DEN 后第 28 周出现 HCC 病灶,随后持续增殖并侵袭远端器官,这一结论已通过肝脏组织病理学检查证实(图 2b)。实验将 HCC 小鼠随机分为对照组、纳米粒子组、Rg3 组及 NpRg3 组(每组 n=5),其中 15 只 / 组随访观察存活情况至 70 周,剩余 10 只 / 组于 42 周时处死以评估 HCC 进展。数据表明,与其他三组相比,NpRg3 处理组能显著延长原位 HCC 小鼠的存活时间(图 2c)。
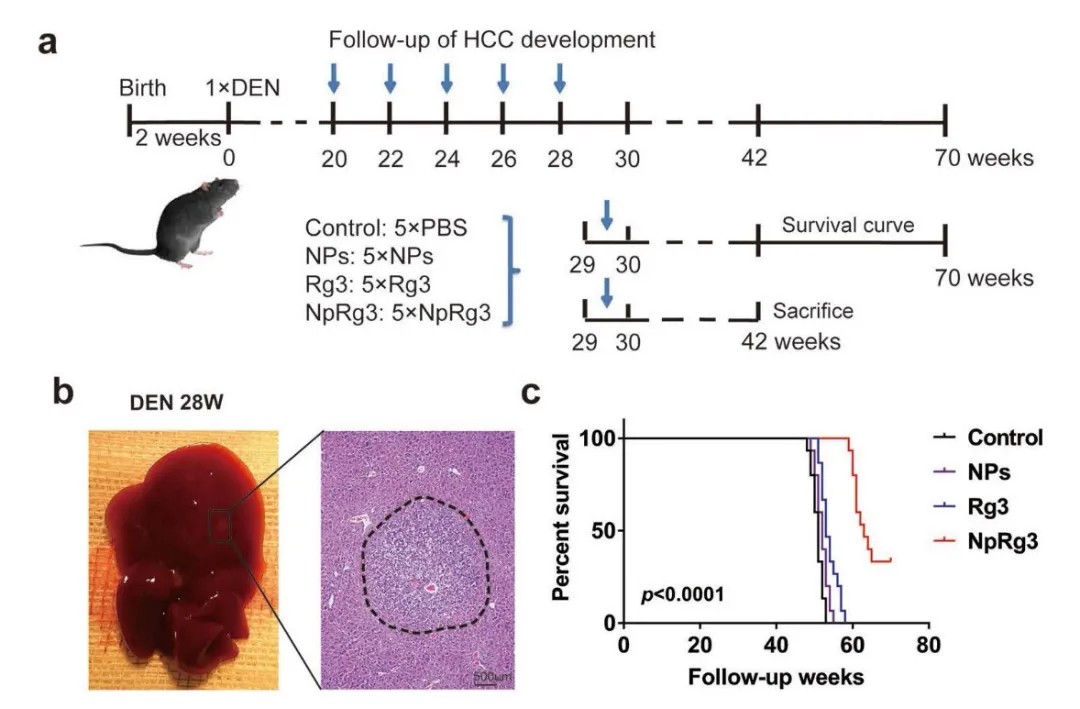
3、人参皂苷 Rg3 纳米偶联物可抑制原位 HCC 小鼠的 HCC 进展
小鼠注射 DEN 第 42 周后,对照组与纳米粒子组出现明显的多发性肿瘤结节,人参皂苷 Rg3 组肿瘤结节略有减少,而 NpRg3 组几乎未观察到肿瘤结节(图 3a)。与其余三组相比,NpRg3 组的肝脏 / 体重比值显著降低,肝脏表面肿瘤数量明显减少,且表面最大肿瘤直径也显著缩小。这表明,人参皂苷 Rg3 与纳米颗粒结合后,对 HCC 形成及进展的抑制效果,显著优于单独使用纳米粒子或人参皂苷 Rg3。相较于对照组和纳米粒子组,人参皂苷 Rg3 组的血清丙氨酸转氨酶、天冬氨酸转氨酶水平有所下降;而 NpRg3 组这两项指标显著降低(接近基线水平),HCC 小鼠的肝功能得到有效改善(图 3c)。肝脏组织病理学检测显示,对照组与纳米粒子组中 50%-90% 的肝脏存在肿瘤增生,增生细胞的形态及分布符合 HCC 组织病理学特征;人参皂苷 Rg3 组肝脏肿瘤增生面积有所减小,NpRg3 组则罕见肿瘤结节,肿瘤增生面积显著缩减(图 3d)。

4、人参皂苷 Rg3 纳米偶联物可降低 HCC 肺转移风险
通过透射电子显微镜观察肿瘤细胞超微结构:对照组与纳米粒子组的肿瘤细胞存在异常分裂现象,且含有大量完整线粒体,提示肿瘤处于活跃增殖状态;而 NpRg3 组肿瘤细胞呈现单细胞核特征,线粒体数量显著减少(图 4a)。酸滴定实验显示 NpRg3 的 pH 值为 9.15,具备较强碱性,推测其可中和 HCC 肿瘤缺氧引发的酸性微环境,改变肿瘤增殖所需的最佳酸碱条件。肺转移是 HCC 患者常见致死原因:宏观观察可见,对照组与纳米粒子组肺组织中存在多个转移结节,NpRg3 组则未发现肺转移结节(图 4b);数据显示,NpRg3 组 HCC 肺转移比例较对照组和纳米粒子组显著降低(图 4c)。肺组织病理学检查证实,对照组与纳米粒子组的肺结节为血管丰富的 HCC 转移灶,而 NpRg3 组无此类结节(图 4d)。肿瘤血管生成与循环肿瘤细胞是 HCC 转移的关键影响因素:人参皂苷 Rg3 可抑制内皮祖细胞从骨髓微环境向循环系统迁移,并调控 VEGF 依赖的肿瘤血管生成;NpRg3 离开肝脏后,铁基成分的长期循环可能激活血液免疫细胞,对循环肿瘤细胞发挥杀伤作用。以上结果表明,NpRg3 不仅能抑制肝脏原发性 HCC,还可有效阻断 HCC 向肺的转移。

5、人参皂苷 Rg3 纳米偶联物可抑制回盲肠形态及肠道微生物改变
肝脏功能与状态通过肝肠循环及肠道微生物 - 肝脏轴,与肠道功能、肠道微生物密切相关,因此本研究观察了回盲肠形态及肠道微生物群的变化情况。与对照组和纳米粒子组相比,NpRg3 处理的 HCC 小鼠,其体内回盲肠结构发生明显改变,盲肠长度显著缩短(图 5a)。研究收集正常对照组、DEN 注射后 30 周(30W)组及 42 周(42W)组的回盲肠样本,分析细菌组成:韦恩图结果显示,四组共存在 433 个 OTUs,其中 4 个 OTUs 为 NpRg3 组特有(图 5b)。非度量多维尺度分析显示,随着 HCC 进展,肠道微生物群从正常对照组到 DEN-30W 组、再到 DEN-42W 组呈现规律性变化;而 NpRg3 组肠道微生物群形成独特聚类,与 DEN-42W 组距离较远(图 5c),表明 NpRg3 能显著延缓肠道微生物改变,效果甚至优于 DEN-30W 组。主成分分析计算 β 多样性以评估微生物群相似性,结果显示正常对照组与 NpRg3 组的肠道微生物群落聚集在一起,而 Den-30W 组与 Den-42W 组的微生物群落聚类成团(图 5d)。主坐标分析进一步揭示微生物群落差异,证实 NpRg3 可诱导形成独特的肠道微生物结构,与 DEN-30W 组、DEN-42W 组实现显著区分(图 5e)。

6、参与 NpRg3 抗肿瘤作用的关键细菌及微生物基因功能
通过分析微生物的分类组成与变化特征,本研究鉴定出参与 NpRg3 抗肿瘤功能的关键细菌群落:拟杆菌门、硬壁菌门和蛋白菌门为四组样本中的优势菌门。与 DEN-30W 组相比,DEN-42W 组拟杆菌门与疣微菌门的丰度有所下降,而 NpRg3 给药后这两类菌门的丰度显著提升;反之,DEN-42W 组硬壁菌门丰度较 DEN-30W 组升高,NpRg3 处理后则明显降低(图 6a)。细菌属水平分析显示,毛螺菌属与立克次体属的丰度在 DEN-30W 组和 DEN-42W 组中呈上升趋势,NpRg3 给药后则显著下降(图 6b);另有 15 个细菌属在 DEN-42W 组的丰度较 DEN-30W 组减少,而 NpRg3 处理后其丰度得到恢复性增加(图 6c)。肠道微生物的系统发育与基因功能密切相关,基于群落系统发育调查的代谢功能分析表明:与 DEN-42W 组相比,NpRg3 组共有 29 种微生物功能显著富集,包括核黄素生物合成、氧戊二酸铁氧还蛋白氧化还原酶、戊糖磷酸途径等;同时,肽镍转运系统、多糖转运系统等 7 种微生物功能的丰度明显降低(图 6d)。

本研究采用 Luminex 多重技术检测肝脏组织中的细胞因子与趋化因子,共检测出 29 种炎症因子,并筛选出具有显著差异的炎症标志物。结果显示:与 DEN-30W 组相比,DEN-42W 组中 TNF-α、IFN-γ、IL-1β 等可杀伤肿瘤细胞或抑制肿瘤进展的炎症因子显著下调,而 NpRg3 给药后这些因子水平明显回升;反之,DEN-42W 组中 KC、LIX 等促肿瘤趋化因子较 DEN-30W 组升高,NpRg3 处理后则降低。可见 NpRg3 通过上调抑瘤炎症因子、下调促瘤趋化因子,显著抑制 HCC 进展。
为明确宿主代谢与 NpRg3 抗肿瘤作用的关联,研究对小鼠血清及肝脏开展代谢组学分析,质控结果显示内标稳定、数据可靠。代谢组学轮廓呈现规律变化:从正常对照组、DEN-30W 组到 DEN-42W 组呈渐进式改变,NpRg3 组则呈反向趋势(图 7a)。血清中 69 种代谢物与 HCC 进展相关,DEN-42W 组 3 - 吲哚丙酸、尿素水平较 DEN-30W 组升高,NpRg3 组则降低(图 7b);肝脏中 110 种代谢物与 HCC 进展相关,NpRg3 组游离脂肪酸 18_2、16_2 较 DEN-42W 组增加,N8 - 乙酰亚精氨酸、肌酐则降低(图 7c)。
肠 - 肝轴在 HCC 发生发展中发挥关键作用:肠道微生物可调控宿主代谢功能及能量平衡,其紊乱可能诱发代谢性疾病,因此 HCC 进展中肠道菌群的改变会推动宿主代谢及关键代谢物的变化。本研究基于同一小鼠个体的肠道菌群与关键代谢物,构建各组关联网络(相关系数>0.70 界定为明确关联),并筛选 DEN-42W 组与 NpRg3 组间存在显著差异的菌属及代谢物进行分析。血清代谢物与肠道菌群的相关性分析显示:对照组有 300 组交互关联存在统计学差异,NpRg3 组则为 188 组。NpRg3 组中丁酸产生菌 Butyricicoccus(有益菌)显著富集,其与 3 - 羟基异戊酸呈负相关、与乳酸菌呈正相关;抗炎有益菌 Akkermansia 同样富集,对照组中其与 IV 型梭状芽胞杆菌呈正相关,而 NpRg3 组中与双歧杆菌呈正相关、与梭状芽胞杆菌 XlVb 及毛螺菌呈负相关(图 8),提示 NpRg3 可重建 HCC 小鼠肠道菌群与血清代谢的特异性关联网络。肝组织代谢物与肠道菌群的关联分析显示:对照组有 362 组交互关联存在统计学差异,NpRg3 组为 326 组。对照组中 Akkermansia 与乳酸菌、3 - 氨基水杨酸及梭状芽胞杆菌 IV 呈正相关,NpRg3 组中则与梭状芽胞杆菌 XlVb 及 2 - 羟基丁酸呈负相关(图 8)。上述结果表明,NpRg3 可重塑肠道菌群与肝组织代谢的特异性关联网络,且多数关联趋势与血清水平一致。

研究通过将 Fe@Fe₃O₄纳米颗粒与人参皂苷 Rg3 偶联,成功研发出新型纳米药物 NpRg3。实验证实,该偶联物可显著延长 DEN 诱导的 HCC 小鼠生存期,不仅能强效抑制 HCC 原发灶进展,还可完全阻断其向肺转移。在疾病进程调控方面,NpRg3 能将 HCC 小鼠回盲肠形态及肠道菌群的异常改变延迟超 12 周;菌群及基因功能层面,NpRg3 可上调拟杆菌门、疣微菌门丰度并下调硬壁菌门丰度,同时调控 36 种预测微生物基因功能(29 种富集、7 种下调)。代谢组学分析显示,HCC 进展中代谢组呈规律性异常,而 NpRg3 可逆转该肿瘤主导的代谢紊乱:降低血清 3 - 吲哚丙酸、尿素浓度,升高肝组织游离脂肪酸 18_2、16_2 水平并降低 N8 - 乙酰亚精氨酸、肌酐含量,提示这些代谢物为 HCC 关键治疗靶点。尤为重要的是,NpRg3 可重塑 HCC 小鼠肠道菌群与代谢间失衡的关联网络。综上,研究充分彰显了人参皂苷 Rg3 纳米偶联物的体内抗肿瘤潜力。
通过Luminex技术检测肝组织炎症/趋化因子,发现DEN诱导的HCC模型中,抑瘤炎症因子(如TNF-α等)随病程下调、促瘤趋化因子(如KC等)上调,而NpRg3可逆转这一变化,通过调控相关因子抑制HCC进展。
网络药理学靶点筛选哪个公司提供?
乐备实(LabEx) 可承接该类相关配套服务,其依托完善的多因子检测平台,能为网络药理学靶点的验证等提供有力支撑,助力靶点筛选相关研究推进。乐备实的多因子检测平台涵盖多种主流技术,具体如下:
1、Luminex 液相悬浮芯片平台:基于 Luminex200 仪器,单孔可检测 1 - 115 个指标,仅需 25 - 50μL 样本就能实现多指标同步检测。适配人、小鼠、大鼠等多个种属,兼容血清、组织裂解液、脑脊液等多种样本类型,广泛用于炎症因子、趋化因子等检测,此前还助力过肝移植相关的炎症机制研究。
2、MSD 超敏电化学发光平台:搭载 MSD S120/MSD S600 仪器,采用石墨烯电极板提升抗体固载量,灵敏度达飞克级别。单孔可检测 1 - 10 个指标,对复杂样本兼容性强,常应用于神经相关蛋白等超微量目标分子的检测,是该领域检测的常用可靠技术。
3、抗体芯片平台:能够实现大量蛋白指标的并行检测,可高效筛选样本中差异表达的蛋白分子,为网络药理学中靶点关联的蛋白表达分析等提供高通量的数据支撑。
此外,乐备实还拥有 ELISA 单因子检测、流式细胞术等配套平台,且是 Bio - Plex 多因子检测特约认证服务商,能通过多维度技术组合,为网络药理学靶点筛选及后续验证等研究提供全面的实验服务。
乐备实(上海优宁维生物科技股份有限公司旗下全资子公司),是国内专注于提供高质量蛋白检测以及组学分析服务的实验服务专家,自2018年成立以来,乐备实不断寻求突破,公司的服务技术平台已扩展到单细胞测序、空间多组学、流式检测、超敏电化学发光、Luminex多因子检测、抗体芯片、PCR Array、ELISA、Elispot、PLA蛋白互作、多色免疫组化、DSP空间多组学等30多个,建立起了一套涵盖基因、蛋白、细胞以及组织水平实验的完整检测体系。
我们可提供从样本运输、储存管理、样本制备、样本检测到检测数据分析的全流程服务。凭借严格的实验室管理流程、标准化实验室操作、原始数据储存体系以及实验项目管理系统,已经为超过3000家客户单位提供服务,年检测样本超过100万,受到了广大客户的信任与支持。





















 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


