皮肤作为人体最大的屏障器官,其损伤修复需经炎症、增殖、重塑等多阶段,依赖免疫细胞、成纤维细胞等多种细胞的协同及复杂信号调控。皮肤富含神经支配,既往研究多关注神经轴突通过神经递质、生长因子调控修复,而外周神经胶质细胞的作用及机制尚未明确。近年发现其损伤后可激活并迁移至创面,但调控机制不明。本研究借助多组学技术与基因编辑动物模型,证实皮肤损伤后神经胶质细胞会激活为修复型胶质细胞,在创面神经束周围形成促修复微环境,通过分泌单核细胞趋化蛋白(MCPs,主要为CCL2/7/8)招募巨噬细胞,进而调控成纤维细胞增殖及肌成纤维细胞分化,构成神经-免疫-间充质细胞互作关键调控轴。该发现揭示了伤口愈合时空调控新机制,为开发创面愈合靶向策略提供了理论基础与潜在靶点。
Stierli S, Salas-Bastos A, et al. A peripheral glial niche orchestrates the early stages of skin wound healing. Cell Stem Cell. 2026 Jan 8:S1934-5909(25)00449-7.
一、 材料与方法
(一)动物模型构建
采用Plp1-CreERT2; tdTomato转基因小鼠用于胶质细胞的特异性标记与可视化;构建Sox10条件性敲除(cKO)小鼠以特异性耗竭外周胶质细胞;建立胶质细胞特异性Ccl2敲除小鼠模型,验证趋化因子的功能作用。所有小鼠均构建皮肤急性损伤模型,分别在损伤后第2、4、7天收集皮肤组织样本进行后续分析。
(二)多重荧光成像与空间组学分析
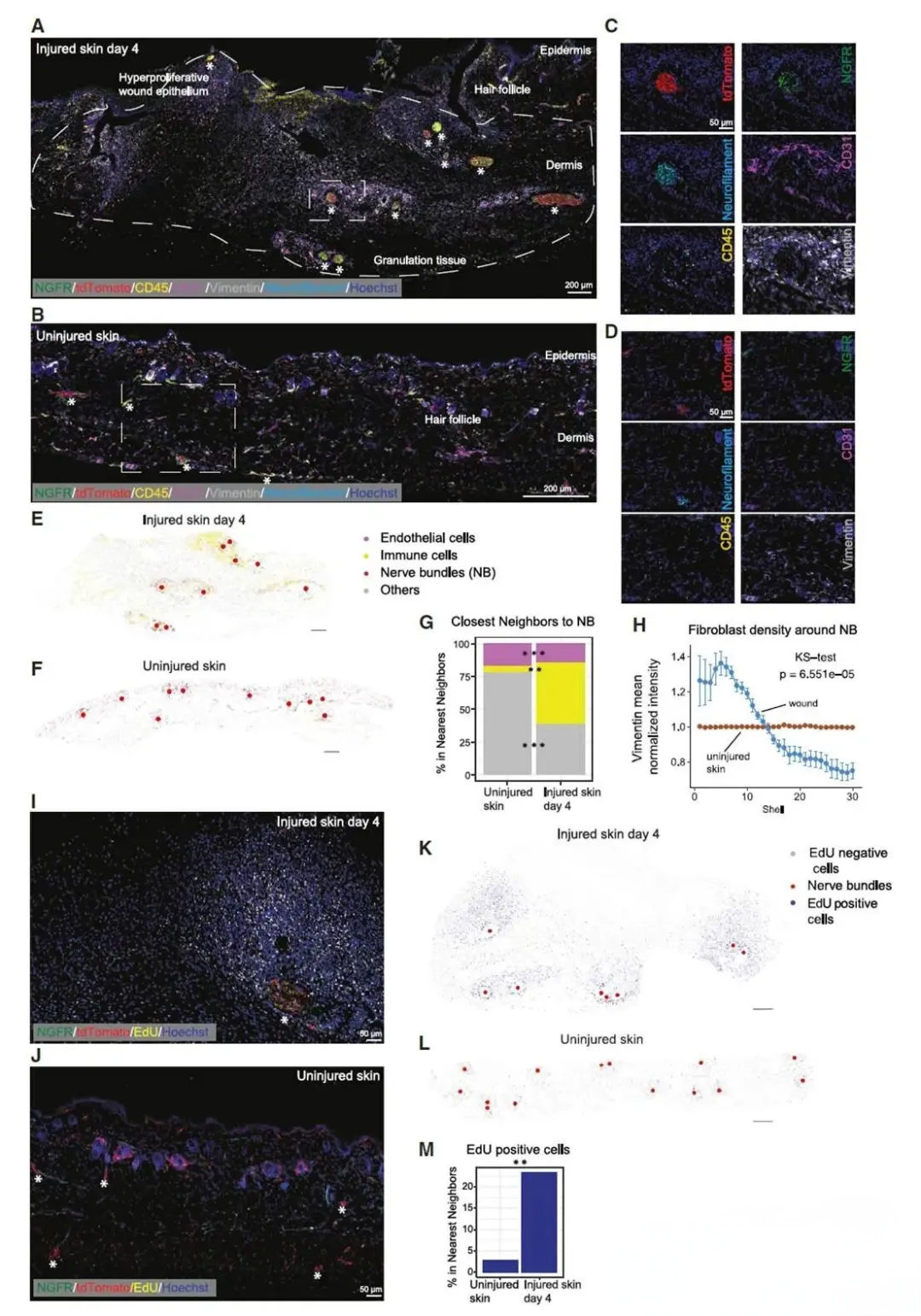
对损伤皮肤组织进行免疫荧光染色,标记神经束(NBs)、免疫细胞(CD45+)、增殖细胞(EdU+)、成纤维细胞(Vimentin+)等细胞类型,使用共聚焦显微镜进行多重荧光成像。通过Sholl分析量化成纤维细胞密度与神经束距离的相关性,结合空间转录组技术分析创面微环境的细胞分布与基因表达特征。
Stierli S, Salas-Bastos A, et al. A peripheral glial niche orchestrates the early stages of skin wound healing. Cell Stem Cell. 2026 Jan 8:S1934-5909(25)00449-7.
(三)单细胞RNA测序分析
分离正常皮肤与损伤后第4天皮肤的胶质细胞,进行单细胞RNA测序,分析胶质细胞的转录组特征,筛选差异表达基因及关键信号通路。通过基因本体论(GO)和京都基因与基因组百科全书(KEGG)分析,揭示损伤后胶质细胞的功能状态转变。
(四)功能验证实验
采用多色流式细胞术分析Sox10 cKO小鼠与野生型小鼠创面免疫细胞(巨噬细胞、中性粒细胞)的数量变化;通过免疫染色检测成纤维细胞增殖(Ki-67+)、肌成纤维细胞分化(αSMA+)及TGF-β信号激活(pSMAD2+)情况;体外实验中敲低施万细胞的Ccl2或Ccl7基因,检测其条件培养基对骨髓单核细胞的招募能力。
二、研究发现
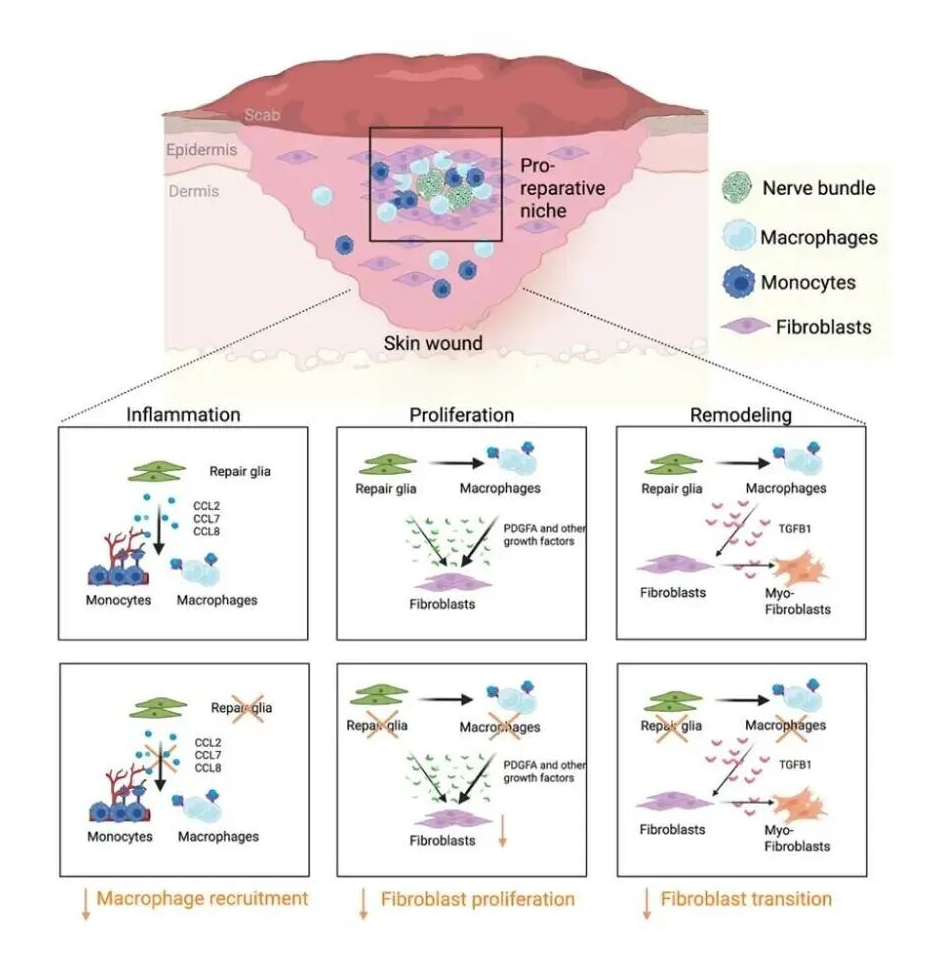
(一)损伤后修复型胶质细胞在创面形成促修复微环境
多重荧光成像结果显示,损伤后第4天,NGFR高表达的修复型胶质细胞主要聚集在创面内的神经束周围。与未损伤皮肤相比,创面神经束周围显著富集了成纤维细胞和CD45+免疫细胞,且EdU+增殖细胞数量大幅增加(p=6.551e-05)。Sholl分析证实,成纤维细胞密度与距离神经束的远近呈正相关,而未损伤皮肤中该细胞分布均匀,表明损伤早期以修复型胶质细胞为中心形成了富含增殖细胞和免疫细胞的"促修复微环境"。
(二)损伤诱导胶质细胞发生去分化转变
单细胞RNA测序分析显示,未损伤皮肤的胶质细胞高表达成熟施万细胞标志基因(如Mpz);而损伤后第4天的胶质细胞呈现出失巢化特征,转录因子Sox2/Ngfr表达上调,表现出类似胚胎前体状态的去分化表型。Sox10条件性敲除后,胶质谱系细胞丧失,创面修复相关信号通路显著下调,证实Sox10对维持修复型胶质细胞的功能至关重要。
(三)胶质细胞通过调控巨噬细胞影响成纤维细胞功能
Sox10 cKO小鼠创面分析显示,损伤后第2、4天神经束周围的CD45+免疫细胞和EdU+增殖细胞数量显著减少;多色流式检测发现,单核细胞和巨噬细胞数量大幅下降,TGF-β1+巨噬细胞减少,而中性粒细胞在第4天反而升高,提示胶质细胞缺失导致巨噬细胞介导的炎症调控受损。同时,成纤维细胞总数及其增殖能力(Ki-67+)显著降低,肌成纤维细胞(αSMA+)数量及TGF-β信号下游pSMAD2+细胞减少,表明胶质细胞通过调控巨噬细胞间接影响成纤维细胞的增殖与分化。
(四)CCL2-CCR2轴介导胶质细胞对巨噬细胞的招募作用
空间转录组与RNAscope原位杂交结果显示,损伤早期(第2天)神经束周围的胶质细胞高表达单核细胞趋化蛋白基因Ccl2/7/8,且该信号沿神经束向周围呈梯度递减。体外实验中,敲低施万细胞的Ccl2或Ccl7基因后,其条件培养基对骨髓单核细胞的招募能力显著减弱;胶质细胞特异性Ccl2敲除小鼠创面的巨噬细胞数量显著减少,伤口愈合延迟,该表型与Ccr2全身敲除小鼠一致,证实胶质源CCL2-CCR2轴是巨噬细胞招募及伤口修复的关键调控通路。
三、启示与总结
本研究通过多组学技术与遗传模型结合,首次明确外周神经胶质细胞在皮肤伤口早期愈合中的核心调控作用。皮肤损伤后,神经胶质细胞发生去分化转变为修复型胶质细胞,在神经束周围形成促修复微环境,为免疫细胞募集和成纤维细胞增殖提供支持。
机制上,本研究揭示“修复型胶质细胞-趋化因子-巨噬细胞-成纤维细胞”调控轴:修复型胶质细胞分泌CCL2/7/8等趋化因子招募单核细胞分化为巨噬细胞,后者通过TGF-β1等细胞因子调控成纤维细胞增殖及肌成纤维细胞分化,推动创面修复。该发现完善了伤口愈合细胞互作网络理论,突破既往研究局限,凸显神经-免疫-间充质细胞跨界互作的重要性。
临床层面,胶质细胞缺失或趋化因子分泌障碍会导致炎症启动延迟、修复细胞增殖不足,影响愈合进程。因此,靶向调控修复型胶质细胞激活、增强其趋化因子分泌,或干预CCL2-CCR2轴优化巨噬细胞功能,可为糖尿病足、压疮等慢性创面提供新的治疗思路。
本研究存在一定局限:聚焦伤口早期愈合阶段,修复型胶质细胞在组织重塑后期的作用、是否通过其他信号分子调控修复,以及该机制在人类皮肤中的保守性,均需进一步探究。未来可借助单细胞时空测序技术追踪细胞动态互作,开展临床转化研究,为创面修复药物开发提供更直接的实验依据。
综上,外周神经修复型胶质细胞是皮肤伤口早期愈合的关键时空调控因子,其通过趋化因子招募巨噬细胞、调控成纤维细胞功能,构成核心调控网络。该发现丰富了伤口修复分子机制理论,提供了新的潜在靶点,兼具基础研究价值与临床转化前景。












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


