在肿瘤发生与转移进程中,恶性细胞通过累积遗传和非遗传改变逐步获得高度异质性,这种异质性进一步塑造了复杂多样的肿瘤免疫微环境(Tumor Immune Microenvironment, TIME)。肿瘤免疫微环境由免疫细胞、基质细胞、细胞因子、趋化因子及代谢产物等多种成分构成,其异质性体现为这些成分在空间分布和时间进程中的动态变化,几乎存在于所有实体瘤中。
抗肿瘤免疫的异质性与疾病进展、治疗敏感性密切相关,尤其在免疫检查点抑制剂(Immune Checkpoint Inhibitors, ICI)治疗领域,成为影响疗效的关键因素。近年来,多区域测序、单细胞测序及纵向液体活检等技术的发展,为解析肿瘤免疫微环境异质性的复杂性提供了有力工具。深入理解其起源机制和生物学特征,对于优化临床评估体系、开发更有效的个性化治疗方案具有重要意义。
一、肿瘤免疫微环境异质性的起源机制
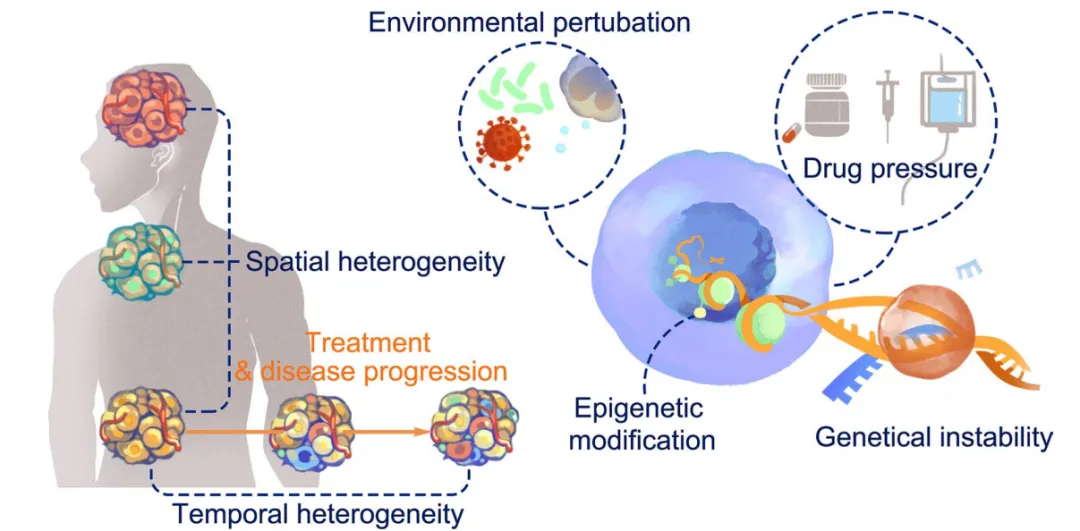
肿瘤免疫微环境异质性的形成是遗传变异、表观遗传调控、微环境适应及治疗选择压力等多因素共同作用的结果,这些机制相互交织,推动了免疫微环境在时空维度上的动态演化。
Jia Q, Wang A, et al. Heterogeneity of the tumor immune microenvironment and its clinical relevance. Exp Hematol Oncol. 2022 Apr 23;11(1):24.
(一)遗传不稳定性
遗传不稳定性是肿瘤异质性产生的根本驱动力。高通量测序研究证实,肿瘤细胞在增殖过程中会随机发生单核苷酸突变、插入缺失、拷贝数变异等遗传改变。其中,驱动基因突变赋予肿瘤细胞生存优势,使其发展为优势克隆群体;而乘客突变虽不直接促进肿瘤生长,但构成了亚克隆细胞的主要来源。这些遗传变异共同塑造了肿瘤细胞的抗原谱差异,为免疫微环境异质性奠定了基础。
(二)表观遗传修饰
表观遗传调控在免疫微环境异质性形成中发挥关键作用。DNA甲基化、染色质可及性改变及非编码RNA介导的转录后调控等机制,可促进肿瘤细胞恶性进展并赋予其环境适应能力。与遗传变异不同,表观遗传修饰具有条件可逆性且可被子代细胞继承,使得肿瘤细胞在空间分布和纵向发展中呈现显著异质性,进而影响免疫细胞的浸润模式和功能状态。
(三)微环境扰动适应
肿瘤细胞持续暴露于细胞外微环境的动态变化中,包括氧气张力、葡萄糖可用性、氧化应激等扰动因素。肿瘤内血管分布的异质性导致不同区域存在氧供差异,诱导免疫成分通过代谢重编程适应环境——缺氧条件下,肿瘤细胞和免疫细胞会发生糖酵解代谢转换,表现为葡萄糖消耗增加、乳酸堆积和微环境酸化,这种代谢异质性进一步加剧了免疫微环境的功能分化。此外,DNA损伤反应、未折叠蛋白质反应等细胞内适应性应答,也参与了免疫微环境异质性的形成。
(四)抗肿瘤治疗的选择压力
抗肿瘤治疗是驱动免疫微环境异质性演化的重要外部因素。放疗、化疗及免疫检查点抑制剂(ICI)等治疗手段会对肿瘤细胞和免疫细胞造成选择性压力:敏感克隆通过自噬介导的细胞死亡释放ATP,可诱导局部炎症反应;而细胞外核苷酸酶可将ATP转化为腺苷,形成免疫抑制微环境。同时,免疫细胞在治疗过程中会发生表型重塑,如T细胞亚群组成改变和细胞因子分泌谱调整,这种治疗诱导的动态相互作用显著促进了时空异质性的形成。
二、肿瘤免疫微环境异质性的核心特征
肿瘤免疫微环境异质性主要表现为空间异质性和时间异质性两个维度,二者共同决定了肿瘤的免疫表型和临床行为。
Jia Q, Wang A, et al. Heterogeneity of the tumor immune microenvironment and its clinical relevance. Exp Hematol Oncol. 2022 Apr 23;11(1):24.
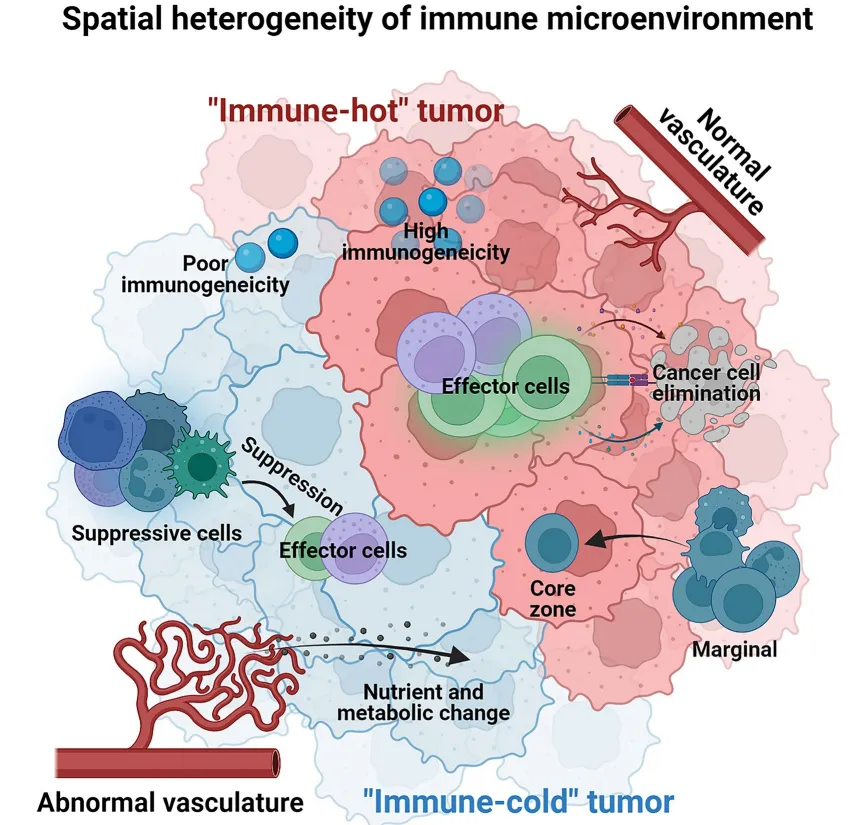
(一)空间异质性
空间异质性指免疫微环境成分在肿瘤组织内的分布差异,主要体现在以下方面:
1. 免疫分子表达异质性:抑制性免疫检查点(如PD-L1)的表面表达、免疫抑制/促炎细胞因子的分泌呈现区域特异性;
2. 免疫细胞浸润异质性:效应T细胞、调节性T细胞(Treg)、巨噬细胞等免疫细胞的浸润丰度和功能状态存在空间差异,如胃癌中CD68+CD163+CD206+巨噬细胞主要位于基质区,而CD68+IRF8+巨噬细胞在肿瘤核心区过表达;
3. 组织结构异质性:血管系统状态、肿瘤边缘与核心区域的空间距离、代谢营养素分布等存在显著差异,形成"免疫热区"和"免疫冷区"的区域分化;
4. 代谢表型异质性:高糖酵解活性的肿瘤细胞可产生乳酸、腺苷等免疫抑制介质,导致局部免疫监视功能减弱,且这种代谢特征的空间分布与免疫细胞功能异质性密切相关。
(二)时间异质性
时间异质性体现为免疫微环境随疾病进展和治疗干预的动态演化。在肿瘤从非侵袭性病变向侵袭性表型发展的过程中,免疫细胞浸润成分发生显著改变,表现为CD8+T细胞和树突状细胞浸润减少,Treg、骨髓来源抑制性细胞(MDSC)等免疫抑制细胞异常聚集。同时,肿瘤进展过程中还会出现细胞溶解活性受损、T/B细胞克隆性受限及进行性衰竭等现象。治疗干预会进一步加速时间异质性演化,如ICI治疗可诱导T细胞表型重塑,导致不同治疗阶段的免疫微环境功能状态显著差异。
三、TIME异质性对免疫治疗科研的影响
(一)生物标志物研发的挑战
PD-L1表达、TMB、dMMR等常用免疫治疗预测生物标志物,均受TIME异质性显著影响,预测效能受限。PD-L1表达在肿瘤内、肿瘤间及时空维度存在差异,如NSCLC原发灶与脑转移灶的PD-L1表达不同,且受IFN-γ信号通路异质性调控,导致PD-L1阳性患者可能无应答、阴性患者或获益;TMB高患者的ICI治疗反应异质性强,抗原呈递机制缺陷(如HLA异常、B2M缺失)会引发抵抗,部分TMB低患者仍可获益;dMMR患者虽整体敏感,但免疫细胞浸润异质性、免疫编辑及代谢重编程等因素,仅少数能获得持久应答。因此,单一生物标志物难以全面反映异质性,开发整合多维度信息的复合标志物成为科研热点。
(二)耐药机制研究的核心方向
TIME异质性是免疫治疗耐药的重要诱因,相关科研聚焦三大方向:
一是抗原丢失耐药,肿瘤细胞克隆进化丢失关键抗原,导致效应T细胞无法杀伤,单细胞测序可追踪耐药克隆轨迹;
二是免疫抑制微环境庇护,TIME中固有或治疗诱导的免疫抑制区域,因富集免疫抑制细胞或介质成为耐药克隆“庇护所”,空间转录组学可解析其细胞组成与分子特征;
三是代谢异质性介导耐药,高乳酸等代谢异质性区域抑制T细胞活性,降低ICI敏感性,代谢通路抑制剂与ICI联合治疗是潜在突破方向。
四、克服肿瘤免疫微环境异质性的策略
Jia Q, Wang A, et al. Heterogeneity of the tumor immune microenvironment and its clinical relevance. Exp Hematol Oncol. 2022 Apr 23;11(1):24.
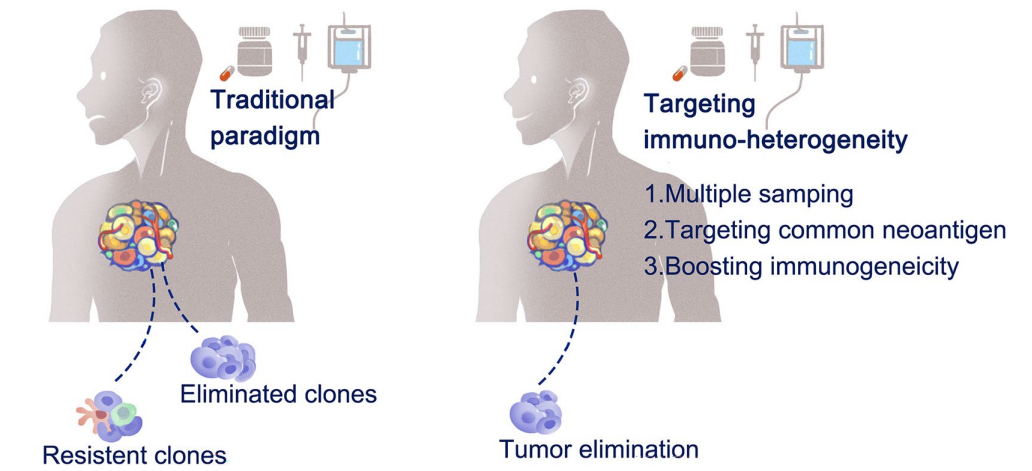
针对免疫微环境异质性的干预策略需聚焦于覆盖异质性群体、增强免疫原性及动态监测调整,具体包括以下方向:
(一)靶向公共新抗原
公共新抗原来源于癌基因驱动突变或基因组热点突变,在特定癌症亚型的患者群体中共享表达,如KRAS G12D突变常见于胰腺癌、结直肠癌等多种肿瘤,TP53热点突变在恶性肿瘤中广泛存在。与个性化新抗原相比,靶向公共新抗原的治疗可覆盖肿瘤异质性群体,避免因抗原丢失导致的免疫逃逸,为开发广谱性肿瘤疫苗和细胞治疗产品提供了思路。
(二)多抗原靶向策略
通过同时靶向多个抗原可有效克服免疫原性异质性。在CAR-T细胞治疗中,双靶点策略已显示出良好应用前景,如抗CD38/BCMA CAR-T细胞治疗多发性骨髓瘤、抗CD19/CD22双特异性CAR-T细胞治疗B细胞非霍奇金淋巴瘤等,可最大限度降低单一抗原丢失导致的治疗失败风险。此外,多表位疫苗的开发也有助于拓宽抗原覆盖范围,增强治疗效果的稳定性。
(三)促进免疫原性细胞死亡与表位扩散
肿瘤疫苗通过传递高免疫原性抗原,可引发炎症环境并促进表位扩散,拓宽T细胞识别谱,实现对异质性肿瘤的全面覆盖。个性化新抗原疫苗(包括合成肽疫苗、RNA疫苗及树突状细胞负载疫苗)已在临床研究中显示出强大的新抗原特异性T细胞激活能力,可诱导多样化T细胞库形成。此外,溶瘤病毒、酪氨酸激酶抑制剂、放疗等手段可通过诱导免疫原性细胞死亡,释放肿瘤相关抗原和危险信号,激活全身性抗肿瘤免疫应答,重塑免疫微环境均一性。
(四)技术创新驱动机制研究
LabEx 凭借多组学检测成熟经验、标准化操作体系及专业数据分析实力,其单细胞测序、DSP 空间多组学及样本动态追踪技术已成为解析 TIME 异质性的核心利器。单细胞测序精准区分细胞亚群与功能状态,DSP 空间多组学以高分辨率定位区域分子特征,结合严格样本处理流程可动态监测 TIME 时间异质性。依托全面技术平台优势,这些技术为异质性调控机制研究、精准靶向策略开发提供强力支撑,助力肿瘤免疫治疗精准化研究提质增效。
五、结语
肿瘤免疫微环境异质性是肿瘤生物学的核心特征,其起源于遗传与表观遗传的内在变异,受微环境扰动和治疗压力的外在驱动,在时空维度上呈现复杂的动态演化模式。这种异质性不仅是预测性生物标志物效能有限的主要原因,也是免疫治疗耐药产生的关键机制。未来的研究需进一步解析异质性调控的分子网络,开发更精准的动态监测技术,同时探索多靶点、多模态的联合治疗策略,通过重塑免疫微环境均一性,实现对异质性肿瘤的有效控制,推动肿瘤免疫治疗向更高效、更持久的方向发展。












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


