一、引言:GBM的临床挑战与免疫微环境特征
多形性胶质母细胞瘤(Glioblastoma Multiforme, GBM)作为最具侵袭性的原发性中枢神经系统恶性肿瘤,其标准治疗方案包括最大安全范围手术切除联合替莫唑胺(TMZ)同步放化疗。然而,该病预后仍不理想,中位总生存期(OS)仅为14至17个月,三年生存率约为10%,这一现状与肿瘤固有的高度侵袭性密切相关。
GBM的肿瘤微环境呈现显著的免疫抑制特性,具体表现为选择性清除浸润的CD4+ T细胞,并抑制与Th1细胞相关的抗肿瘤细胞毒性免疫应答。同时,肿瘤可促使免疫反应向Th17细胞介导的慢性炎症状态转变,从而为肿瘤进展创造有利条件。传统观点认为,中枢神经系统(CNS)因血脑屏障(BBB)的存在及经典淋巴系统的缺失,属于免疫豁免区域。然而,近年研究揭示了CNS与颈深淋巴结之间存在特殊通路,允许脑脊液携带抗原及T细胞进行迁移。在此过程中,小胶质细胞、巨噬细胞及树突状细胞等抗原呈递细胞(APC)可激活T细胞,这些活化的T细胞经血管周围间隙进入CNS并识别肿瘤细胞。该免疫应答过程受到程序性死亡蛋白-1(PD-1)及其配体(PD-L1)信号轴的精密调控,其中活化的T细胞表面PD-1表达尤为关键。
波兰卢布林医科大学免疫学中心Jakub Litak等人于2019年10月在《International Journal of Molecular Sciences》上发表的综述,系统阐述了GBM中PD-L1/PD-1轴的调控作用及其临床意义。
二、研究方法:PD-1/PD-L1轴的免疫调控机制及其在GBM中的作用
本综述聚焦于程序性细胞死亡蛋白-1(PD-1)与其配体(PD-L1)相互作用所构成的免疫调控轴,及其在多形性胶质母细胞瘤(GBM)进展中的关键作用。在生理状态下,PD-1/PD-L1信号通路通过抑制效应T细胞的抗肿瘤活性并促进调节性T细胞(Tregs)功能,负向调控T细胞免疫应答,从而维持自身免疫耐受并防止过度免疫激活。
PD-L1可由多种细胞表达,包括肿瘤细胞、抗原呈递细胞(APC)、B淋巴细胞及组织实质细胞。其与T细胞表面PD-1受体结合后,可募集并激活酪氨酸磷酸酶SHP-2,进而导致T细胞受体下游信号分子Zap70的去磷酸化(图1所示)。该信号传导过程最终抑制T细胞增殖与细胞毒性功能,并可能诱导T细胞凋亡或失能,从而在局部微环境中发挥免疫抑制作用。
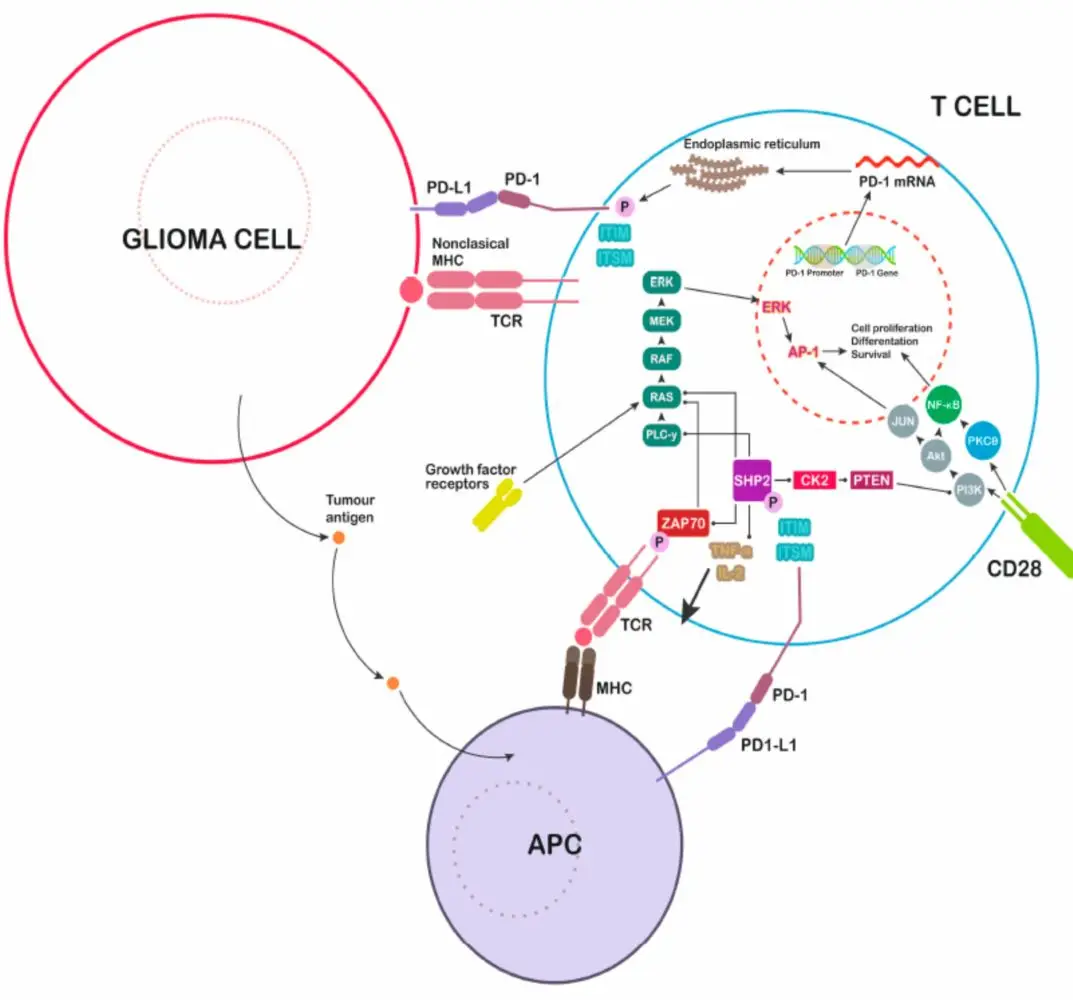 图1. GBM细胞诱导的免疫调节。程序性细胞死亡配体1(PD-L1)分泌抑制免疫反应,阻断T细胞应答。PD-1:程序性细胞死亡因子-1;MHC:主要组织相容性复合物;TCR:T细胞受体;APC:抗原递呈细胞。
图1. GBM细胞诱导的免疫调节。程序性细胞死亡配体1(PD-L1)分泌抑制免疫反应,阻断T细胞应答。PD-1:程序性细胞死亡因子-1;MHC:主要组织相容性复合物;TCR:T细胞受体;APC:抗原递呈细胞。
在GBM病理环境中,肿瘤细胞及肿瘤相关小胶质细胞均呈现PD-L1的过表达,这增强了PD-L1与浸润T细胞上PD-1的结合效率,导致针对肿瘤的免疫应答受到显著抑制。研究表明,GBM通过上调包括PD-L1/PD-1在内的免疫检查点分子表达,主动营造免疫抑制性微环境。其中,胶质瘤细胞是PD-L1的主要细胞来源,其表达水平与肿瘤WHO分级呈正相关,提示PD-L1可能作为胶质瘤恶性程度的潜在生物标志物。GBM细胞可通过激活多种细胞表面受体通路——例如Toll样受体(TLR)、表皮生长因子受体(EGFR)、干扰素-α受体(IFNAR)及干扰素-γ受体(IFNGR)——来诱导PD-L1的表达与分泌,进而逃逸机体免疫监视。
三、研究结果:PD-L1在GBM中的调控通路及免疫治疗潜力
研究系统阐述了GBM肿瘤微环境中PD-L1表达上调的多条关键分子通路及其生物学效应:
1、Toll样受体(TLR)通路:胶质瘤细胞内源性表达TLR。其信号转导主要通过髓样分化因子88(MyD88)依赖与非依赖两条途径进行。非MyD88依赖途径可启动PD-L1的基因转录,而MyD88依赖途径则参与介导PD-L1的过表达。
2、表皮生长因子受体(EGFR)通路:EGFR信号异常活化与细胞凋亡失调、肿瘤血管生成、坏死、增殖加剧及治疗抵抗密切相关。研究表明,PD-L1的表达受到EGFR下游信号转导的正向调控。在GBM小鼠模型中,EGFR原癌基因的激活与磷酸酶PTEN基因缺失共同作用,可显著上调PD-L1表达水平。
3、血管生成相关调节:GBM具有高度侵袭性与血管生成特性。PD-1/PD-L1轴被发现可能通过调节血管内皮生长因子(VEGF)水平来影响肿瘤血管生成。部分临床研究提示原发性胶质瘤患者的PD-L1表达与VEGF水平呈正相关,但也有证据表明VEGF相关基因与PD-L1活性间存在负相关关系,二者间的确切相互作用机制尚需进一步阐明。
4、干扰素(IFN)信号通路:干扰素诱导的细胞内信号对胶质瘤的抗肿瘤免疫应答具有负性调节作用。具体而言,II型干扰素(IFN-γ)通过激活JAK2/STAT1/IRF1信号轴上调PD-L1表达;而I型干扰素(如IFN-α/β)则典型地通过STAT3、STAT2及IRF9轴传递信号(图2所示)。
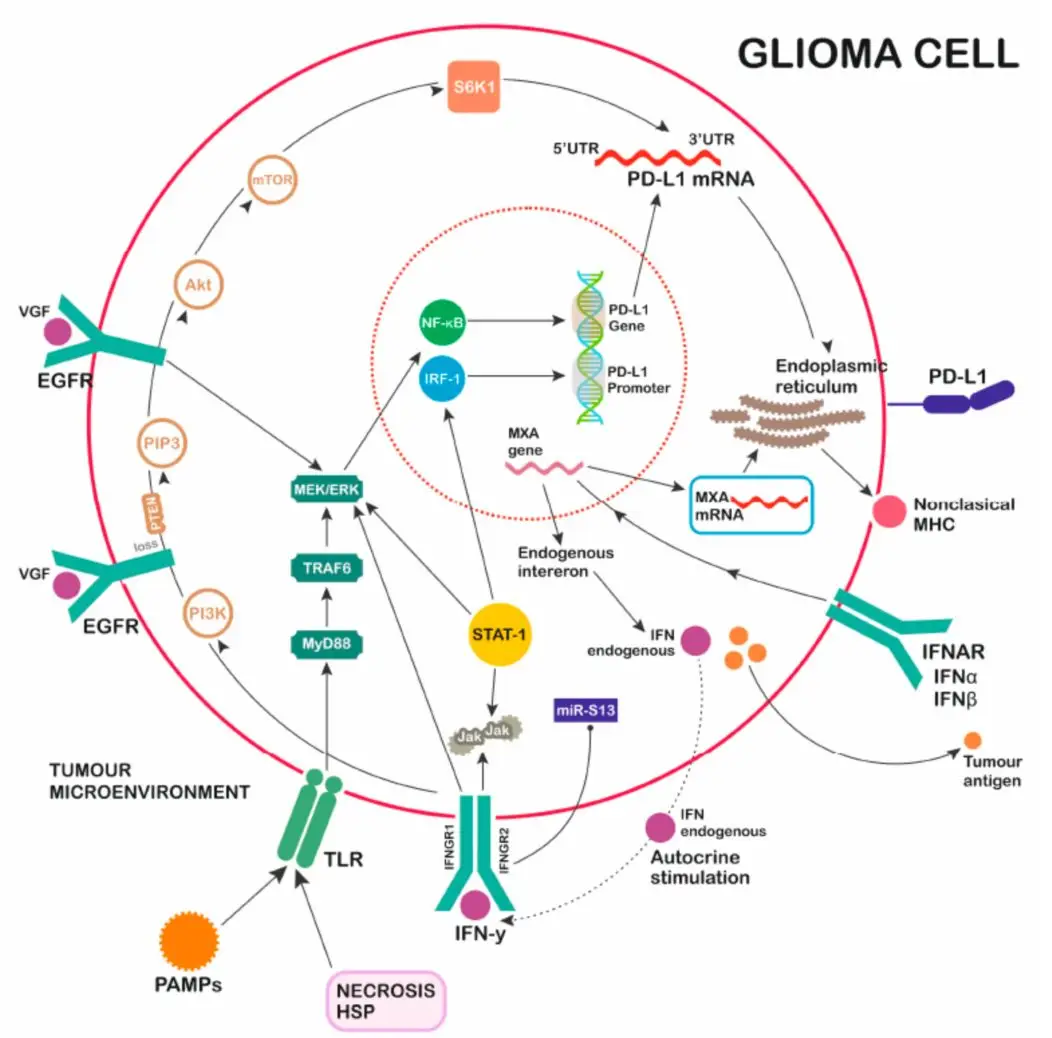 图2. GBM诱导PD-L1分泌。多种活化途径(TLR、EGFR、IFNAR、IFNGR)促进PD-L1表达:①Toll样受体(TLR)途径:病原体相关分子模式(PAMPs)、坏死、热休克蛋白(HSP)作为TLR髓样分化因子88(MyD88)依赖途径的激活剂,通过TRAF6/MEK/ERK/NF-κB传递信号。②表皮生长因子受体(EGFR)通路:TGFα/EGF/VGF/MUTATION OF RECEPTOR作为通过MEK/ERK(STAT-1)/NF-κB的EGFR通路信号的激活剂。③IFNAR通路:干扰素(IFN-α)和IFN-β作为IFNAR通路信号的激活剂,通过MXA基因转录,形成非经典MHC,促进PD-1L转录,并诱导内源性干扰素。④IFNGR通路:IFN-γ作为IIFNGR通路信号转导的激活剂,通过JAK/STAT-1/MEK/ERK/IRF-1和PI3K/PIP3/Akt/mTOR/S6K1,对转录的PD-1L mRNA具有调控功能。
图2. GBM诱导PD-L1分泌。多种活化途径(TLR、EGFR、IFNAR、IFNGR)促进PD-L1表达:①Toll样受体(TLR)途径:病原体相关分子模式(PAMPs)、坏死、热休克蛋白(HSP)作为TLR髓样分化因子88(MyD88)依赖途径的激活剂,通过TRAF6/MEK/ERK/NF-κB传递信号。②表皮生长因子受体(EGFR)通路:TGFα/EGF/VGF/MUTATION OF RECEPTOR作为通过MEK/ERK(STAT-1)/NF-κB的EGFR通路信号的激活剂。③IFNAR通路:干扰素(IFN-α)和IFN-β作为IFNAR通路信号的激活剂,通过MXA基因转录,形成非经典MHC,促进PD-1L转录,并诱导内源性干扰素。④IFNGR通路:IFN-γ作为IIFNGR通路信号转导的激活剂,通过JAK/STAT-1/MEK/ERK/IRF-1和PI3K/PIP3/Akt/mTOR/S6K1,对转录的PD-1L mRNA具有调控功能。
临床转化前景:针对免疫检查点的单克隆抗体疗法为肿瘤免疫治疗带来了突破性进展。这类抗体可通过阻断免疫效应细胞上的抑制性受体(如PD-1)或肿瘤/辅助细胞上的相应配体(如PD-L1),解除免疫抑制。临床前GBM小鼠模型研究已证实,靶向PD-1/PD-L1轴的单克隆抗体具有良好安全性,并能有效诱导肿瘤消退、显著延长荷瘤动物生存期。目前,针对复发性多形性胶质母细胞瘤患者的临床试验正在评估PD-1/PD-L1抑制剂的疗效与安全性。
四、结论:靶向PD-1/PD-L1轴作为GBM治疗的新策略
综上所述,多形性胶质母细胞瘤(GBM)对现有标准疗法普遍存在高度抵抗,其侵袭性强、总生存期短的特点至今未能有效克服。因此,靶向PD-1/PD-L1免疫检查点轴被认为是一个具有重要前景的治疗方向。该通路在GBM免疫逃逸机制中发挥关键作用:通过激活PD-L1/PD-1信号,肿瘤细胞得以依赖性地逃避免疫清除。而使用特异性单克隆抗体阻断PD-1与PD-L1之间的相互作用,则有望恢复效应T细胞的抗肿瘤活性,重建机体对GBM的免疫监视。
近期临床试验表明,PD-1/PD-L1抑制剂能够在一定程度上缓解肿瘤进展。尽管现有研究尚未能明确证实该类单药治疗可显著延长患者总生存期,但若将其与手术、放化疗及替莫唑胺等标准治疗方案联合应用,则可能通过协同作用为GBM患者带来更优的临床获益。未来仍需进一步开展深入的研究,以优化联合治疗策略、筛选潜在获益人群,并阐明其耐药机制。












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


