一、引言:传统药物发现的严峻挑战
传统药物发现过程面临周期漫长、成本高昂及成功率低的严峻挑战。据行业数据统计,单一创新药物的研发平均需投入十年以上的时间与约二十亿美元的资金,而最终获批上市的成功率不足万分之一。这一过程被形象地比喻为在未知目标形态的前提下于茫茫海洋中寻觅特定沙粒,其难度与偶然性可见一斑。
二、传统药物筛选模式的根本局限
在人工智能技术应用于药物发现领域之前,药物筛选主要依赖于基于实验经验的试错方法,其局限性可概括为以下几个阶段:
1、大规模实验筛选的低效性:研究团队需依托自动化设备,将海量化合逐个添加至如96孔或384孔板等标准化实验平台中进行生物活性测试。一次典型的高通量筛选通常涉及数十万乃至上百万次独立操作,工作强度大且流程繁琐。
2、缺乏理论指导的随机性:由于对药物靶点作用机制及有效化合物结构特征认知有限,筛选过程往往缺乏明确方向,需对庞大化合物库进行近乎穷举式的随机测试。据统计,即便完成数十万次筛选,也仅能发现极少数的先导化合物候选分子。
3、临床前优化的冗长周期:初步显示活性的化合物需经历多轮系统的结构修饰、体外与体内毒性评价、药代动力学及药效学研究等复杂流程。从先导化合物确定到进入临床研究阶段,通常需耗费五至八年时间。
4、罕见病药物研发的经济困境:对于患者群体规模较小的罕见疾病,由于传统研发模式经济回报率低,企业投入意愿普遍不足。全球已知约七千种罕见病中,超过百分之九十五至今仍缺乏有效治疗药物,这一现状主要源于现有研发模式在经济性与可行性方面的双重局限。
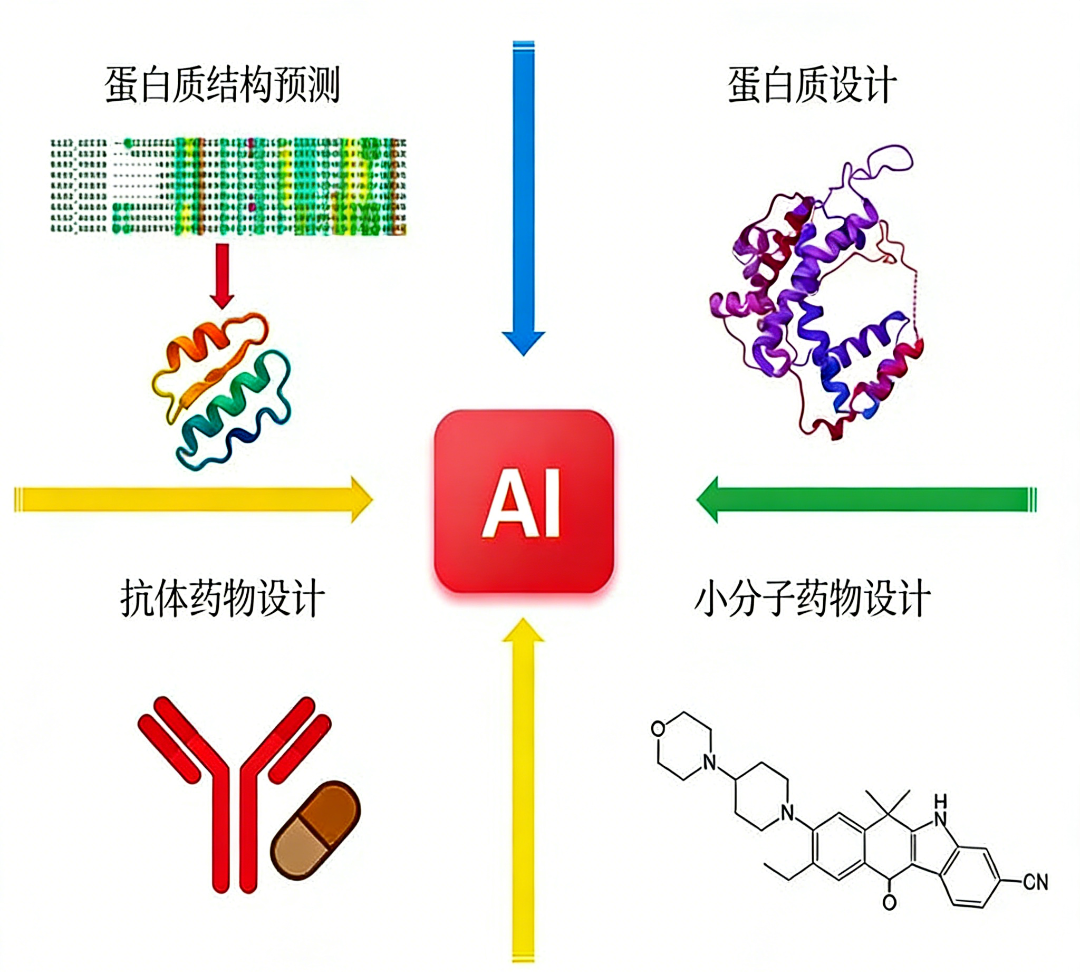
在此背景下,以人工智能为代表的新兴技术正为药物发现领域带来革命性突破。通过整合深度学习、自然语言处理及多模态数据融合等先进算法,人工智能系统能够实现对海量文献、化学数据库及生物医学信息的快速解析与深度挖掘,从而精准预测化合物性质、优化分子设计,并大幅加速候选药物的筛选与优化进程。此类技术的应用,有望将传统模式下需数百年的计算与分析任务压缩至数天完成,显著提升研发效率,降低失败风险,并为包括罕见病在内的广泛疾病治疗开辟新的药物研发路径。
三、人工智能驱动的药物智能筛选新范式
以人工智能为核心的药物发现技术,正通过先进的深度学习方法,从根本上变革药物筛选的范式,构建起一个高效、精准的智能导航系统。
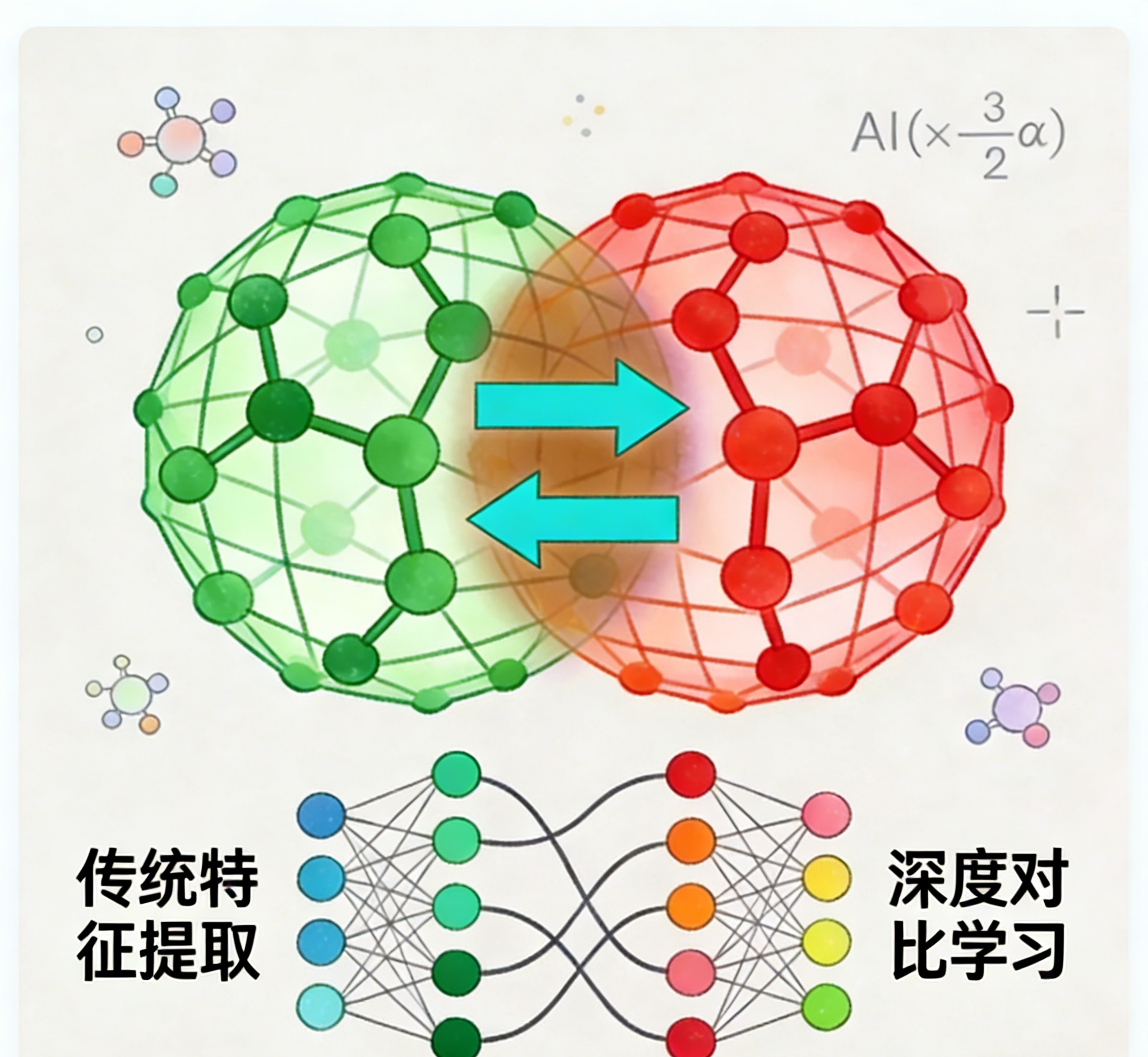
1、基于深度对比学习的分子语义解析
此方法的核心是深度对比学习框架。其训练过程旨在让模型理解分子“语言”:通过分析海量分子对,学习识别结构差异与生物活性相似性之间的内在关联。如同进行系统的“差异识别”训练,模型通过反复比较不同分子的结构特征,逐渐建立起从特定化学基团(如苯环、羟基等)及其空间排布到预估生物活性的预测能力。
该模型的训练涉及前所未有的数据规模:涵盖约一万个人类蛋白靶点(约占人类蛋白质组的三分之一),分析超过两万个蛋白质结合口袋,处理高达五亿个类药性小分子结构数据。此数据量远超人工处理极限,传统研究方式需要数百年才能完成同等规模的分析。
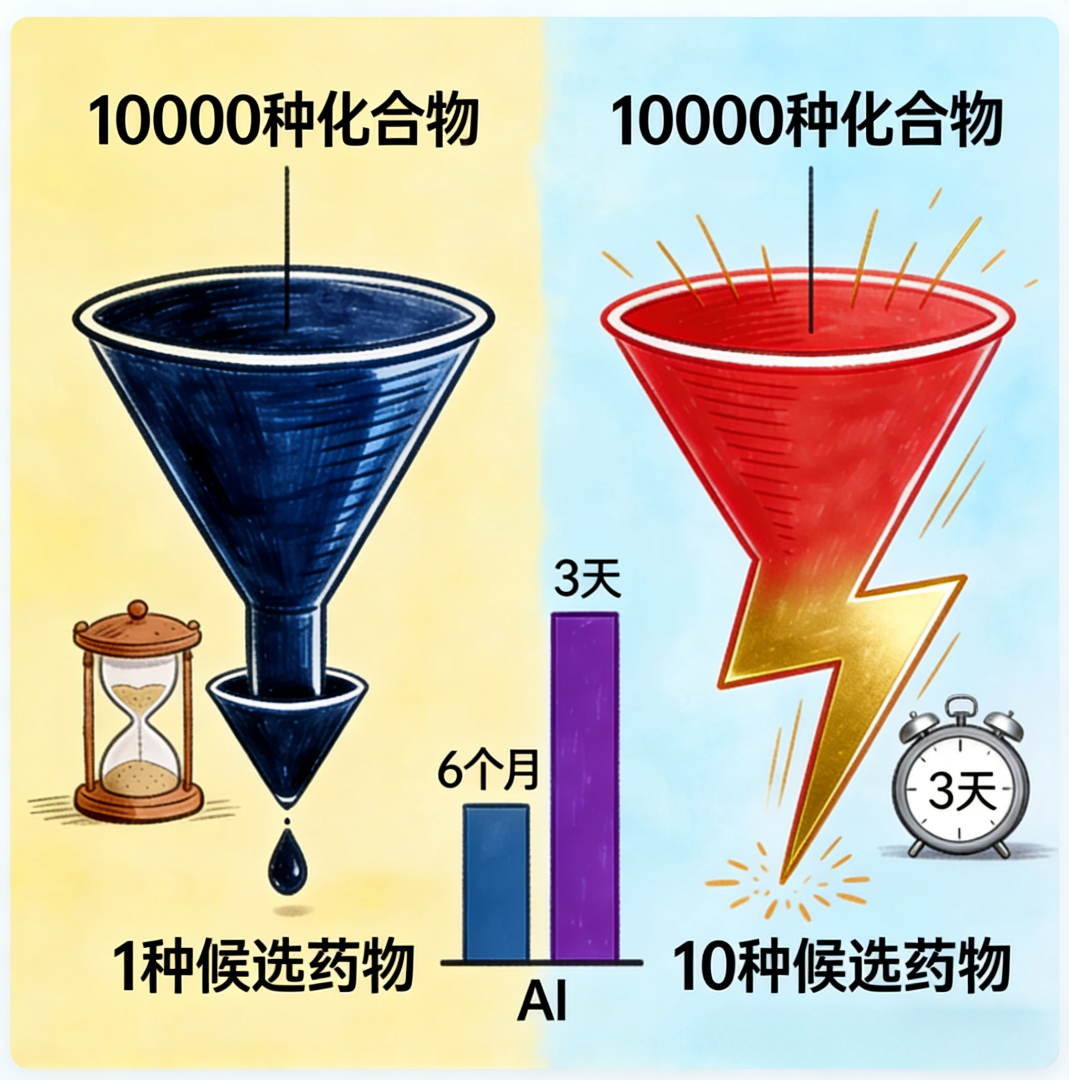
2、实现超高通量的智能虚拟筛选
传统实验筛选模式每天仅能完成数万个化合物的测试,而人工智能虚拟筛选系统可在数秒内对数百万个化合物进行初步评估。其效能跃升源于多模态数据的融合分析:
👉结构匹配:模拟小分子与靶蛋白口袋的三维空间对接,计算几何形状与化学表面的互补性。
👉相互作用分析:系统评估氢键、疏水作用、静电作用等多种分子间作用力。
👉序列信息利用:在靶蛋白三维结构未知的情况下,利用其氨基酸序列预测潜在结合位点。
👉功能上下文整合:结合靶点所在的生物学通路与功能信息,提升预测的特异性与可靠性。
通过整合上述多维信息,此类人工智能系统的预测准确率与效率可显著超越传统随机筛选方法。
3、整合动态构象预测以提高结合亲和力
传统的基于结构的药物设计常将蛋白质视为静态结构。然而,蛋白质在生理环境中存在复杂的构象动力学。先进的人工智能方法通过整合分子动力学模拟原理,能够预测蛋白质结合口袋的动态变化,从而筛选出即使在靶标蛋白发生构象调整时仍能保持稳定结合的小分子配体。这相当于寻找能够适应“锁芯”晃动的“柔性钥匙”,大大提高了发现高亲和力、高选择性化合物的可能性。
4、多源生物医学数据的跨模态融合
该技术框架的另一大突破在于实现了结构生物学、基因组学与功能组学数据的系统性融合。人工智能模型通过学习不同数据模态间的复杂对应关系——例如,特定氨基酸序列如何决定蛋白质的空间折叠,而特定结构又如何介导其生物学功能——从而构建出更全面的靶点-配体相互作用认知模型。这对于研究传统方法难以解析的靶点(如某些膜蛋白)尤为重要。尽管这类靶点的实验结构数据稀缺,但人工智能模型能够利用其序列与同源信息,推断出潜在的可成药位点。
四、结论
综上所述,通过深度对比学习、超高通量虚拟筛选、动态构象预测以及多模态数据融合,人工智能技术为药物发现领域提供了强大的智能导航系统。它正将传统需要耗时数百年的早期筛选与优化工作,压缩至可管理的时间范围内,极大地加速了先导化合物的发现进程。这不仅有望显著降低新药研发的成本与周期,提高成功率,也为攻克罕见病等长期未被满足的医疗需求,开辟了充满希望的全新路径,标志着药物发现已步入一个由数据和智能驱动的新纪元。












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


