衰老与神经退行性疾病、癌症等多种年龄相关疾病密切相关。饮食限制(CR)是经证实可延长多物种寿命的有效干预方式,其通过重塑代谢网络、激活AMPK、sirtuins等信号通路,减少细胞损伤以延长健康寿命。尽管AMPK激动剂如二甲双胍已展现潜在抗衰老作用,但CR诱导的代谢物如何直接调控相关通路仍不明确。本文基于基于厦门大学林圣彩院士团队在Nature发表的两篇研究,通过筛选CR小鼠血清差异代谢物,鉴定出石胆酸(LCA)为关键活性分子,解析其通过TULP3-sirtuin-V-ATPase-AMPK信号轴发挥抗衰老作用的机制,为理解CR的抗衰老效应提供新的代谢调控视角。


一、材料与方法
(一)实验模型
1. 动物模型:C57BL/6小鼠用于CR处理(4个月)、LCA给药及寿命检测;无菌小鼠、抗生素处理小鼠用于肠道菌群相关实验;AMPK肌肉特异性敲除小鼠(a-MKO)、SIRT1-7全敲小鼠、TULP3敲除小鼠用于机制验证。
2. 模式生物:秀丽隐杆线虫(N2菌株、aak-2突变体)、黑腹果蝇(Act5C-GAL4驱动株、AMPKa RNAi株)用于寿命及抗氧化实验。
3. 细胞模型:小鼠胚胎成纤维细胞(MEFs)、HEK293T细胞、原代肝细胞、原代心肌细胞用于体外信号通路验证。
(二)主要实验方法
1. 代谢物检测:采用高效液相色谱-质谱、气相色谱-质谱和毛细管电泳-质谱联用技术分析CR小鼠与正常饮食(AL)小鼠血清代谢物差异。
2. 信号通路分析:Western blot检测AMPK、ACC磷酸化水平及相关蛋白表达;免疫共沉淀验证蛋白相互作用;免疫荧光检测AXIN、LKB1的溶酶体定位。 3. 功能验证:线粒体功能检测(mtDNA拷贝数、氧化磷酸化基因表达、呼吸速率);小鼠肌肉性能评估(握力测试、跑步耐力检测);肌肉再生实验观察PAX-7阳性细胞数量;寿命实验记录线虫、果蝇及小鼠生存曲线。
3. 分子操作:构建V1E1突变体(3KR、3KQ)、TULP3截短体及SIRT家族过表达质粒;通过RNAi技术敲降目标基因;肠道菌群移植实验验证菌群对LCA生成的调控作用。
二、结果
(一)CR小鼠血清中存在AMPK激活型代谢物
与正常饮食小鼠相比,CR处理4个月的小鼠肝脏和肌肉组织中AMPK及其下游分子ACC的磷酸化水平显著上调。将CR小鼠血清分别处理MEFs、HEK293T等细胞系,或通过颈静脉注射到正常饮食小鼠体内,均能快速激活AMPK信号,表明CR小鼠血清中存在可激活AMPK的活性物质。进一步通过高温加热、透析及亲脂液相色谱柱处理发现,该活性物质为热稳定、小分子极性代谢物,排除了蛋白质类分子的可能性。
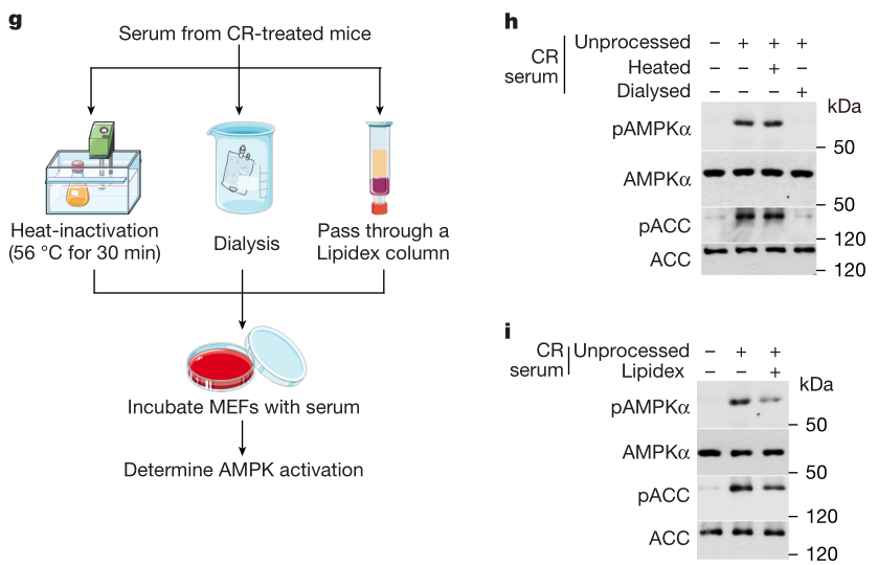
热稳定、小分子极性代谢物介导AMPK的激活
(二)石胆酸(LCA)是CR诱导的AMPK激活关键分子
代谢组学分析显示,CR小鼠血清中共有1215种代谢物发生改变,其中341种为极性代谢物。通过逐一验证,发现仅LCA在生理浓度(1.1 μM)下即可显著激活AMPK信号。口服给予LCA(2-羟丙基-β-环糊精包被,1 g/L)可使小鼠体内LCA水平稳定维持在生理有效浓度,且能模拟CR的AMPK激活效应,证实LCA是CR介导AMPK激活的核心代谢物。
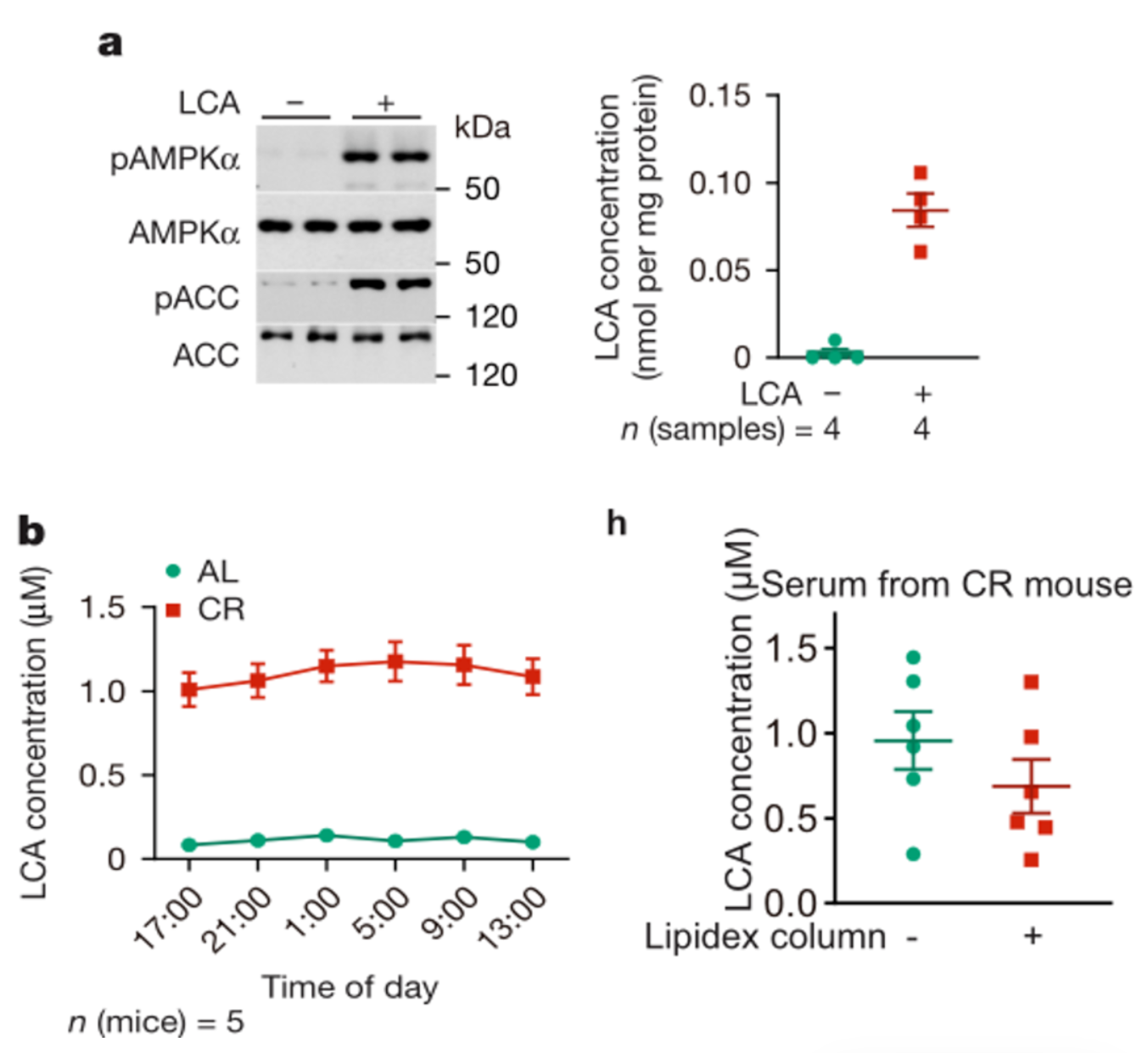
CR后LCA浓度上调并且激活AMPK
(三)LCA通过葡萄糖感知-溶酶体通路激活AMPK
机制研究表明,LCA通过葡萄糖感知-溶酶体通路调控AMPK活性:LCA处理后,溶酶体V-ATPase活性受抑制,促进AXIN和LKB1在溶酶体上的定位,形成V-ATPase-Ragulator-AXIN-LKB1-AMPK复合物,进而激活AMPK。敲降V-ATPase组分(ATP6v0c)、Ragulator组分(LAMTOR1)或AXIN1/2,均可阻断LCA诱导的AMPK激活,证实该通路的必要性。此外,CR小鼠血糖水平维持在5.5 mM以上,表明LCA激活AMPK不依赖于葡萄糖浓度降低。
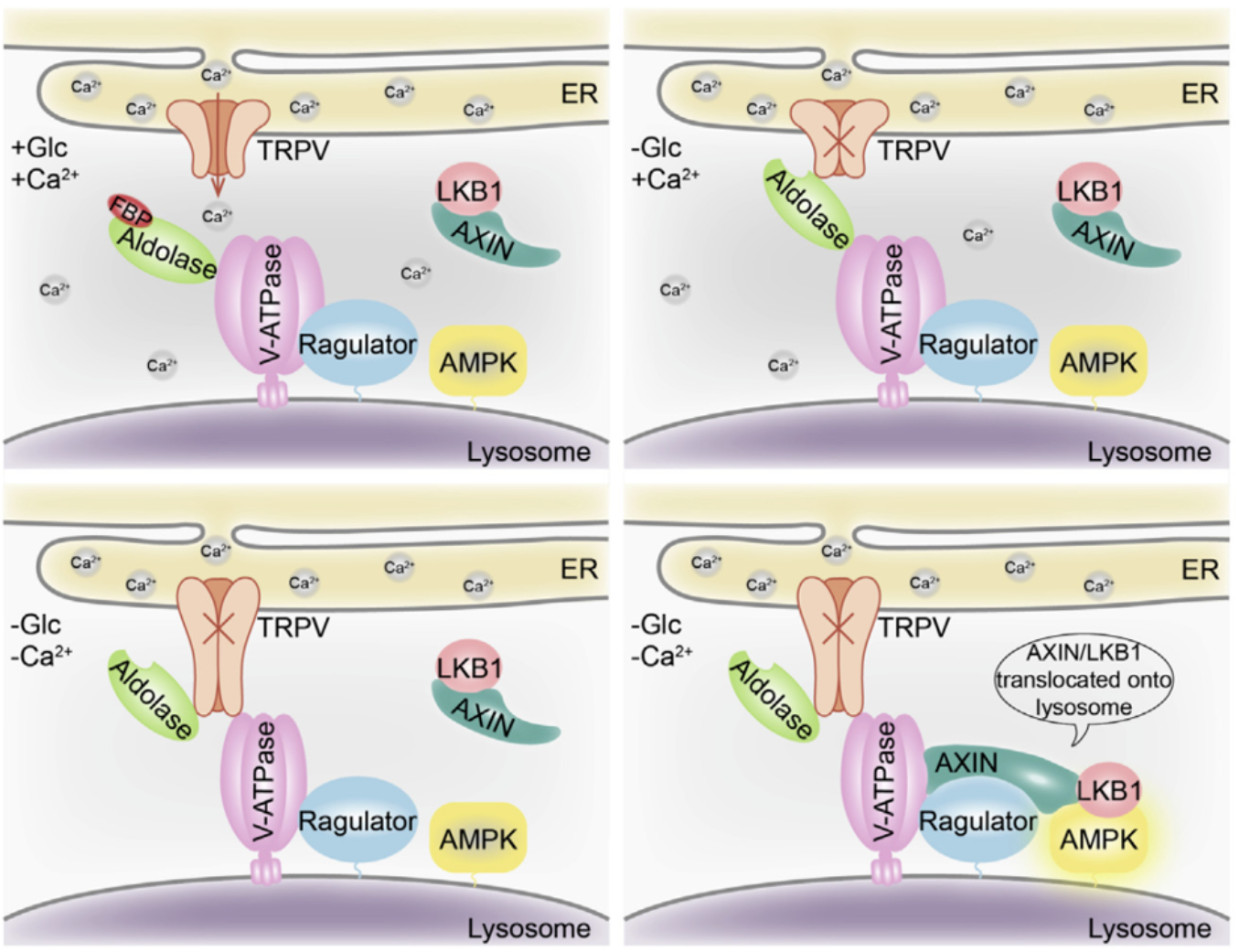
葡萄糖感知-溶酶体-AMPK信号通路
(四)V1E1去乙酰化是LCA激活AMPK的关键修饰
质谱分析发现V-ATPase复合体存在263个乙酰化修饰位点,其中V1E1亚基的K52、K99和K191位点去乙酰化(模拟突变体3KR)可直接激活AMPK,并抑制溶酶体活性、促进AXIN溶酶体定位;而乙酰化模拟突变体(3KQ)则完全阻断LCA的上述效应。CR和LCA处理均能显著降低V1E1(K99)位点的乙酰化水平,证实V1E1去乙酰化是LCA激活AMPK的关键分子事件。
(五)SIRT家族介导LCA诱导的V1E1去乙酰化
过表达SIRT1-7均能增强LCA诱导的AMPK激活,而同时敲除SIRT1-7则完全阻断该效应,且抑制LCA介导的溶酶体失活和AXIN溶酶体定位,表明SIRT家族存在功能冗余,共同调控V1E1去乙酰化。回补实验显示SIRT1的调控作用最为显著,但LCA与SIRT1无直接相互作用,需细胞内其他组分介导二者结合。
(六)TULP3是LCA激活SIRT-AMPK通路的必需分子
通过蛋白质谱鉴定SIRT1潜在互作蛋白,发现TULP3可与SIRT1直接结合,且TULP3的N端60个氨基酸是结合关键区域。敲降TULP3或突变其LCA结合位点(Y193、P195、K333、P336→G),均能阻断LCA诱导的AMPK激活、V1E1去乙酰化及溶酶体功能调控。此外,TULP3同源蛋白在了你线虫和果蝇中高度保守,其功能缺失同样消除LCA的抗衰老效应,证实TULP3是LCA信号通路的核心介导分子。
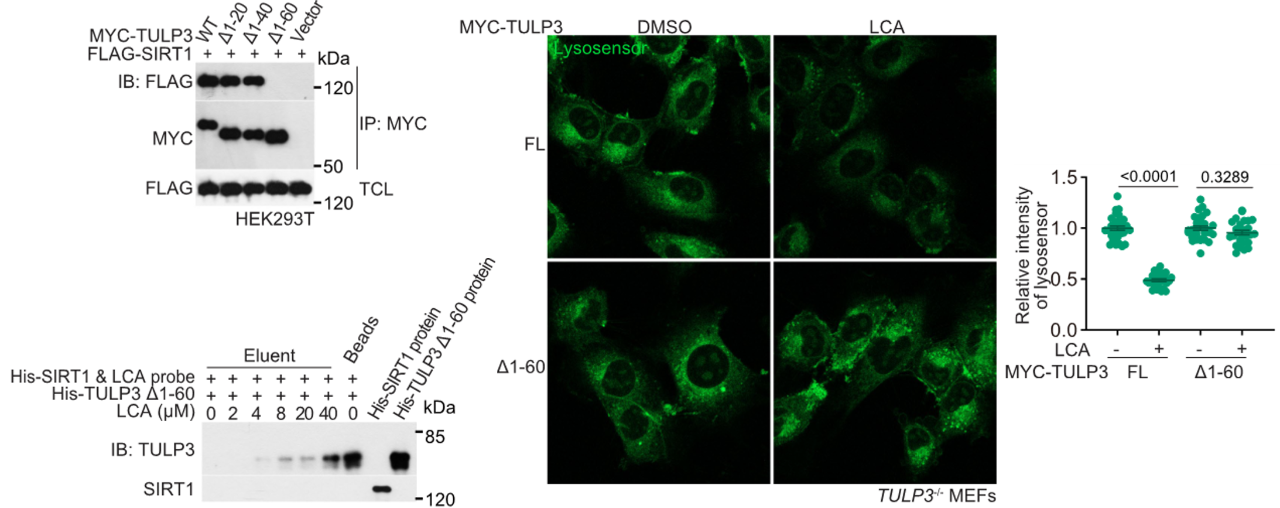
TULP3与SIRT1的结合对于LCA激活AMPK是必需的
(七)LCA的抗衰老效应及肠道菌群调控机制
1.生理功能改善:LCA处理可显著增加小鼠肌肉线粒体含量、mtDNA拷贝数及氧化磷酸化基因表达,提升小鼠握力、跑步耐力及肌肉再生能力;在线虫和果蝇模型中,LCA可延长寿命并增强抗氧化应激能力,且这些效应均依赖AMPK、SIRT及TULP3。
2.肠道菌群调控:CR小鼠粪便及血清中LCA水平显著升高,而无菌小鼠和抗生素处理小鼠的CR血清LCA水平无明显变化;将CR小鼠肠道菌群移植到无菌鼠中可恢复LCA生成,证实CR通过调控肠道菌群代谢促进LCA产生。
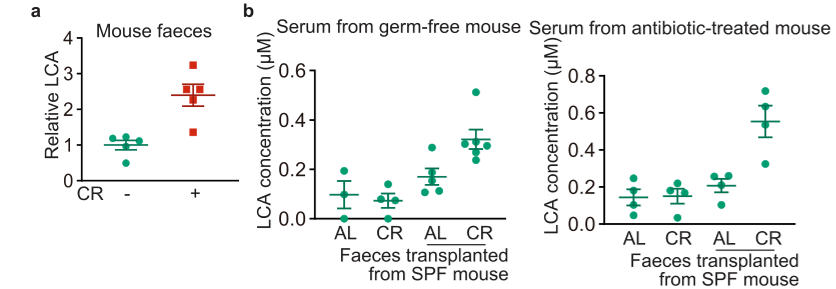
CR通过影响肠道菌群进而影响小鼠血清中的LCA水平
(八)V1E1(3KR)模拟LCA的抗衰老表型
在小鼠中过表达V1E1(3KR)突变体,可模拟LCA和CR的效应,显著增加线粒体质量和肌肉性能,且该表型依赖AMPK和TULP3的功能完整性。在线虫和果蝇中,V1E1(3KR)同样能激活AMPK并延长寿命,证实V1E1去乙酰化是LCA抗衰老通路的关键下游事件。
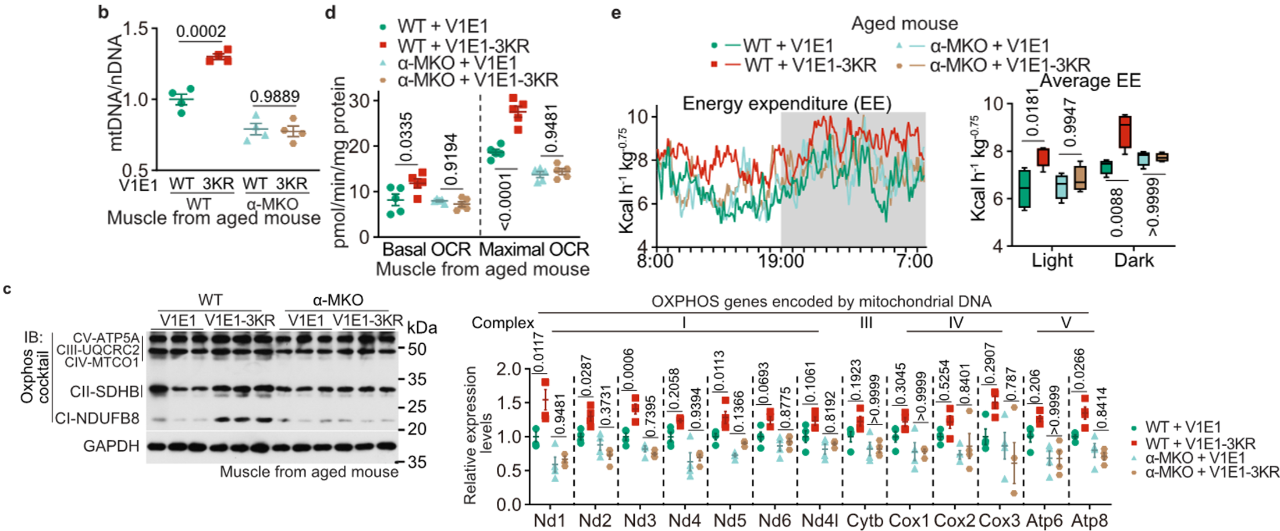
V1E1(3KR)增加了线粒体质量
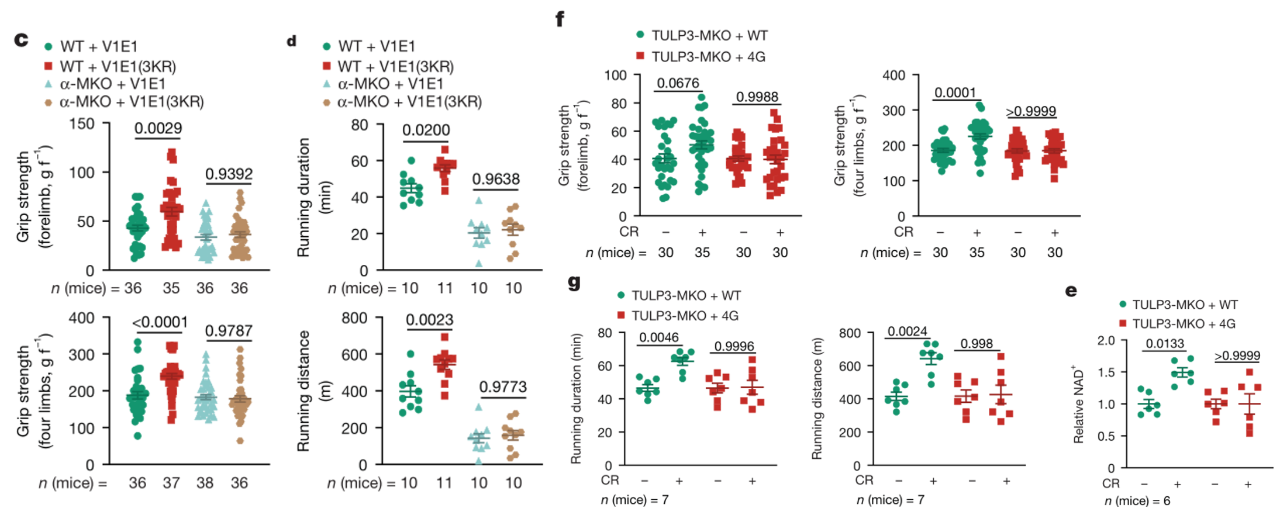
V1E1(3KR)增强了小鼠肌肉力量
三、讨论
本研究首次鉴定出石胆酸(LCA)作为饮食限制(CR)诱导的内源性AMPK激动剂,阐明了其通过TULP3-sirtuin-V-ATPase-AMPK轴发挥抗衰老作用的分子机制,揭示了肠道菌群-代谢物-信号通路的跨界调控网络。研究发现,CR通过重塑肠道菌群促进LCA生成,LCA结合TULP3后激活SIRT家族去乙酰化酶,特异性调控V-ATPase复合体V1E1亚基的去乙酰化修饰,进而通过葡萄糖感知-溶酶体通路激活AMPK,最终实现线粒体功能增强、肌肉性能提升及多物种寿命延长。
该研究具有重要的理论创新意义:
其一,明确了LCA作为CR代谢重编程的关键效应分子,弥补了CR下游代谢调控机制的研究空白;
其二,揭示了TULP3作为LCA受体的全新功能,建立了代谢物-蛋白相互作用调控衰老信号通路的新模式;
其三,证实了V1E1去乙酰化修饰在AMPK激活中的关键作用,为抗衰老药物开发提供了新的分子靶点。
然而,研究仍存在若干待解决的问题:LCA对小鼠的延寿效应相对温和,可能与给药浓度、时间窗口或给药方式相关,需进一步优化干预方案;线虫和果蝇中不存在LCA,但存在TULP3同源蛋白,提示可能存在LCA类似物调控保守的抗衰老通路,有待后续挖掘;LCA作为肠道菌群代谢产物,其吸收机制及发挥作用的组织特异性仍需深入探究。
综上所述,本研究为理解饮食限制的抗衰老机制提供了全新视角,LCA及其调控的信号通路为开发安全有效的抗衰老干预策略提供了重要靶点,具有广阔的转化应用前景。












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


