一、蛋白质定量分析中的BCA法概述
BCA法(二喹啉甲酸法)是一种广泛应用于溶液内蛋白质含量测定的分析技术。该方法基于特定的物理与化学反应,通过显色体系对蛋白质浓度进行定量评估,具有较高的准确性与重复性,已成为生物化学及分子生物学研究中常用的蛋白质定量手段。
在生物体系统中,蛋白质不仅是细胞与组织结构的基本组成成分,也参与并调控各类生理生化过程。因此,对样本中蛋白质含量进行精确测定,是相关实验研究的重要基础。正常生理状态下,人体血液中蛋白质的浓度范围通常维持在60至80克/升之间。
相较于其他定量方法,BCA法在操作上较为简便,且具备良好的灵敏度和线性范围,适用于多种样本类型的蛋白质含量测定。其原理主要依赖于碱性环境下蛋白质分子与二价铜离子的相互作用,以及随后与BCA试剂的显色反应,通过比色分析即可实现蛋白质浓度的可靠测定。因此,该方法在基础研究与实验分析中常作为首选的定量策略之一。
二、BCA法测定蛋白质含量的基本原理
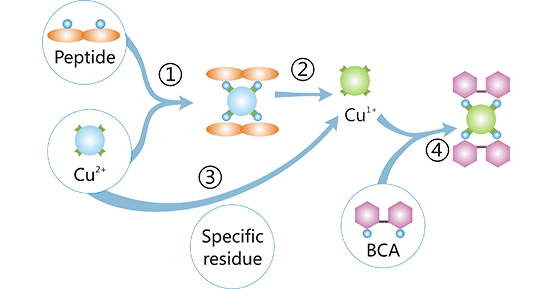
BCA法的定量基础在于二喹啉甲酸(BCA)这一稳定且具碱性的水溶性化合物。其作用机理主要包含两个连续发生的化学反应步骤。首先,在碱性介质中,蛋白质分子将试剂体系中的二价铜离子(Cu²⁺)还原为一价铜离子(Cu⁺)。随后,生成的一价铜离子与BCA分子发生特异性螯合,形成一种呈现蓝紫色的复合物。
该复合物在562纳米波长处具有特征性吸收峰,其吸光度值与反应体系中蛋白质的浓度呈正相关。因此,通过测定反应液在562纳米处的吸光度,并参照已知浓度的标准蛋白质所建立的标准曲线,即可实现对样品中蛋白质含量的准确定量。
此方法因检测灵敏度高、操作流程简便以及对多种常见干扰物(如缓冲液中的某些成分)耐受性较好等优点,在生物化学研究中应用广泛。需要注意的是,反应体系的孵育温度与时间等因素会对显色强度产生影响,因此优化并严格控制反应条件,是确保测定结果准确性与重复性的关键。
三、BCA法测定蛋白质含量的试剂配制
(一) BCA工作液的配制
本实验所需BCA工作液由试剂A与试剂B按比例混合而成,具体配制方法如下。
① 试剂A(1升):
分别准确称取10克BCA(1%,w/v)、20克Na₂CO₃·H₂O(2%,w/v)、1.6克Na₂C₄H₄O₆·2H₂O(0.16%,w/v)、4克NaOH(0.4%,w/v)及9.5克NaHCO₃(0.95%,w/v)。将上述试剂依次溶解于适量蒸馏水中,完全溶解后定容至1升。使用NaOH溶液或固体NaHCO₃将溶液pH值精确调节至11.25。
② 试剂B(50毫升):
准确称取2克CuSO₄·5H₂O(4%,w/v),加入蒸馏水溶解并定容至50毫升。
③ BCA工作液:
取50体积试剂A与1体积试剂B充分混合均匀,即为所需工作液。该混合试剂在适宜条件下可保持稳定约一周。
(二) 标准蛋白质溶液的配制
准确称取0.5克牛血清白蛋白(BSA),以蒸馏水溶解,并转移至100毫升容量瓶中定容,配制成浓度为5毫克/毫升的储备液。使用前,用蒸馏水或相应缓冲液将此储备液稀释10倍,获得浓度为0.5毫克/毫升的标准工作液,用于标准曲线的绘制。
四、BCA法测定蛋白质含量的操作步骤
1. 加样准备
取96孔酶标板,按预先设计的实验布局,依次向各孔中加入标准品及待测样品。
2. 显色反应
于每孔中准确加入20微升样品溶液,随即加入200微升预先配制的BCA工作液。轻轻振荡酶标板以确保反应液充分混匀。将酶标板置于37℃恒温箱中孵育30至60分钟,待反应完全后取出,冷却至室温。
3. 吸光度测定
使用酶标仪,选择562纳米作为测定波长,以未加入蛋白质样品的BCA工作液孔作为空白对照,读取各孔的吸光度值。以系列浓度牛血清白蛋白(BSA)标准溶液的浓度为横坐标,对应测得的吸光度值为纵坐标,绘制标准曲线。
4. 浓度计算
根据待测样品孔测得的吸光度值,在标准曲线上查得对应的蛋白质浓度。若吸光度值落在标准曲线线性范围之外,可适当稀释样品后重新测定,以确保结果准确性。最终计算结果可表示为克每升(g/L)或根据需要进行单位换算。
五、标准曲线绘制与浓度计算
1、数据收集
分别测定系列浓度牛血清白蛋白(BSA)标准溶液(通常建议设置不少于6个浓度梯度)及待测样品的吸光度值。
2、散点图绘制
将标准溶液的已知浓度(x轴)与对应的平均吸光度值(y轴)录入数据分析软件,生成XY散点图。
3、标准曲线拟合
对散点图数据进行线性回归分析,添加趋势线并显示其线性方程及决定系数(R²值)。R²值用于评估数据点与拟合直线的接近程度,其值越接近1(通常要求≥0.99),表明线性关系越好,定量结果的可靠性越高。
4、样品浓度计算
将待测样品的吸光度值代入上述线性回归方程,计算得出对应的蛋白质浓度。若样品经稀释处理,需在最终结果中乘以相应的稀释倍数。
六、蛋白质浓度测定实验的注意事项
为保障BCA法测定蛋白质浓度的准确性、重复性及可靠性,实验操作中需注意以下要点:
1、标准品的配制与保存
标准品储备液可于-20℃条件下长期保存(建议不超过一年)。但每次实验时,必须使用新鲜配制的标准工作液绘制标准曲线,以避免因储存条件导致的标准品活性变化对定量结果产生影响。
2、实验重复与数据处理
建议每个样品设置不少于三个技术重复,以评估实验的重复性。后续数据处理时,可依据统计学方法(如Grubbs检验法)识别并剔除异常值,从而提高最终结果的准确度。
3、反应条件的控制
显色反应的强度受孵育温度与时间影响显著。为获得稳定的结果,应确保孵育过程在恒温(如37℃)及规定时间内完成。鉴于反应条件可能存在的细微波动,每次实验均需同步绘制全新的标准曲线。
4、标准曲线的绘制
绘制标准曲线时,须明确设置坐标轴:横坐标(X轴)为标准蛋白质浓度,纵坐标(Y轴)为对应吸光度值。需确保数据点分布均匀并处于线性范围内,避免坐标轴误用导致的定量错误。
5、加样操作的规范性
加样过程需精确、匀速,尽量避免产生气泡。若孔内出现气泡,可使用微量注射器针头轻轻戳破,或将酶标板置于微量振荡器上短暂轻摇,以使溶液混合均匀并消除气泡,防止其对吸光度读数造成干扰。
6、吸光度的及时测定
显色反应完成后,应尽快将酶标板冷却至室温并在短时间内完成所有孔的吸光度测定。延迟测定可能导致反应产物不稳定,从而引入测量误差。
7、样品的预处理
若预实验表明待测样品蛋白质浓度超出标准曲线线性范围,需使用适当的缓冲液(如磷酸盐缓冲液)对其进行梯度稀释,使稀释后样品的预期浓度落入标准曲线中部线性最佳区间,最后计算结果时乘以相应的稀释倍数。












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


