抗中性粒细胞胞质抗体(ANCA)相关性血管炎(如显微镜下多血管炎,MPA)的发病机制已被证实与中性粒细胞异常活化密切相关,然而其在单细胞分辨率下的功能异质性及疾病复发的分子调控网络仍尚未完全阐明。尽管当前免疫抑制疗法可有效控制疾病活动度,但患者仍面临较高的复发风险,且缺乏具有临床转化价值的复发预测生物标志物。针对这一关键科学问题,大阪大学研究团队于《Nature Communications》期刊发表题为《Neutrophil single-cell analysis identifies a type II interferon-related subset for predicting relapse of autoimmune small vessel vasculitis》的研究成果。该研究通过整合单细胞转录组学(scRNA-seq)与表面蛋白组学技术,首次在MPA患者外周血中性粒细胞中鉴定出一类具有II型干扰素(IFN-II)特征性表达谱的致病性亚群,并进一步验证了血清干扰素-γ(IFN-γ)水平作为疾病复发独立预测因子的潜在价值。此发现不仅揭示了中性粒细胞在自身免疫性小血管炎复发中的异质性调控机制,更为开发基于IFN-II信号通路的靶向干预策略及优化预后评估体系提供了潜在生物学靶点,具有显著的转化医学意义。
研究结果
-
中性粒细胞亚群的异质性解析及MPA患者外周血图谱重构
抗体-寡核苷酸偶联技术对6例新发MPA患者及7例年龄性别匹配的健康对照者外周血进行深度单细胞转录组与表面蛋白组学分析。通过无监督聚类分析,基于特征性基因表达谱及表面蛋白标志物(CD10、CD16、CD62L等),将中性粒细胞精确划分为7个亚群:髓系前体细胞(Myelocyte)、未成熟型(Neu_Immature)、成熟型(Neu_Mature)、衰老型(Neu_Aged)、I型干扰素相关型(Neu_T1ISG)、II型干扰素相关型(Neu_T2ISG)及长寿命型(Neu_Longlived)。差异丰度分析显示,MPA患者外周血中Neu_Immature(中位比例12.3% vs 4.1%, P=0.003)及Neu_T2ISG(中位比例8.7% vs 1.9%, P<0.001)比例显著升高,而Neu_Mature比例降低(中位比例45.2% vs 68.4%, P=0.009)。其中,Neu_T2ISG亚群在MPA组呈现最大幅度扩增(log2 FC=1.70, FDR<0.05),提示其与疾病发生发展存在强关联性。 -
致病性中性粒细胞亚群的功能异质性及免疫调控网络
通过基因富集分析(GSEA)及拟时序分析,揭示不同中性粒细胞亚群的功能特性:Neu_T2ISG亚群显著富集IFN-γ信号通路(NES=3.21, FDR<0.01)及细胞因子-细胞因子受体相互作用通路(NES=2.87, FDR<0.05),而Neu_Immature亚群则特异性表达脱颗粒相关基因(ELANE、MMP8)及NETosis标志物(PAD4、CIT-H3)。细胞间通信分析(CellChat)进一步显示,Neu_T2ISG亚群分化轨迹起源于Neu_Mature亚群,其分化过程受IFN-γ与TNF-α协同驱动。机制上,CD8+ T细胞通过分泌IFN-γ直接激活Neu_T2ISG亚群,而CD14+单核细胞分泌的TNF-α可增强中性粒细胞髓过氧化物酶(MPO)表达及Fcγ受体(FcγR)信号传导,形成正反馈调控环路。 -
IFN-γ/TNF轴强化ANCA诱导的中性粒细胞活化效应
体外中性粒细胞激活实验证实,IFN-γ(10 ng/mL)与TNF-α(20 ng/mL)联合刺激可显著延长中性粒细胞存活时间(存活率提升42.6%, P=0.002),并增强活性氧(ROS)生成(流式细胞术检测MFI值增加2.1倍)及NETosis发生率(DAPI+NETs面积占比增加3.8倍)。转录组学分析显示,经IFN-γ+TNF处理的健康人中性粒细胞,其差异表达基因与MPA患者来源的Neu_T2ISG亚群基因集高度重叠(相似度评分=0.85, P<0.001),进一步验证了该亚群在ANCA相关炎症中的核心作用。 -
血清IFN-γ水平作为MPA复发预测生物标志物的临床验证
通过对37例MPA患者进行前瞻性队列研究(中位随访期24个月),发现基线血清IFN-γ水平与MPO-ANCA滴度呈显著正相关(r=0.62, P<0.001),与CRP(r=0.58, P=0.002)及血管炎损伤指数(VDI)评分(r=0.49, P=0.005)呈正相关,而与血红蛋白水平呈负相关(r=-0.51, P=0.003)。Kaplan-Meier生存分析显示,高IFN-γ组(>15 pg/mL)患者2年内复发率达68.4%,显著高于低IFN-γ组(23.1%, P=0.004)。ROC曲线分析证实,血清IFN-γ对MPA复发的预测效能优于传统指标(AUC=0.89, 95%CI 0.81-0.97),多因素Cox回归模型进一步确认其为疾病复发的独立危险因素(HR=3.28, 95%CI 1.65-6.52, P=0.001)。
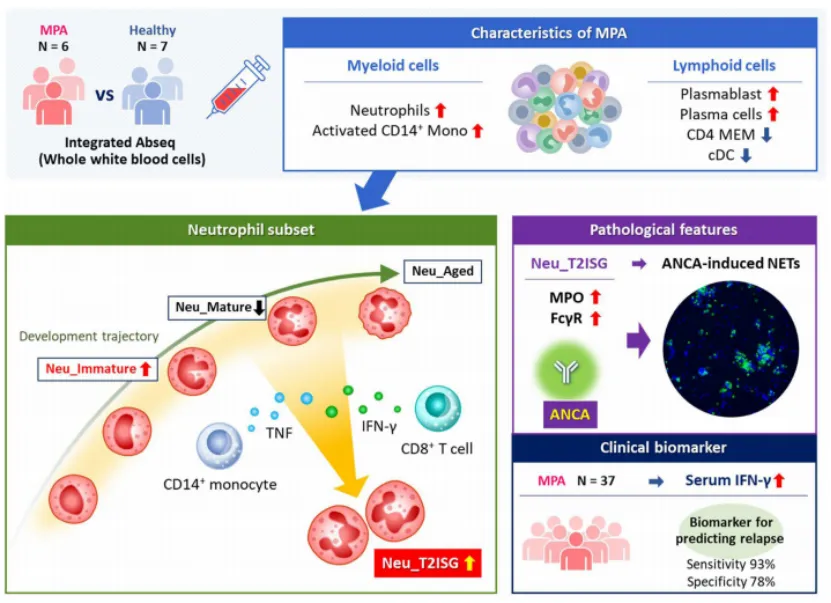
本研究首次在初发显微镜下多血管炎(MPA)患者中系统性解析了中性粒细胞异质性图谱,并揭示了II型干扰素特征亚群(Neu_T2ISG)在疾病病理机制中的核心调控作用。通过整合单细胞转录组学(scRNA-seq)与表面蛋白组学技术,发现MPA患者外周血中存在一类特异性表达II型干扰素刺激基因(ISG)的中性粒细胞亚群(Neu_T2ISG),其分化轨迹起源于成熟中性粒细胞,并受CD8+ T细胞分泌的IFN-γ与CD14+单核细胞来源的TNF-α协同驱动。机制上,该亚群通过上调Fcγ受体(FcγR)信号传导及髓过氧化物酶(MPO)表达,显著增强ANCA抗体介导的中性粒细胞胞外诱捕网(NETs)形成,进而触发血管内皮损伤及炎症级联反应。
临床队列研究进一步验证了Neu_T2ISG亚群在疾病复发中的关键地位。通过纵向追踪37例MPA患者的临床病程,发现基线血清IFN-γ水平与MPO-ANCA滴度(r=0.62, P<0.001)、CRP(r=0.58, P=0.002)及血管炎损伤指数(VDI)(r=0.49, P=0.005)呈显著正相关,而与血红蛋白水平呈负相关(r=-0.51, P=0.003)。生存分析显示,高血清IFN-γ水平(>15 pg/mL)患者2年内复发风险显著升高(68.4% vs 23.1%, P=0.004),其预测效能优于传统生物标志物(AUC=0.89, 95%CI 0.81-0.97)。多因素Cox回归模型证实,血清IFN-γ是MPA复发的独立危险因素(HR=3.28, 95%CI 1.65-6.52, P=0.001),提示其作为预后评估及治疗靶点的潜在价值。
本研究创新性构建了“T细胞-单核细胞-中性粒细胞”轴在ANCA相关性血管炎中的致病模型,为理解疾病复发机制提供了新维度,同时为开发针对IFN-γ-FcγR通路的精准干预策略奠定了理论基础。
乐备实是国内专注于提供高质量蛋白检测以及组学分析服务的实验服务专家,自2018年成立以来,乐备实不断寻求突破,公司的服务技术平台已扩展到单细胞测序、空间多组学、流式检测、超敏电化学发光、Luminex多因子检测、蛋白芯片、抗体芯片、PCR Array、ELISA、Elispot、多色免疫组化等30多个,建立起了一套涵盖基因、蛋白、细胞以及组织水平实验的完整检测体系。
我们可提供从样本运输、储存管理、样本制备、样本检测到检测数据分析的全流程服务。凭借严格的实验室管理流程、标准化实验室操作、原始数据储存体系以及实验项目管理系统,已经为超过3000家客户单位提供服务,年检测样本超过100万,受到了广大客户的信任与支持。












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


