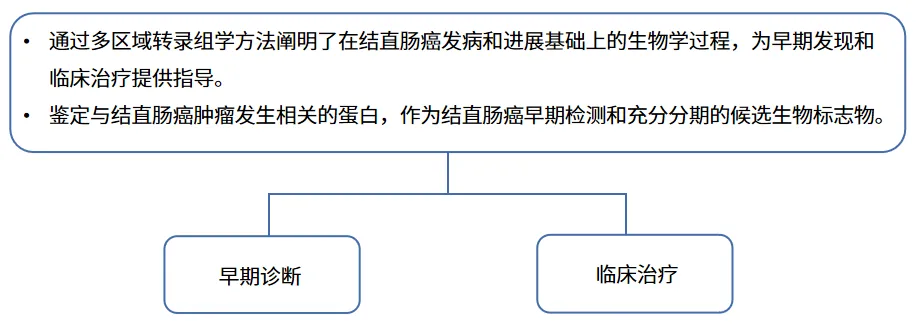
早期结直肠癌肿瘤发生的瘤内异质性分析与生物标志物筛选
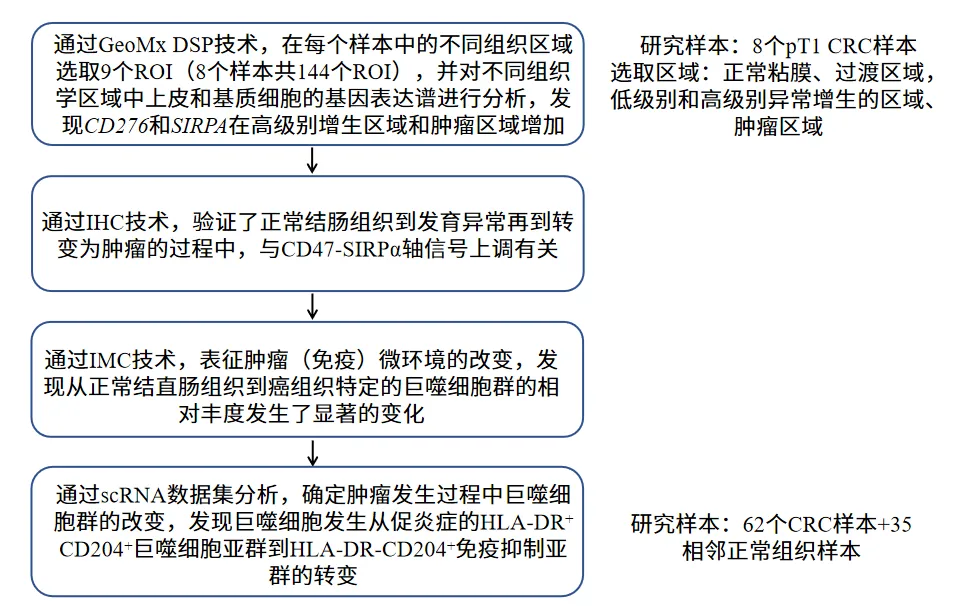
应用数字空间多组学技术(DSP)对同一结直肠癌样本中的9 个组织形态学各异的 ROI(感兴趣区域)进行精准定位分析。通过免疫荧光标记技术,在每个 ROI 内分别圈选PanCK 阳性上皮细胞群与Vimentin 阳性基质细胞群,结合激光显微切割技术实现细胞亚群的特异性捕获。利用DSP 平台进行高分辨率转录组测序,通过主成分分析(PCA)与差异表达基因(DEG)分析等多维度生物信息学方法,系统解析肿瘤微环境中的细胞异质性。结果显示,不同组织区域的上皮细胞与基质细胞呈现显著的基因表达差异,提示肿瘤发生过程中存在时空依赖性的分子重编程事件。
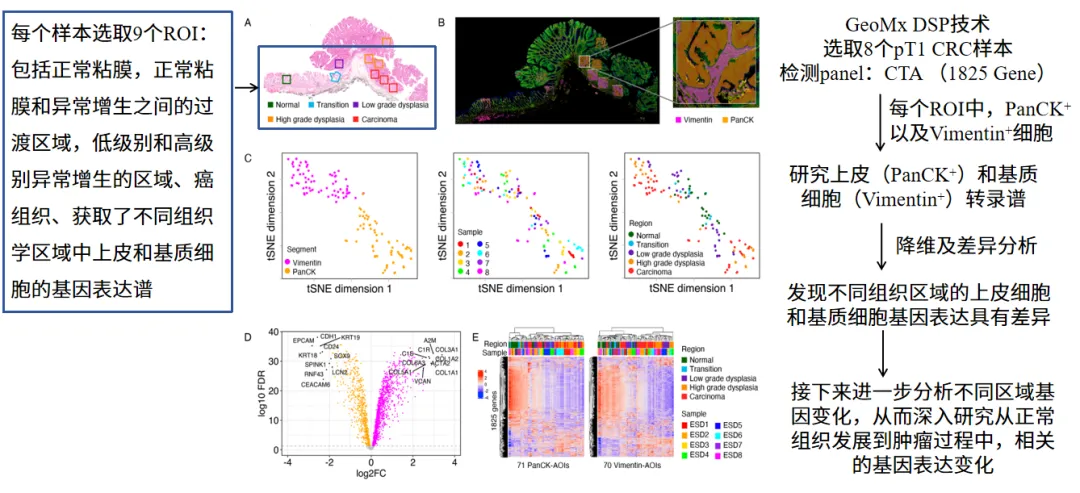 图 1 早期结直肠癌(CRC)肿瘤微环境的空间转录谱特征
图 1 早期结直肠癌(CRC)肿瘤微环境的空间转录谱特征
通过对早期结直肠癌不同组织区域转录组进行深度解析,运用生物信息学分析手段鉴定出多个呈现显著表达差异的基因,这些基因在肿瘤上皮与基质区域间的表达变化尤为突出,提示其具备作为早期 CRC 生物标志物的潜力。为进一步验证其临床应用价值,研究采用免疫组织化学(IHC)技术,系统探究差异基因的 mRNA 表达水平与对应蛋白丰度的一致性,旨在明确这些候选生物标志物能否转化为可靠的临床检测指标 。
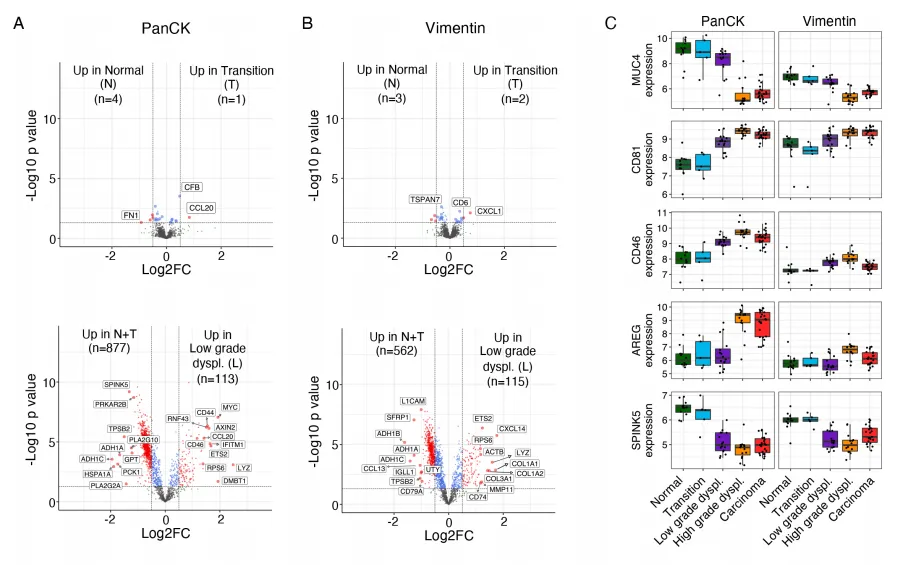
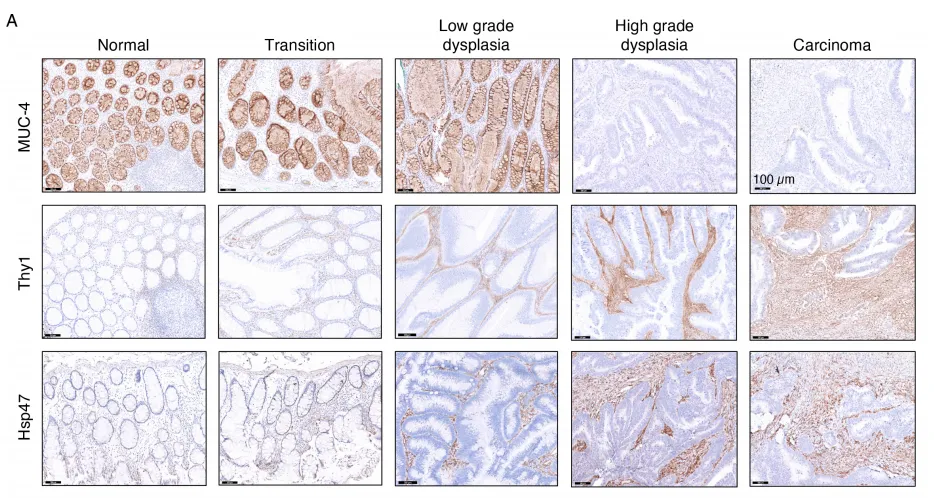
图 2 早期结直肠癌候选生物标志物的差异基因与蛋白表达特征
结直肠癌肿瘤发生时上皮细胞和基质细胞的生物学过程差异性富集特征
基于 Wiki Pathways 数据库开展富集分析,成功识别出 7 个与不同恶性转化阶段密切关联的通路簇(C1-C7)。研究发现,上皮细胞显著富集 C1、C2 和 C4 通路簇,主要涉及细胞增殖调控、DNA 损伤修复机制及代谢重编程等生物学过程;C3 通路簇则在上皮细胞与基质细胞中均呈现高富集状态,与肿瘤进展的关键步骤密切相关。相比之下,基质细胞主要富集 C5、C6 和 C7 通路簇,高度关联免疫抑制等恶性肿瘤发展的核心生物学过程。上述结果表明,在 CRC 肿瘤发生过程中,上皮细胞与基质细胞存在显著的转录组重塑,且不同恶性相关生物学过程呈现细胞类型特异性富集特征,揭示了肿瘤微环境中细胞间功能分工的复杂性 。
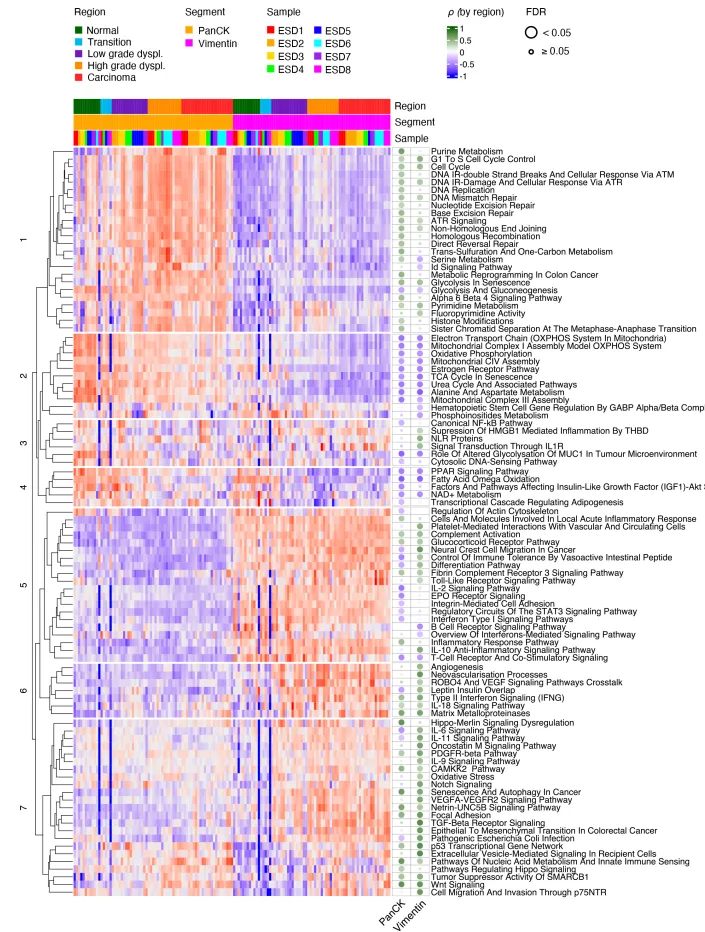
图 3 DBI 基因敲低对胚胎大脑神经元数量的影响
结直肠癌进展中的免疫微环境重塑与 CD47-SIRPα 信号轴激活关联
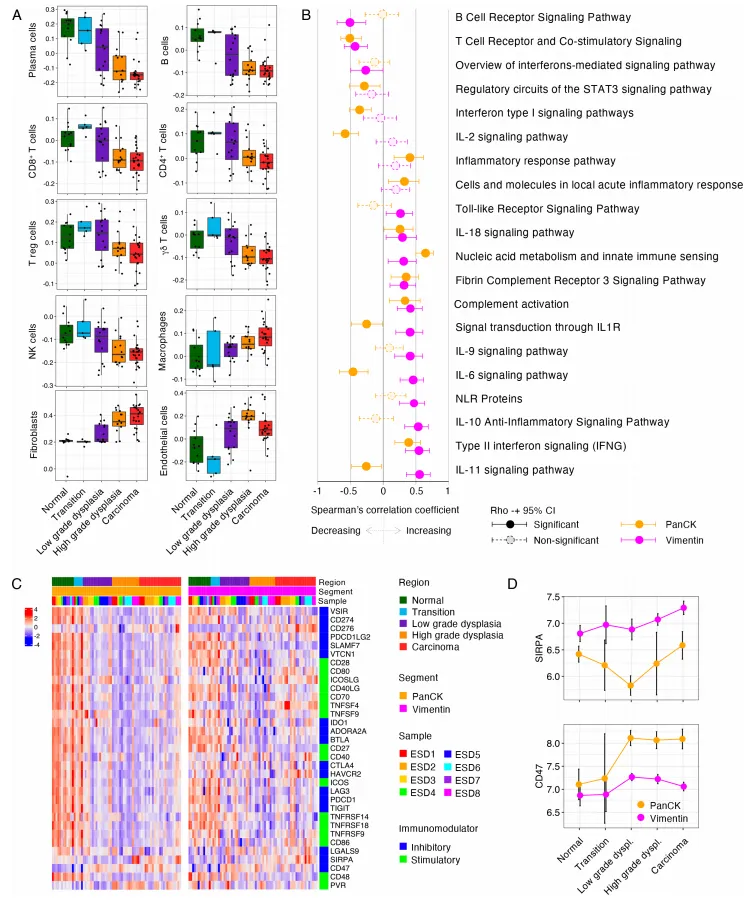
图 4 结直肠癌演进过程的免疫特征重塑与细胞组分变化
接下来采用免疫组织化学(IHC)技术对差异基因 CD276、SIRPA 进行蛋白水平验证,结果显示 CD47 及 SIRPα 蛋白在正常结直肠组织至癌组织中的表达呈渐进性升高趋势。这一发现进一步证实了结直肠癌的发生发展过程与 CD47-SIRPα 信号轴的上调密切相关。
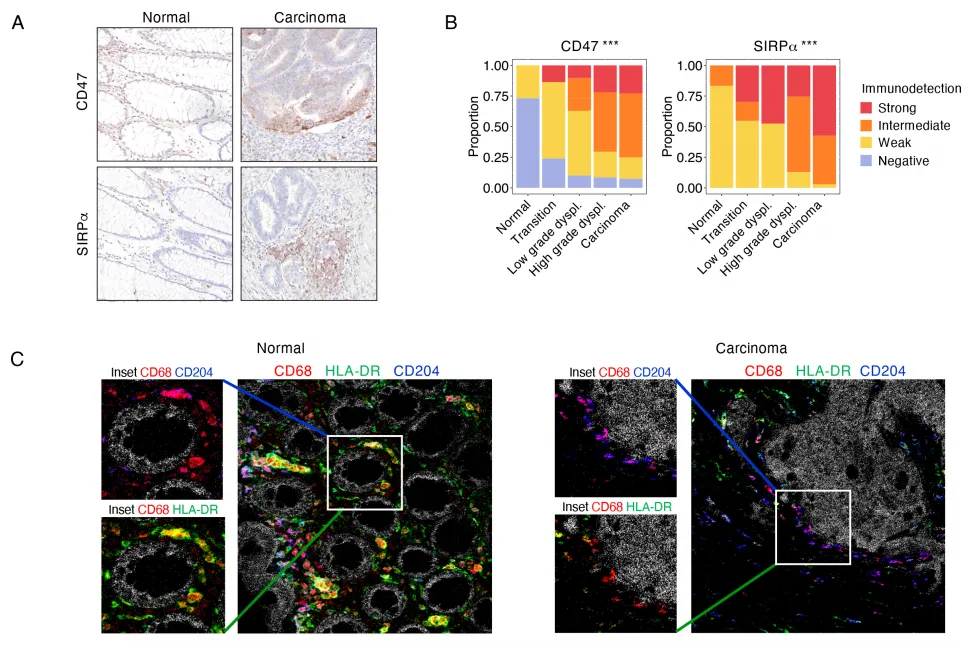 图5 CD47以及SIRPα 蛋白表达
图5 CD47以及SIRPα 蛋白表达
正常组织至癌组织进程中巨噬细胞亚型的谱系转变特征
为系统解析免疫微环境的动态重塑,研究采用基于飞行时间质谱的成像质谱流式技术(IMC),对正常结直肠组织至癌组织中的CD68+CD163+HLA-DR+CD204 + 巨噬细胞群进行空间定位与定量分析。结果显示,该细胞群的相对丰度在恶性转化过程中呈现显著梯度变化。进一步通过单细胞转录组数据重构与已发表髓系细胞谱系数据集比对,发现从正常结肠黏膜→异常增生→肿瘤形成的连续进程中,髓系细胞浸润总量显著增加,伴随巨噬细胞亚型的特征性转换:即促炎症表型 HLA-DR+CD204 + 巨噬细胞亚群比例降低,而免疫抑制表型 HLA-DR-CD204 + 亚群显著富集。这一转变提示,肿瘤微环境中巨噬细胞的功能极化可能通过构建免疫抑制微环境驱动结直肠癌进展,为靶向巨噬细胞表型转换的免疫治疗提供了潜在靶点。
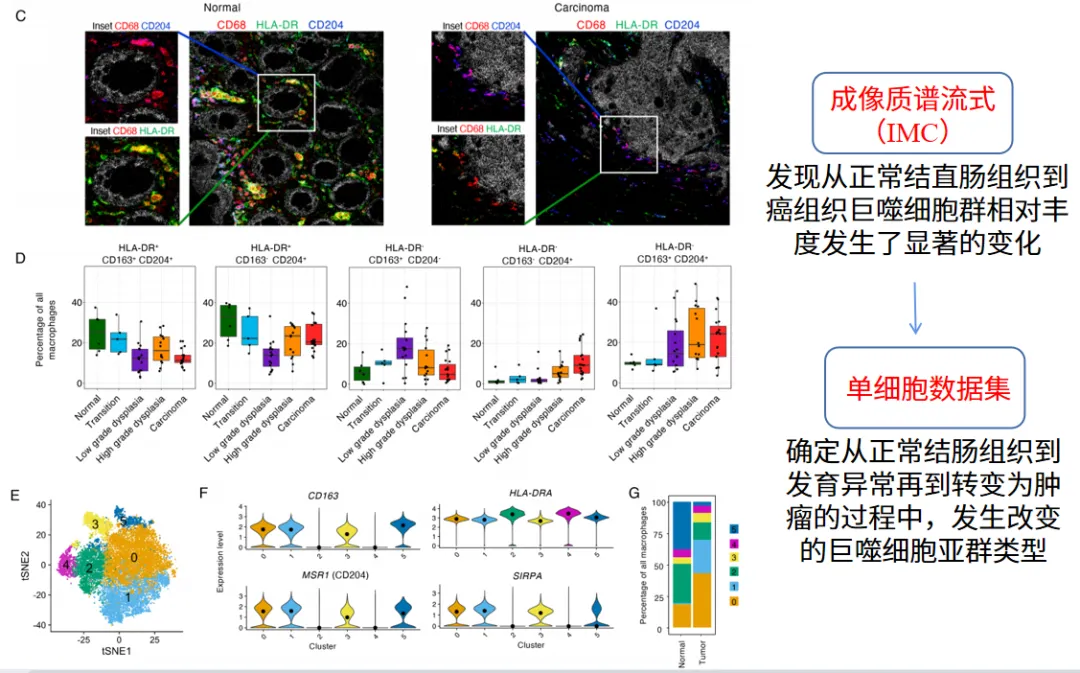 图6 巨噬细胞亚型在从正常组织到癌症的进展过程发生转变
图6 巨噬细胞亚型在从正常组织到癌症的进展过程发生转变
乐备实是国内专注于提供高质量蛋白检测以及组学分析服务的实验服务专家,自2018年成立以来,乐备实不断寻求突破,公司的服务技术平台已扩展到单细胞测序、空间多组学、流式检测、超敏电化学发光、Luminex多因子检测、抗体芯片、PCR Array、ELISA、Elispot、多色免疫组化等30多个,建立起了一套涵盖基因、蛋白、细胞以及组织水平实验的完整检测体系。
我们可提供从样本运输、储存管理、样本制备、样本检测到检测数据分析的全流程服务。凭借严格的实验室管理流程、标准化实验室操作、原始数据储存体系以及实验项目管理系统,已经为超过3000家客户单位提供服务,年检测样本超过100万,受到了广大客户的信任与支持。











 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


