细胞免疫荧光技术(点击查看更多)作为解析蛋白质功能的关键手段,能够精准定位细胞内蛋白质的分布,并实时追踪特殊信号分子在细胞核内外的动态转位,为揭示肿瘤发生发展机制提供直观证据。在实验操作中,细胞爬片是不可或缺的载体,需将其无菌放置于细胞培养皿内的培养基中,待细胞在爬片表面完成贴壁生长并达到合适密度后,方可开展后续的免疫荧光染色流程,确保实验结果的准确性与可靠性。
- 消化试剂:含 EDTA 的 0.25% 胰蛋白酶溶液(-20℃分装冻存,使用前 37℃水浴预热)
- 培养基:高糖型 DMEM 完全培养基(添加 10% 胎牛血清、1% 双抗,4℃避光保存)
- 培养耗材:无菌 6 孔板或 12 孔细胞培养板(推荐低吸附表面处理款)
- 实验载体:灭菌圆形 / 方形玻璃细胞爬片(直径 12mm 或 22mm,提前紫外照射 30 分钟)
- 当细胞汇合度达到 90%-95% 时,弃去旧培养基,用预热的 PBS 轻柔漂洗细胞 2 次。加入适量预热胰酶(6 孔板每孔 0.5ml,12 孔板每孔 0.25ml),37℃孵育 1-2 分钟。在显微镜下观察,待细胞变圆后,立即加入等体积完全培养基终止消化。用 1ml 移液枪轻柔吹打培养皿底部,确保细胞完全脱离皿壁,形成均匀单细胞悬液,采用血球计数板进行细胞计数。
- 爬片预处理与细胞接种:取无菌 12 孔细胞培养板,使用 200μl 移液器在各孔中央拟放置爬片区域滴加 3-5 滴(约 150-200μl)预热的 DMEM 完全培养基。镊子经 75% 乙醇消毒后,夹取灭菌玻璃爬片,轻置于培养基液滴中央,确保爬片完全贴合孔底。随后用移液枪头轻压爬片边缘,利用培养基表面张力使爬片与孔底紧密贴合,避免后续加样时爬片漂浮导致细胞双层生长。根据实验设计(如细胞增殖速率、蛋白表达丰度),调整细胞悬液浓度,按适宜密度(如每孔 5×10⁴-1×10⁵个细胞)接种至各孔,轻柔晃动培养板使细胞均匀分布,置于 37℃、5% CO₂培养箱中继续培养。

- 根据细胞系的增殖特性(如 HeLa 细胞约 24h 倍增,原代细胞可能需 48-72h),在接种后 24-48h 通过倒置显微镜动态评估细胞密度。当细胞达到85%-95% 汇合度(即视野中细胞单层覆盖率达此范围)且形态保持饱满状态时,终止培养进行后续实验。
-
轻柔洗涤:弃去培养基,每孔加入 1mL 预冷的 1×PBS(含 0.1% NaN₃),水平晃动培养板 5 次 / 次,重复 3 次,彻底清除血清蛋白。
注意:避免直接冲洗爬片表面,防止细胞脱落。
-
多聚甲醛固定:
- 现配 4% 多聚甲醛(PBS 配制,pH 7.4),每孔加入 1mL,室温避光固定 20min。
- 固定机制:通过醛基交联蛋白,保留抗原表位和亚细胞结构。
-
清洗残留固定剂:
- 用含 0.1% Tween-20 的 PBS(PBST)洗涤 3 次,每次 5min,振荡速度≤50rpm。
-
细胞膜通透化:
- 加入 0.5% Triton X-100(PBST 配制),室温孵育 20min。
- 作用:破坏脂质双分子层,允许抗体进入胞内。
-
封闭非特异性位点:
- 选择与二抗同源的封闭液:
- 10% 山羊血清(适用于抗小鼠 / 兔二抗)
- 5% BSA(无血清体系)
- 每孔加入 200μL,37℃孵育 2h,无需清洗直接进行下一步。
-
一抗孵育:
- 按抗体说明书推荐浓度用封闭液稀释一抗。
- 每孔加入 100μL,4℃湿盒内避光孵育 16-18h(避免反复冻融抗体)。
- 优化技巧:
- 首次使用新抗体需进行梯度稀释验证(如 1:100、1:500、1:1000)
- 肿瘤组织样本建议增设同型对照。
-
清洗未结合一抗:
- PBST 洗涤 3 次,每次 5min,轻拍培养板边缘确保充分清洗。
-
二抗孵育:
- 避光操作!用封闭液稀释荧光二抗。
- 每孔加入 100μL,37℃避光孵育 1h(铝箔包裹培养板)。
-
二抗清洗:
- PBST 避光洗涤 3 次,每次 5min,最后一次用无 Tween 的 PBS 漂洗。
-
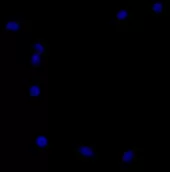
DAPI 复染:
- 用 PBS 稀释 DAPI 至 1μg/mL,每孔加入 100μL,避光孵育 5-8min。
- 注意:DAPI 有毒性,需戴手套操作。
-
封片与保存:
- 用镊子取出爬片,吸水纸轻触边缘吸干水分。
- 滴加含抗淬灭剂的封片剂,将爬片细胞面朝下覆盖在载玻片上,避免气泡。
- 4℃避光保存,建议 24h 内完成成像。
-
DAPI 漂洗:每孔加入 1ml PBS 缓冲液,轻柔晃动培养板,室温下漂洗细胞 3 次,每次 5 分钟,彻底清除未结合的 DAPI,减少背景荧光干扰。
-
爬片取出技巧:为避免损伤细胞,使用前将注射器针头弯成微型钩状(针尖朝背侧弯曲约 30°)。操作时,将弯钩小心插入爬片边缘与孔底的缝隙,利用杠杆原理轻柔上挑,待爬片松动后,迅速用灭菌镊子夹持取出,确保细胞形态完整。
-
封片与成像:用无菌吸水纸吸去爬片表面多余液体,在多聚赖氨酸载玻片中央滴加适量含抗荧光淬灭剂的封片液。将爬片细胞面倒置贴合于封片液上,轻压排出气泡,避免产生折光伪影。置于荧光显微镜下,根据一抗所偶联荧光基团的激发 / 发射波长参数,选择对应滤光片组进行观察。
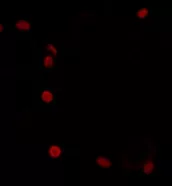
(1)爬片操作规范:使用经灭菌处理的镊子夹取细胞爬片时,需采用「两点夹持法」,即镊子尖端轻触爬片两侧边缘,避免直接施压于中央细胞区域。若爬片与孔底粘连紧密,可先用 PBS 浸润边缘辅助分离,防止因蛮力操作导致玻片碎裂或细胞层损伤,影响后续成像分析。
(2)细胞接种优化:制备单细胞悬液后,建议采用「涡旋振荡 + 移液枪吹打」双重混匀法,确保细胞浓度均一。接种至培养板后,通过「十字交叉平移法」水平晃动培养板,使细胞均匀分布,避免因局部密度过高引发接触抑制,干扰蛋白表达检测。
(3)荧光保护策略:涉及荧光二抗的操作全程需在避光环境下进行,推荐使用铝箔包裹反应板或在暗箱内操作。洗涤步骤采用「轻柔倾倒 + 沿孔壁缓慢添加」的 PBS 冲洗方式,减少荧光淬灭风险,同时避免强光照环境对荧光信号的不可逆损伤。
(4)成像时效管理:免疫荧光染色完成后,应在 2 小时内完成成像采集。若需延迟观察,需将封片后的样本置于含干燥剂的避光暗盒,4℃低温保存,且最长保存时间不超过 24 小时,防止荧光信号因淬灭或背景升高影响数据质量。
(5)显微镜参数设置:根据荧光基团特性(如 FITC/AF488 使用 488nm 激发光,Cy3/AF555 使用 555nm 激发光)精准选择滤光片组与光源。需注意,PI 染料可同时标记死细胞(红色)和活细胞(弱红色),而 DAPI 可将所有细胞核染为蓝色;仅在凋亡细胞中,FITC-12-dUTP 会特异性掺入断裂 DNA 链,呈现绿色荧光,需据此设置多通道成像参数以区分不同细胞状态。
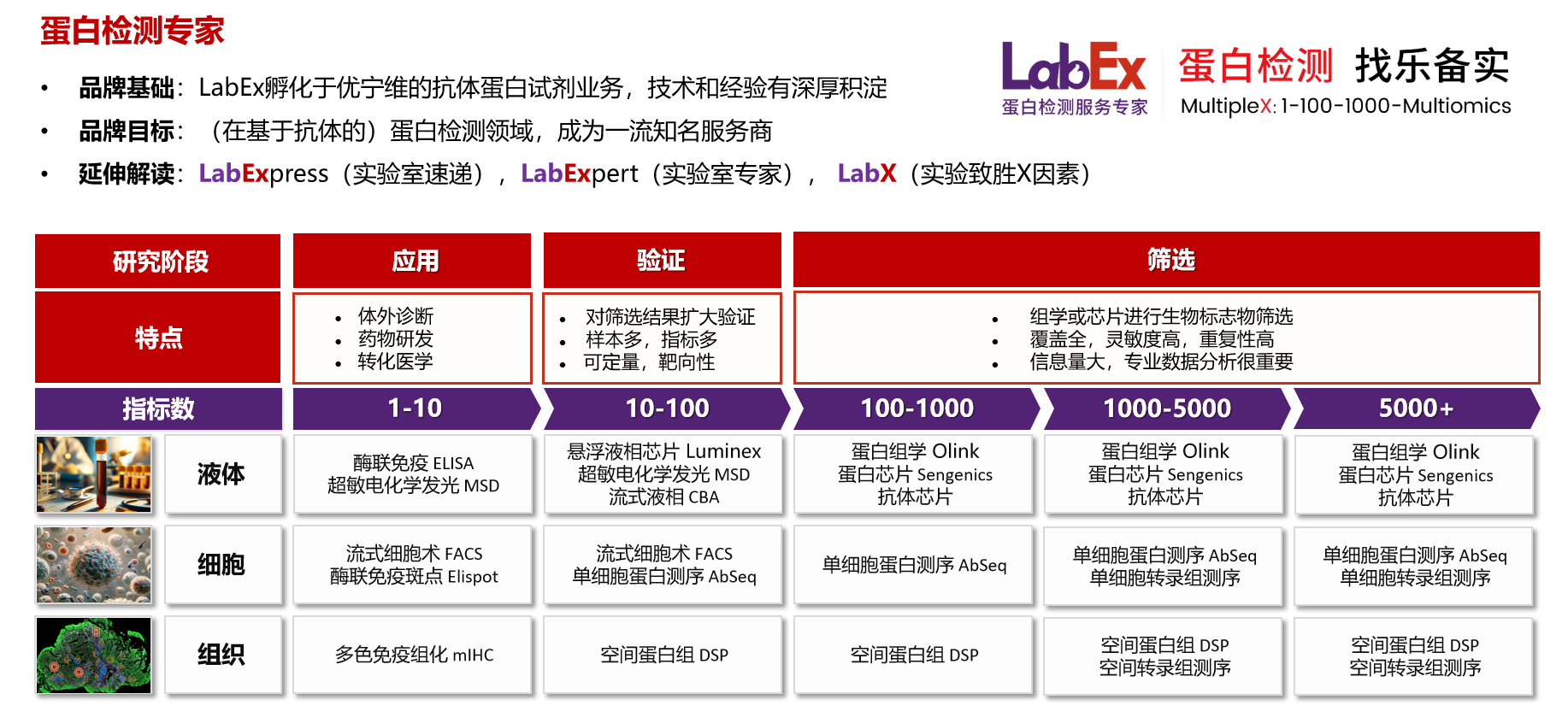
乐备实是国内专注于提供高质量蛋白检测以及组学分析服务的实验服务专家,自2018年成立以来,乐备实不断寻求突破,公司的服务技术平台已扩展到单细胞测序、空间多组学、流式检测、超敏电化学发光、Luminex多因子检测、抗体芯片、PCR Array、ELISA、Elispot、多色免疫组化等30多个,建立起了一套涵盖基因、蛋白、细胞以及组织水平实验的完整检测体系。
我们可提供从样本运输、储存管理、样本制备、样本检测到检测数据分析的全流程服务。凭借严格的实验室管理流程、标准化实验室操作、原始数据储存体系以及实验项目管理系统,已经为超过3000家客户单位提供服务,年检测样本超过100万,受到了广大客户的信任与支持。

 实验前准备
实验前准备 实验步骤
实验步骤















 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


