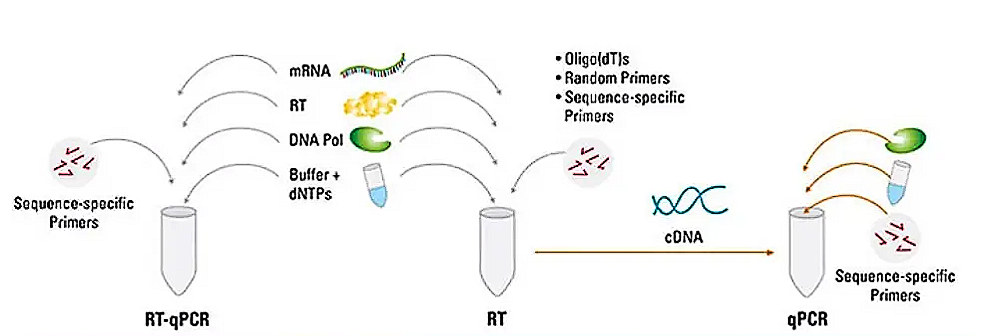
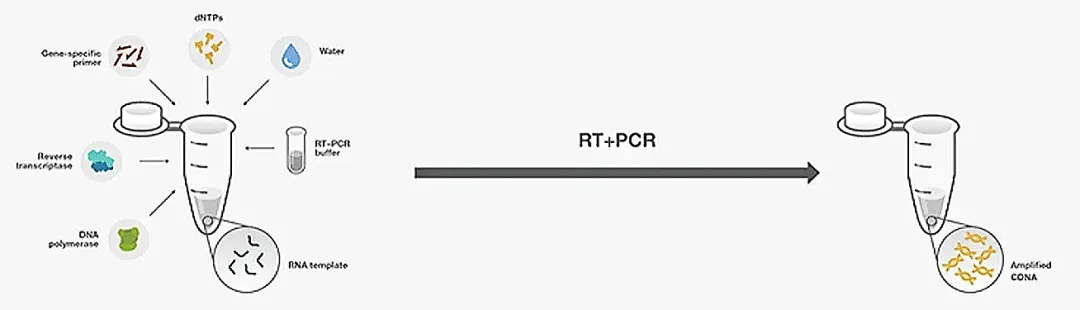
一步法 RT-PCR 是指在同一反应体系中完成第一链 cDNA 合成与后续 PCR 扩增的技术模式。
- 流程简化与污染控制:单管反应设计省去了样本转移操作,从根源上降低了交叉污染风险,尤其适合大规模样本的高通量检测场景。在时间敏感性实验(如 RNA 病毒的快速筛查)中,一步法因操作便捷、耗时更短而成为优先选择。
- 靶向扩增效率优化:通过基因特异性引物(GSP)启动逆转录与扩增过程,可显著提升目标 cDNA 的合成效率,同时有效抑制非特异性扩增背景。这一特性使其在低表达基因的检测、基因表达量细微差异的定量分析(如转录组差异研究)中表现突出,检测结果具有较高的准确性。
- 引物与反应条件的双重制约:基因特异性引物的使用限定了单一样本仅能分析少数基因,无法实现多基因的同步检测;此外,逆转录与 PCR 扩增需在同一反应体系中平衡酶活条件,可能导致部分场景下的灵敏度与扩增效率下降。
- 酶促反应的兼容性瓶颈:逆转录酶(Reverse Transcriptase)与 DNA 聚合酶的最佳反应条件存在天然冲突,同一体系下二者的酶活性会相互影响,难以同时达到最优状态。
(1)对逆转录反应的影响
① 模板 RNA 质量要求严苛:一步法 RT-PCR 依赖基因特异性引物启动逆转录,对 RNA 模板的完整性与纯度要求较高。若 RNA 存在降解或杂质污染,会显著降低逆转录效率,直接影响后续扩增结果。
② 反转录效率的天然劣势:两步法 RT-PCR 在逆转录阶段采用 Oligo dT 与 Random Primer 的优化混合引物,其 cDNA 合成产量与效率显著优于一步法中单一的基因特异性引物,尤其适用于低丰度 RNA 或复杂样本的逆转录。
③ 温度依赖性引物二聚体风险:逆转录酶的最适活性温度(37-50℃)与 PCR 引物退火温度重叠,在此区间内上下游引物 3´ 末端易发生非特异性退火,大幅增加引物二聚体形成的概率,干扰目标序列的有效扩增。
引物二聚体的形成,以及逆转录体系中残留抑制剂(如胍盐、酚类物质),均会显著抑制 PCR 扩增效率,影响最终检测结果的准确性。
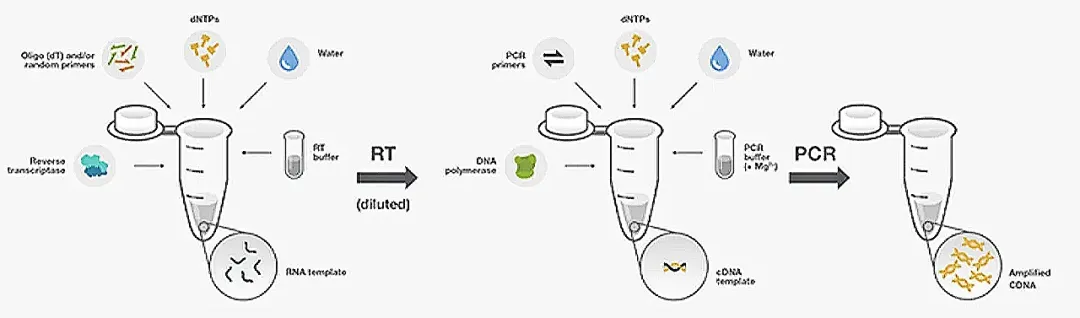
两步法 RT-PCR 分为两个独立的反应阶段:首先通过逆转录合成第一链 cDNA,再以该产物为模板进行 PCR 扩增。
- RT 过程的灵活性与高效性:
① 宽适模板要求:采用 Oligo dT 与 Random Primer 的优化混合引物,可兼容 1 ng-1 μg 总 RNA 起始量,对 RNA 模板质量要求较低,适配多种样本类型;
② 产物复用性强:逆转录生成的 cDNA 可长期储存,并广泛应用于多场景实验,如高通量基因检测、文库构建及基因克隆等,提升实验资源利用率。
- PCR 过程的优化空间与通量优势:
① 高效扩增保障:通过对 cDNA 进行 5-20 倍稀释,可有效降低 RNA 提取与逆转录过程中残留抑制剂(如乙醇、酚类、胍盐)对 PCR 反应的干扰,显著提升扩增效率;
② 多基因同步分析:同一 cDNA 样本可实现多个靶基因的平行检测,适用于基因表达谱的高通量研究;
③ 条件精细调控:逆转录与 PCR 反应独立进行,便于研究者灵活优化引物设计(如选择 oligo dT、随机引物或基因特异性引物)、酶体系(DNA 聚合酶类型)及反应参数,提升实验结果稳定性。
相较于一步法,两步法 RT-PCR 存在操作流程繁琐、实验周期延长等问题。多次样本处理与反应体系转换,不仅增加了操作误差风险,还可能引入交叉污染,导致实验结果的重复性与一致性下降。
以第一链 cDNA 为模板合成互补链,从而获得双链 cDNA 的过程称为第二链 cDNA 合成。在第一链合成时,建议选用 RNase H 活性极低的逆转录酶,以最大化 cDNA 合成长度与产量,为后续第二链合成提供优质模板。
在 dNTP 存在条件下,利用 RNase H 在 DNA/RNA 杂交链的 RNA 链上产生切口与缺口,进而生成 RNA 引物,再通过大肠杆菌 DNA 聚合酶 I 催化第二链合成。
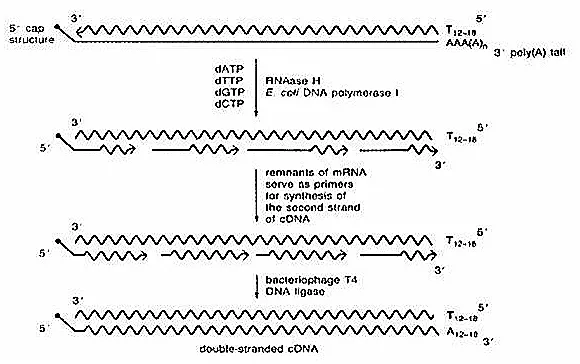
① RNA 链切割:E. coli RNase H 对 cDNA/RNA 复合物中的 RNA 链进行切割,为 DNA 合成提供 3'-OH 引物结合位点。
② 切口平移反应:E. coli DNA 聚合酶 I 借助 5´→3´ 聚合酶活性延伸切口处的 RNA 链,同时利用 5´→3´ 外切核酸酶活性沿合成方向逐步替换 RNA 链,完成切口平移过程。
③ 缺口修复:E. coli DNA 连接酶缝合新合成 cDNA 片段间的缺口(不推荐使用 T4 DNA 连接酶,因其会连接双链 cDNA 平末端并形成嵌合结构)。
④ 末端处理:大肠杆菌 DNA 聚合酶 I 的 5´→3' 核酸外切酶与 RNase H 共同降解 5'- 末端残留的 mRNA 片段,暴露第一链 cDNA 对应的 3' 端序列;同时,其 3´→5' 核酸外切酶活性消化第一链 cDNA 的 3' 端,最终形成平端或近平端结构。
注:该方法合成的 cDNA 在 5' 端可能存在数个核苷酸缺失,但通常不影响编码区完整性。
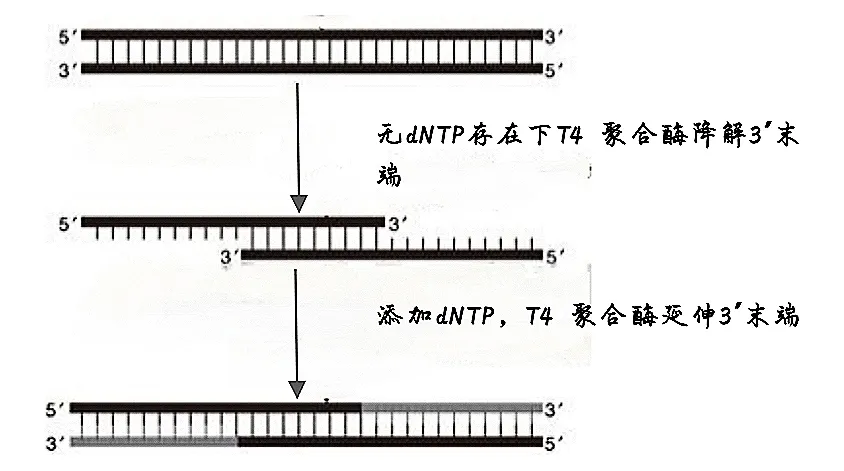
T4 DNA 聚合酶具备依赖 DNA 模板的 5´→3´ 聚合酶活性,同时具有针对单链 / 双链 DNA 的 3´→5´ 外切酶活性,但缺乏 5´→3´ 外切酶活性。具体表现为:
- 无 dNTP 时,3´→5´ 外切酶活性可从 3´ 末端降解双链 DNA;
- 补加 4 种 dNTP 后,激活聚合酶活性以延伸 3´ 末端;
- 高浓度 dNTP 条件下,酶促降解反应终止于双链区,此特性可用于双链 DNA 分子的 3´ 末端标记。
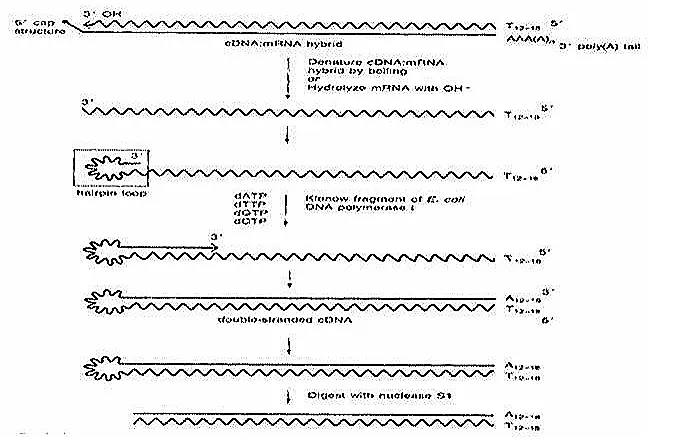
通过 NaOH 消化 DNA/RNA 杂合链中的 mRNA 链后,解离的第一链 cDNA 的 3´ 末端会自发形成发夹环(其产生机制尚不明确,推测可能与 mRNA 帽子结构相关),该发夹环可作为现成引物,在 E. coli DNA 聚合酶 I 的 Klenow 片段或反转录酶(DNA 指导的 DNA 聚合酶活性)作用下延伸形成第二链,最后利用单链特异性的 S1 核酸酶消化发夹环结构。
局限性:该方法反应条件难以控制,且 S1 核酸酶切割发夹结构时必然导致 mRNA 5´ 端序列缺失与重排,目前已较少使用。
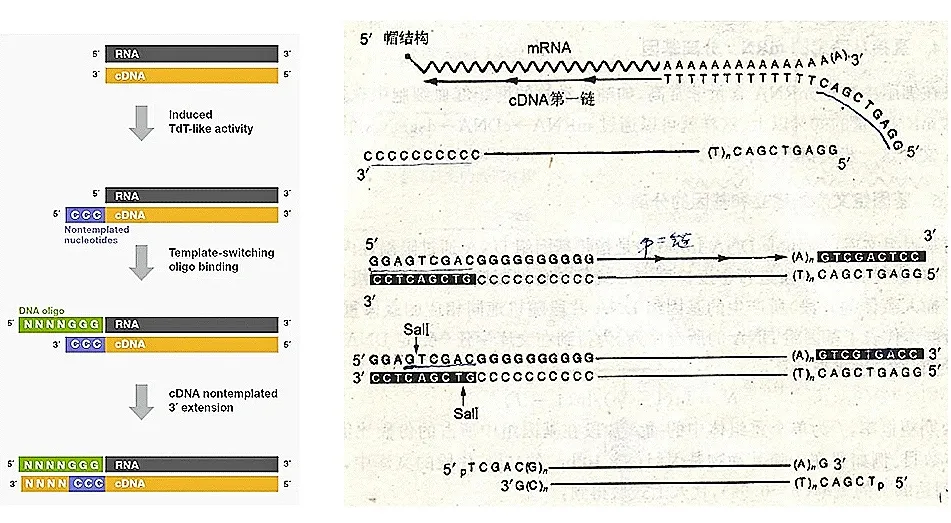
利用 MMLV 逆转录酶的末端转移酶(TdT)活性(如 SuperScript IV、Maxima H Minus 具备该活性,而 SuperScript III 无此活性),经突变改造后丧失 RNase H 活性的酶会在第一链 cDNA 末端添加 CCC 碱基。因此,可在反应体系中直接加入含 GGG 序列的 TSO(Template Switching Oligo),以第一链 cDNA 为模板合成第二链。该特性广泛应用于单细胞 SMART-seq 中的模板转换反应或 5´RACE 等实验。
① M-MLV 逆转录酶:具备优异的热稳定性,37℃时酶活达到峰值,可高效合成长度达 7 kb 的第一链 cDNA,适用于中等长度转录本的逆转录。
② SuperScript III 逆转录酶(37℃-55℃):突破传统温度限制,可在 55℃高温下合成第一链 cDNA,产物长度覆盖 100 bp 至 12 kb 以上。该酶通过提升反应特异性,实现 cDNA 及全长产物的高产量合成,尤其适合复杂模板或长片段转录本的逆转录需求。
③ SuperScript IV 逆转录酶(42℃-55℃):显著增强了对抑制剂的耐受能力,可在血清、组织裂解液等复杂样品中稳定进行特异性 cDNA 合成。反应时间从传统的 50 分钟以上大幅缩短至 10 分钟,且相比 SuperScript III 具有更强的持续合成能力,能有效应对高 GC 含量或二级结构丰富的 RNA 模板。
④ Maxima H Minus 逆转录酶(50℃-55℃):在 50℃孵育 60 分钟后仍保持 90% 的热稳定性,最高工作温度可达 65℃,为高温逆转录提供可能。其全长 cDNA 合成能力可达 20 kb,支持 1 pg 至 5 μg 总 RNA 的宽范围起始量,15-30 分钟内即可完成高效合成。此外,该酶对常见抑制剂(如胍盐、酚类)耐受性强,还可掺入修饰核苷酸,适用于单细胞测序、修饰 RNA 研究等特殊场景。
乐备实是国内专注于提供高质量蛋白检测以及组学分析服务的实验服务专家,自2018年成立以来,乐备实不断寻求突破,公司的服务技术平台已扩展到单细胞测序、空间多组学、流式检测、超敏电化学发光、Luminex多因子检测、抗体芯片、PCR Array、ELISA、Elispot、多色免疫组化等30多个,建立起了一套涵盖基因、蛋白、细胞以及组织水平实验的完整检测体系。
我们可提供从样本运输、储存管理、样本制备、样本检测到检测数据分析的全流程服务。凭借严格的实验室管理流程、标准化实验室操作、原始数据储存体系以及实验项目管理系统,已经为超过3000家客户单位提供服务,年检测样本超过100万,受到了广大客户的信任与支持。

















 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


