今日将分享一篇文献 —— 其利用临床大量 Bulk 转录组数据,结合常规差异基因分析、通路富集及肿瘤微环境免疫细胞解析,成功确定患者预后独立影响因素。该研究无需复杂建模,却凭借创新思路发表优质成果,其研究逻辑与创新性值得借鉴!接下来,让我们一同深入解读~

题目:《Differences of molecular events driving pathologicaland radiological progression of lung adenocarcinoma》
期刊:EBioMedicine
IF:11.1
时间:2023 年 7 月
研究背景
在肺癌早期筛查中,磨玻璃样结节(Ground-glass Opacity, GGO)的检出率逐年攀升。GGO 作为特征性影像学表现,呈现密度增高的磨玻璃影,病灶内血管与支气管纹理清晰可辨。根据实变 - 肿瘤比(consolidation-to-tumor ratio, CTR),可将肿瘤分为纯 GGO(pGGO,CTR=0)、混合 GGO(mGGO,0<CTR<1)和实性结节(CTR=1)。pGGO 多见于肺腺癌(LUAD)的前驱 / 微浸润阶段,多项研究证实,GGO 样肺癌属于生长缓慢、预后良好的 “惰性” 肿瘤类型。
数据来源
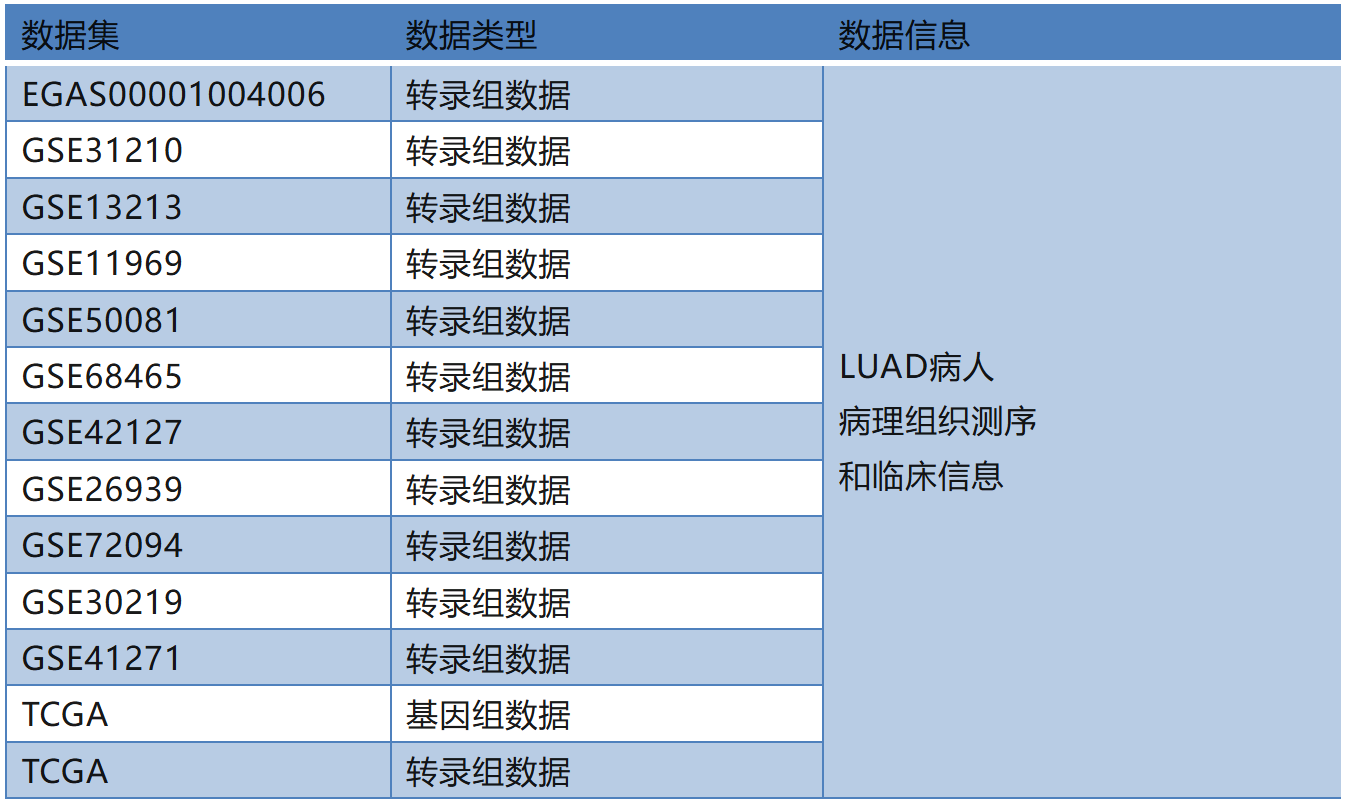
研究思路
研究对 AIS(原位腺癌)、MIA(微浸润腺癌)和 LUAD 三种肺腺癌类型开展全面的基因组与转录组学对比,从基因组变异谱、基因表达特征及肿瘤微环境等维度,系统探究驱动放射分期(pGGO、mGGO、实性结节)与病理分期(AIS&MIA、LUAD)的分子机制。研究发现:
- 相较于 LUAD 实性结节,GGO 样 LUAD 呈现低恶性表型,具备与前驱 / 微浸润阶段相似的分子特征,包括更低的基因组变异负荷、细胞增殖活性及基质重塑水平。
- 在 AIS&MIA 阶段,pGGO 与 mGGO 的基因组差异不显著,但 LUAD 的分子特征(如 EGFR 突变频率、CNV 负载)显著高于 AIS&MIA。
- 免疫相关细胞(如 Treg、CD8+ T 细胞)与病理分期的关联性强于 GGO 成分。
- 最终构建了整合放射学、病理学及组织学进展特征的基因标志物,可作为患者预后的有效预测指标。
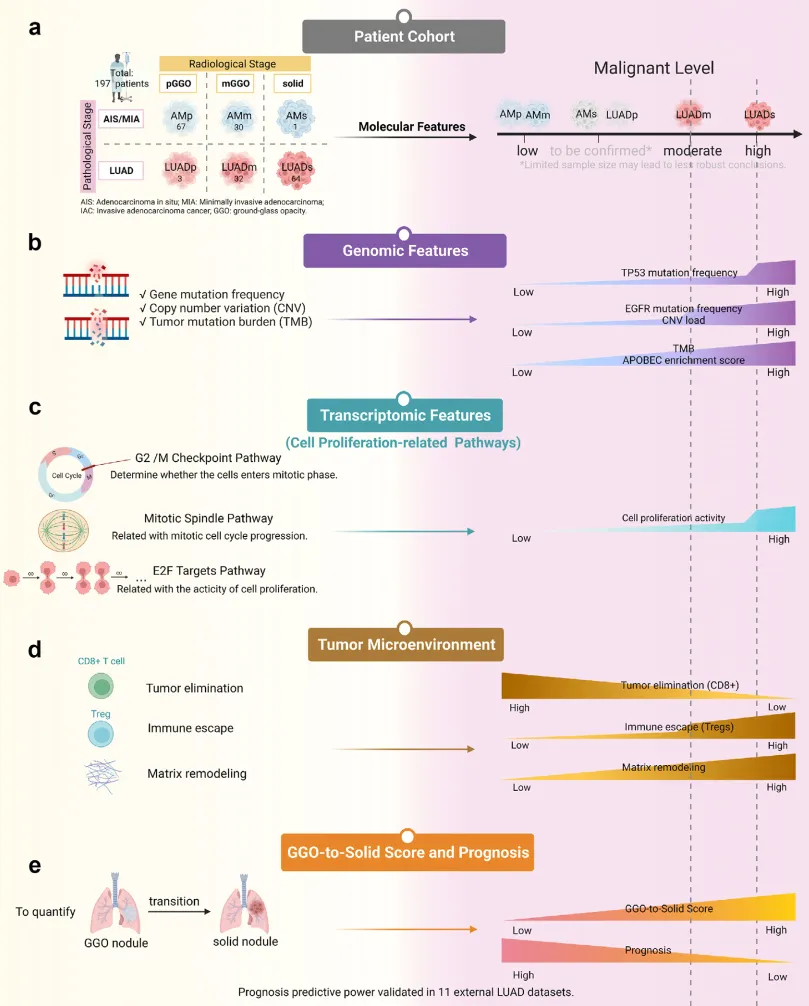 图 1 实验设计技术路线图
图 1 实验设计技术路线图
主要结果
1. 病理演进与放射学进展受不同基因组事件调控
基因组分析显示,病理分期与 GGO 组分的演化由差异化基因组事件驱动。作者剖析了 AIS&MIA 的 pGGO、mGGO 及 LUAD 的 pGGO、mGGO 和实性结节的基因突变谱(图 2a)。各分期(AIS&MIA 或 LUAD)内,pGGO 与 mGGO 的肿瘤突变负荷(TMB)差异无统计学意义,但 LUAD 的 TMB 水平显著高于 AIS/MIA(图 2b,AIS/MIA 中 mGGO vs LUAD 中 mGGO)。在 LUAD 中,实性结节组的 TMB 显著高于 GGO 组(图 2b,LUAD 中 mGGO vs LUAD 中 Solid)。这些发现表明,病理进展与 GGO 组分的变化共同受基因组突变负荷调控,且实性结节中吸烟者占比显著高于 GGO 结节,吸烟史与高 TMB 呈显著正相关。
APOBEC 相关突变(C > G 和 C > T 突变)与多种癌症的发生机制相关。作者发现,LUAD 实性结节患者的 APOBEC 富集评分显著高于 GGO 结节(图 2c,LUAD 中 mGGO vs LUAD 中 Solid;AIS/MIA 中 mGGO vs LUAD 中 Solid),而吸烟对 AIS/MIA 和 LUAD 中不同 GGO 组分的 APOBEC 富集评分影响有限。
通过解析 COSMIC 单碱基替换(SBS)信号在不同病理及放射分期中的活性占比,发现吸烟与 LUAD 实性结节中的 SBS4 信号相关。SBS4 以胞嘧啶(C)单碱基缺失为主要特征,与吸烟暴露密切关联,其突变多源自 TP53 基因突变。在研究队列中,LUAD 实性结节的 TP53 突变频率显著高于 GGO 样 LUAD(图 2d,LUAD 中 mGGO vs LUAD 中 Solid),且吸烟者更易进展为实性结节。因此,LUAD 实性结节中吸烟者比例最高,样本量的增加进一步优化了 SBS4 的区分效能。此外,LUAD 实性结节患者的 APOBEC 相关特征(SBS2 和 SBS13)突变负荷显著高于 GGO 结节。
EGFR 是 LUAD 中最常见的突变基因(图 2a),其突变与病理分期存在关联性,在 LUAD 中的突变频率高于 AIS/MIA(图 2d,AIS/MIA 中 pGGO vs LUAD 中 Solid),拷贝数变异(CNV)呈现相似变化趋势。同时发现,TP53 和 ERBB2 突变与 GGO 组分显著相关:LUAD 中,实性结节的 TP53 突变频率(53%)显著高于 mGGO(13%)(图 2d),提示 TP53 非同义突变可能驱动部分实性结节的表型转化,而 ERBB2 在 GGO 样 LUAD 中呈特征性低突变频率(图 2d)。LUAD 中未发现其他与 GGO 组分相关的高频突变基因(如 RBM10、KRAS、BRAF、MET 和 MAP2K1)(图 2d)。此外,作者对比了 EGFR、TP53 和 ERBB2 的变异等位基因频率(VAF)(图 2e、f):在 EGFR(图 2e,LUAD 中 mGGO vs solid)和 TP53(图 2f,LUAD 中 mGGO vs LUAD 中 solid)突变样本中,含 GGO 组分的肿瘤 VAF 显著低于实性肿瘤,且 EGFR 突变的 VAF 与病理分期相关(图 2e,AIS/MIA 中 mGGO vs LUAD 中 mGGO)。通过肿瘤纯度与 VAF 的相关性分析,证实含 GGO 组分的肿瘤中 VAF 降低并非完全由肿瘤纯度所致。综上,AIS/MIA 及含 GGO 组分的肿瘤较实性肿瘤处于更早的生长阶段。
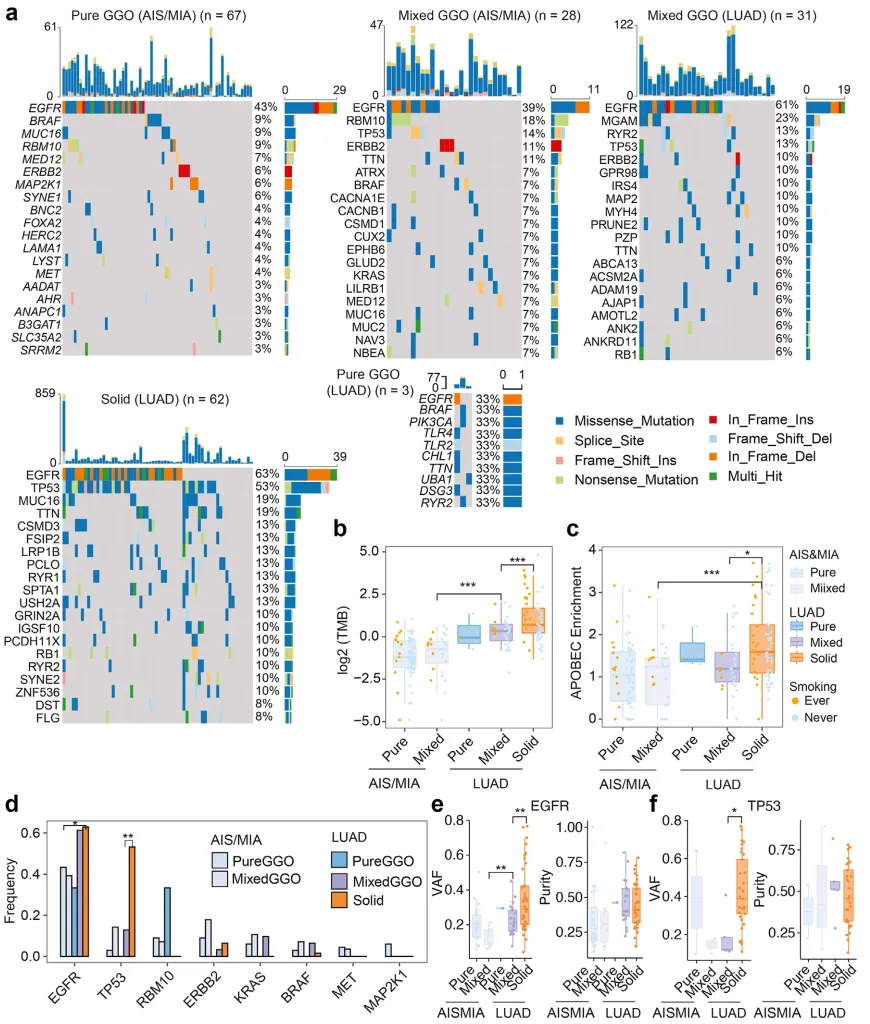 图 2 驱动 AIS/MIA 向 LUAD 及 GGO 向实性结节转化的基因组事件
图 2 驱动 AIS/MIA 向 LUAD 及 GGO 向实性结节转化的基因组事件2. 增殖相关基因模块在 AIS&MIA 及 GGO 样 LUAD 中均呈低表达状态
为筛选与病理分期及 GGO 组分相关的基因特征,作者对四组样本进行差异表达基因(DEGs)分析:AIS&MIA 的 mGGO vs pGGO、LUAD 的 GGO vs AIS&MIA 的 GGO、LUAD 的 mGGO vs pGGO、LUAD 的 solid vs mGGO(|log2FC|≥1,P < 0.05)(图 3a)。四组 DEGs 分析结果显示,病理进展与 GGO 组分均对基因表达模式产生显著影响。通过对图 3a 中所有 DEG 进行主成分分析(PCA)显示,LUAD 中 pGGO 的基因表达谱与 AIS&MIA 高度相似(图 3b)。利用基因集变异分析(GSVA)计算各样本基因富集评分,发现 GGO 样 LUAD 的生物学功能与 AIS&MIA 相近,这可能是 LUAD 中 pGGO 预后与 AIS/MIA 相当的分子机制。
采用加权基因共表达网络分析(WGCNA),将 3948 个与病理及放射学相关的 DEG(涵盖 AIS&MIA 的 pGGO vs 正常、AIS&MIA 的 mGGO vs pGGO、LUAD 的 mGGO vs AIS&MIA 的 GGO、LUAD 的 mGGO vs pGGO、LUAD 的 solid vs mGGO)划分为三个共表达模块(M1、M2 和 M3),其中 M0 包含 806 个未归类基因。分析显示,M1 和 M2 为肿瘤与正常组织间的差异基因模块,M3 则为实性结节特异性高表达模块(图 3c-d)。功能注释表明,M1 和 M2 中的基因主要参与发育调控、信号传导及免疫系统(图 3e),而 M3 基因与细胞增殖功能显著相关,这或可解释 GGO 样结节(M3 基因表达下调)较实性结节(M3 基因表达上调)进展更为缓慢的现象。进一步分析发现,M3 中多数基因与总生存期(OS)和无复发生存期(RFS)强相关,其风险比(HR)分布显著高于 M1 和 M2(图 3f-g;OS 的 HR 比较:M1 vs. M2;M2 vs. M3;RFS 的 HR 比较:M1 vs. M2;M2 vs M3)。综上,GGO 样结节中增殖相关及预后不良基因的表达水平相对较低,从基因表达层面阐释了其生长缓慢且预后更佳的分子基础。
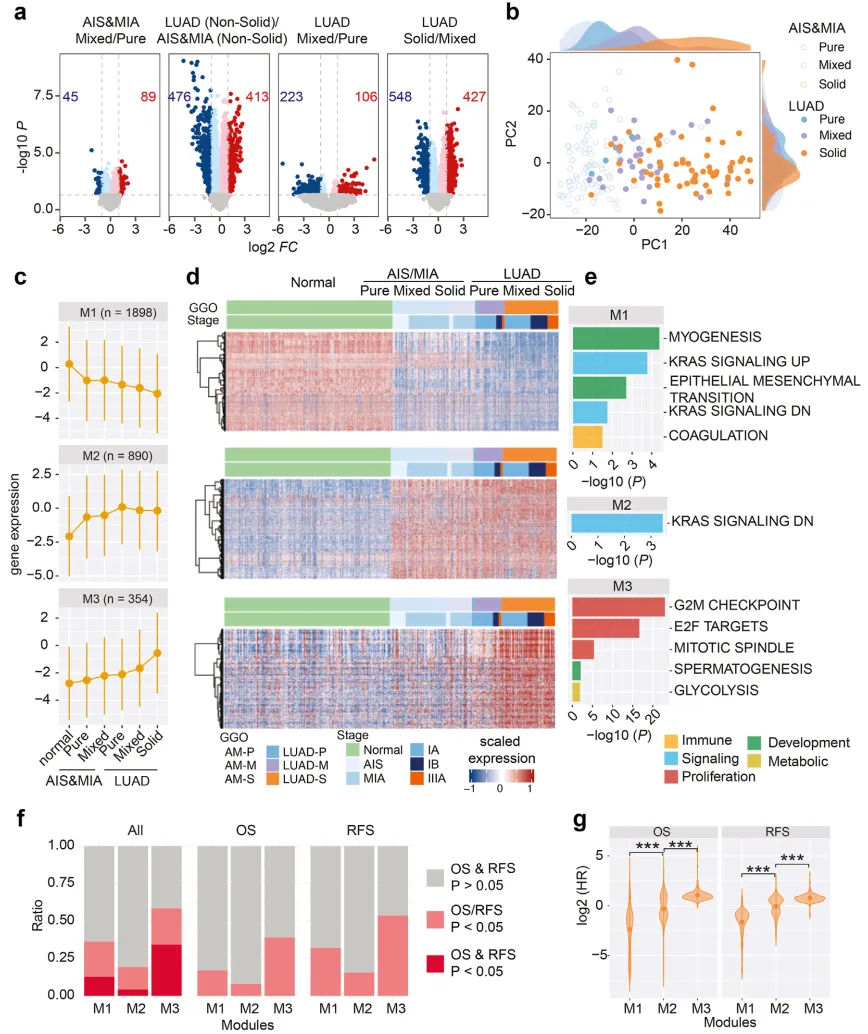
图 3 GGO 样 LUAD 中细胞增殖相关基因模块活性抑制与其良好预后的关联性
3. 病理演进与放射学进展由差异化免疫应答模式驱动
借助 Fges 法定量分析,作者进一步评估了不同病理阶段中 GGO 组分的增殖速率。结果显示,与配对正常肺组织相比,LUAD 从 mGGO 向实性结节进展时增殖速率显著升高;而含 GGO 成分的 LUAD 增殖速率较 LUAD 实性结节显著降低(图 4a;LUAD 中 mGGO vs Solid;AIS/MIA 中的 pGGO vs LUAD 中的 mGGO;AIS/MIA 患者 mGGO vs LUAD 患者 mGGO)。免疫组化检测表明,LUAD 实性结节中 Ki67 阳性率显著高于 GGO 样 LUAD,与 RNA-seq 增殖速率分析结果一致(图 4a;LUAD 中的 mGGO vs LUAD 中的 Solid;AIS/MIA 中的 mGGO vs LUAD 中的 mGGO)。此外,GGO 样 LUAD 的基质重塑活性较实性 LUAD 显著下调(图 4d;LUAD 中 mGGO vs LUAD 中 Solid;AIS/MIA 中 mGGO vs LUAD 中 Solid;AIS/MIA 正常 vs pGGO),提示细胞增殖与基质重塑在 AIS/MIA 向 LUAD 及 GGO 向实性结节的进展中发挥关键作用。
肿瘤细胞的生长既依赖自身增殖能力,也取决于免疫逃逸能力。为解析 GGO 样 LUAD 的免疫微环境特征,作者基于基因表达数据对各样本的免疫细胞比例进行反卷积分析(图 4c)。结果显示,与正常组织相比,肿瘤样本中调节性 T 细胞(Tregs)数量显著增多,CD8+ T 细胞数量显著减少。不同 GGO 组分间 Tregs 比例无显著差异,但从 AIS&MIA 进展至 LUAD 时,Tregs 数量显著增加(图 4b;AIS/MIA 患者 mGGO vs LUAD 患者 mGGO;AIS/MIA 中 mGGO vs LUAD 中 Solid)。LUAD 中 CD8+ T 细胞比例从 pGGO 到实性结节呈下降趋势,在实性结节中达最低值(图 4e,LUAD 实性结节 vs 正常人;AIS/MIA 患者的 pGGO vs 正常人),流式细胞术验证了这一趋势。Treg 数量在疾病进展中持续升高,在 LUAD 实性结节中显著增加(图 4b;AIS/MIA 中 pGGO vs LUAD 中 Solid;LUAD 中 mGGO vs LUAD 中 Solid),而 CD8+ T 细胞数量随疾病进展逐渐减少。值得注意的是,反卷积与流式分析均发现 CD8+ T 细胞分泌穿孔素的能力被显著抑制(图 4f;LUAD 中正常 vs 固态;LUAD 中 mGGO vs LUAD 中 Solid)。结合文献报道 Treg 通过抑制 CD8+ T 细胞杀伤因子分泌促进肿瘤进展,提示 LUAD 免疫逃逸机制可能为:通过上调 Tregs 数量(图 4b)削弱 CD8+ T 细胞杀伤功能(图 4f),而非直接减少其细胞数量(图 4e)。表达穿孔素的 CD8+ T 细胞与 Treg 细胞的代表性流式分析如图 4g-h 所示。
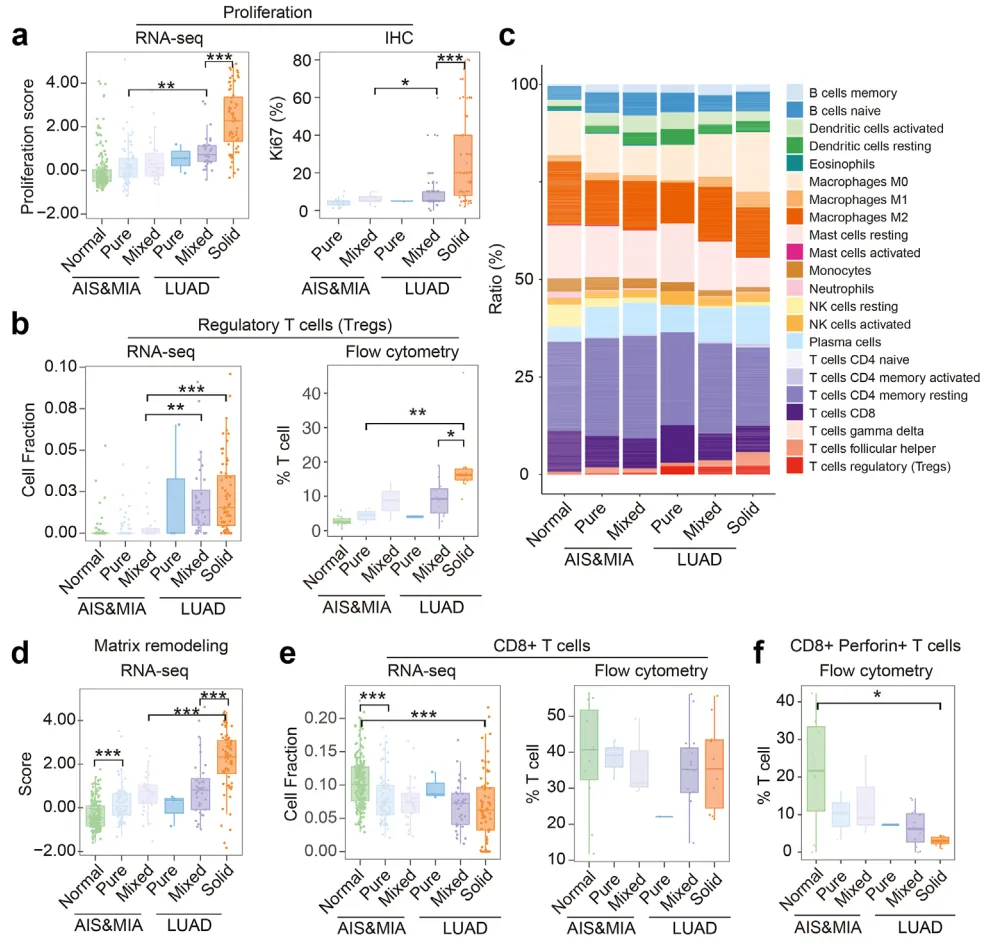 图 4 肿瘤微环境动态变化的系统性评估
图 4 肿瘤微环境动态变化的系统性评估4. 基于病理与放射学进展相关基因特征的预后预测模型构建
上述研究结果证实,LUAD 中与 GGO - 实性结节进展相关的基因在患者预后中具有关键作用。因此,对 LUAD 中 GGO 与实性结节基因的显著差异过程进行量化分析,或可助力 LUAD 患者的预后分层。同理,组织学进展相关特征也能对肿瘤标本的组织学形态及预后进行预测。根据主要生长方式,LUAD 可分为鳞屑状显性腺癌、腺泡显性腺癌、乳头状显性腺癌、微乳头状腺癌和实体型腺癌,其中鳞屑状为主的结节通常含有 GGO 成分且预后更佳,而实体为主的腺癌多不含 GGO 成分且预后更差。作者推测,GGO 与实性结节的放射学生物学差异,与鳞屑状为主和实体为主腺癌的组织学生物学差异可能具有同质性。通过对两组癌症特征开展基因集富集分析(GSEA):GGO vs 实性结节、鳞屑状 vs 实体瘤,结果显示 8 个标记在放射学实体组呈现显著富集,5 个标记在组织学实体组显著富集,其中 G2/M 检查点、E2F 靶点、有丝分裂纺锤体和 mTORC1 信号 4 个标记在两组中均显著富集(图 5a-d)。此外,在 TCGA 数据集中发现的 4 个组织学实体显著富集特征,在 FUSCC 数据集中也得到验证(图 5e-f)。
作者进一步模拟放射学与组织学进展过程,筛选 GGO 到实性结节及鳞屑状到实体瘤的显著差异基因。为确定 GGO / 鳞屑状显性与实体瘤 / 实体瘤显性相关特征,对三组样本进行差异表达分析:FUSCC 数据集的实性结节 vs GGO、FUSCC 数据集的实体瘤显性 vs 鳞屑状显性、TCGA 数据集的实体瘤显性 vs 鳞屑状显性。通过设置 | log2FC|≥1.5 且 p<0.05,获得 GGO / 鳞屑状显性显著上调基因 61 个,实体瘤 / 实体瘤显性显著上调基因 36 个(图 6a-b)。通过 12 个基因表达数据集的交集分析,从 8108 个基因中筛选出 24/61 个 GGO & 鳞屑状显性特异性基因和 21/36 个实体瘤 & 实体瘤显性特异性基因(图 6c),并基于 24 个 GGO / 鳞屑状显性特异性基因和 21 个实体瘤显性特异性基因,开发了名为 G2S 的基因标记,用于量化 GGO 向实性结节或鳞屑状向实体瘤的进展程度。在 FUSCC(图 6d-e;6d:LUAD 中 mGGO vs Solid;AIS/MIA 患者 mGGO vs LUAD 患者 mGGO;AIS/MIA 正常 vs pGGO;6e:乳头状 vs 实体瘤;鳞屑状 vs 腺泡状;正常 vs AIS)和 TCGA 数据集(图 6f:微乳头状 vs 实体瘤;乳头状 vs 微乳头状;鳞屑状 vs 腺泡状)中,G2S 评分随放射学或组织学进展而升高,且实体瘤及实体瘤为主型的平均得分最高。在 FUSCC 数据集中,按 G2S 中位数将患者分为 GGO 样组和实体瘤样组,GGO 样组的总生存期(OS)和无复发生存期(RFS)均显著优于实体瘤样组(图 6g),且在 11 个独立验证数据集中也证实了 G2S 的预后预测效能(图 6h-i)。
为强化基因组与转录组数据的关联,作者整合基因突变与基因表达构建预后模型。鉴于 EGFR 和 TP53 突变频率在 AIS&MIA 向 LUAD 或 GGO 样 LUAD 向实性结节进展中显著增加,重点分析其突变状态与预后的相关性。结果显示,EGFR 突变与 LUAD 良好预后相关,兼具 GGO 特征和 EGFR 突变的患者预后最佳,而具实体特征且 EGFR 野生型的患者预后最差,该结论在亚洲 LUAD 数据集 GSE31210 中得到验证(该队列 EGFR 突变频率较高)。即使未接受酪氨酸激酶抑制剂(TKI)治疗,EGFR 突变患者预后仍优于野生型。肿瘤抑制基因 TP53 突变与预后不良呈趋势性相关。将基于基因表达的 G2S 模型与 TP53 突变整合分析发现,预后分层主要由 G2S 驱动,TP53 突变信息未显著提升模型的预测效能。
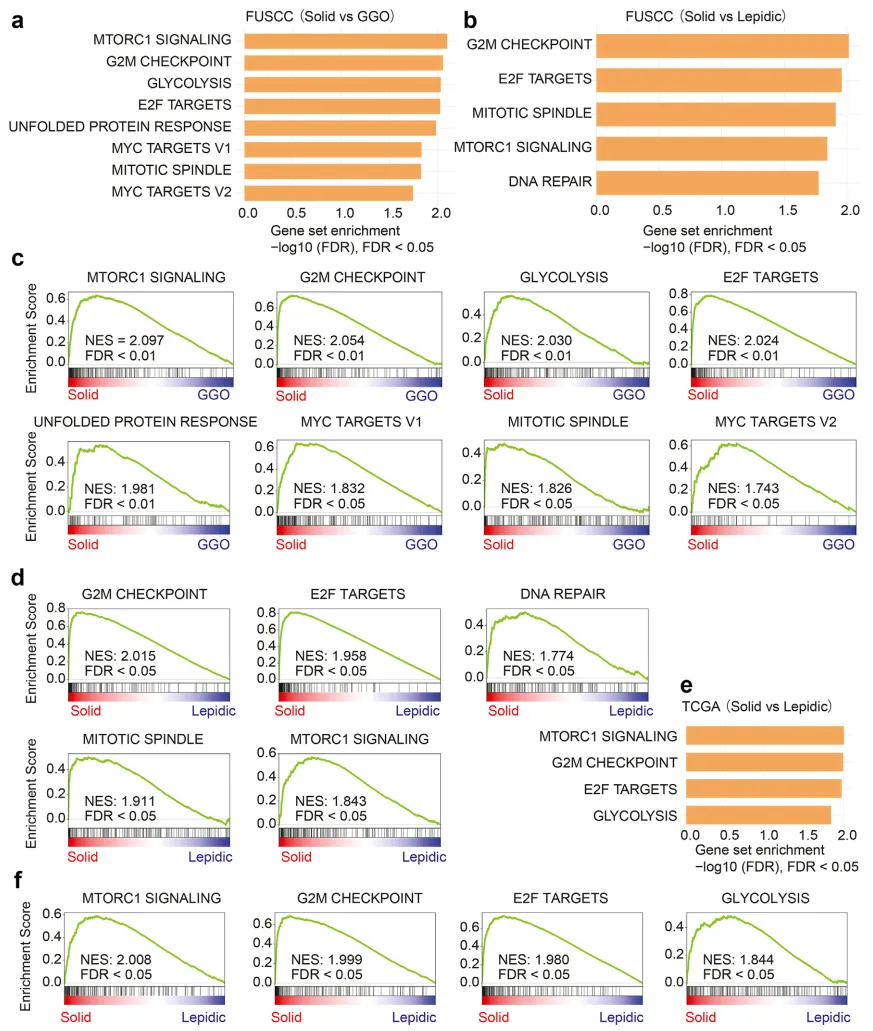 图 5 FUSCC 与 TCGA 数据集的基因集富集分析结果
图 5 FUSCC 与 TCGA 数据集的基因集富集分析结果
图 6 LUAD 病理、影像学及组织学相关的预后预测特征构建
文章小结
该研究基于肺腺癌临床大样本数据,系统探究 GGO 样肺腺癌与实性结节肺腺癌的基因表达差异,深入分析不同类型肺腺癌的病理生理特征及预后关联,并借助流式细胞术与免疫组化技术,验证了免疫细胞丰度及细胞增殖活性。
乐备实是国内专注于提供高质量蛋白检测以及组学分析服务的实验服务专家,自2018年成立以来,乐备实不断寻求突破,公司的服务技术平台已扩展到单细胞测序、空间多组学、流式检测、超敏电化学发光、Luminex多因子检测、抗体芯片、PCR Array、ELISA、Elispot、多色免疫组化等30多个,建立起了一套涵盖基因、蛋白、细胞以及组织水平实验的完整检测体系。
我们可提供从样本运输、储存管理、样本制备、样本检测到检测数据分析的全流程服务。凭借严格的实验室管理流程、标准化实验室操作、原始数据储存体系以及实验项目管理系统,已经为超过3000家客户单位提供服务,年检测样本超过100万,受到了广大客户的信任与支持。











 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


