Western Blot(蛋白印迹),作为科研日常最基础的实验之一,看似流程常规,实则藏着无数细节 —— 堪称 “小实验里的大文章”。相信多数科研人初涉此 “江湖” 时,都被折腾得 “体无完肤”,但在与 WB 反复 “过招” 中,也攒下了不少实战经验。
前人栽树,后人乘凉!小备整理了许多 WB 实验心法,助力大家少踩坑、高效出结果 👇
一、蛋白提取:基础中的基础
蛋白提取是 WB 的 “第一关”,裂解液选择、样本处理稍有差池,后续全白搭。
1. 裂解液的 “门道”
不同裂解液适配不同需求,常见类型及特点如下(按需选择更高效):
| 裂解液类型 | 优势场景 | 注意事项 |
|---|---|---|
| RIPA 裂解液 | 常规蛋白提取,兼容性强 | 需额外添加蛋白酶 / 磷酸酶抑制剂 |
| SDS 裂解液 | 强变性,适合难溶蛋白 | 提取后无法测浓度 |
| NP-40 裂解液 | 温和裂解,保留膜蛋白活性 | 膜蛋白提取首选 |
Tips:
- 无论哪种裂解液,蛋白酶 / 磷酸酶抑制剂必加(防止蛋白降解、去磷酸化);
- 若裂解后悬液仍有不溶物,可辅助 10 - 20s 超声破碎(需冰浴,避免产热);
- 紧急情况下,可用 1×SDS Loading Buffer 替代裂解液(效果类似 SDS 裂解液,但无法测浓度)。
2. 干扰蛋白的 “围剿”
细胞 / 组织样本中,血清残留的 白蛋白(~70kDa)、免疫球蛋白(~50kDa) 是常见 “杂带元凶”—— 即使抗体不直接识别它们,高浓度蛋白也会因非特异吸附造成信号富集,形成杂带。
应对策略:
- 细胞样本:用 PBS 漂洗至少 3 次(彻底去除培养基残留);
- 组织样本:尽量清理血液残留(如心脏组织剪去血块、用 PBS 冲洗),从源头减少干扰。
二、胶浓度与电泳:让蛋白 “各就各位”
选对凝胶浓度和电泳条件,能让目的蛋白 “精准分离”,减少杂带干扰,让条带更清晰。
凝胶浓度 & 电泳条件速查表(按蛋白分子量选择)
| 蛋白分子量(kDa) | 凝胶浓度(%) | 电泳条件(恒压) | 分离效果关键 |
|---|---|---|---|
| 10 - 50 | 12 - 15 | 浓缩胶 80V → 分离胶 120V | 小分子量蛋白避免 “跑过头” |
| 50 - 100 | 10 - 12 | 浓缩胶 80V → 分离胶 120V | 平衡分辨率与迁移速度 |
| 100 - 200 | 8 - 10 | 浓缩胶 80V → 分离胶 100V | 大分子量蛋白需更缓电场 |
核心逻辑:小分子量蛋白用高浓度胶 “限制迁移”,大分子量蛋白用低浓度胶 “拓宽通道”,电泳电压梯度控制可避免条带 “挤压” 或 “拖尾”。
三、转膜:把蛋白 “搬” 到膜上
转膜是 WB 的 “技术活”—— 膜与胶的贴合度、电压 / 时间控制、正负极方向,稍有差错就会前功尽弃。
1. 转膜条件(按蛋白分子量调整)
| 蛋白分子量(kDa) | 转膜电压(V) | 时间(冰浴) | 核心原则 |
|---|---|---|---|
| 10 - 15 | 100 | 45min | 小蛋白别 “转丢”,时间宜短 |
| 15 - 150 | 100 | 60min | 常规蛋白 “黄金时间” |
| >150 | 100 | 120min | 大蛋白需更长时间 “穿透” 凝胶 |
2. 转膜操作 “避坑指南”
- 膜与胶的匹配:PVDF 膜大小需 与凝胶一致或略小(避免蛋白 “跑” 到膜外),滤纸、海绵尺寸同步匹配;
- “三明治” 结构:胶→膜→滤纸→海绵的顺序不能乱,厚度要均匀(太厚易让胶变形、条带弯曲;太薄易进气泡、条带残缺,可通过增减滤纸调整);
- 正负极别搞反:蛋白带负电,从负极(胶侧)向正极(膜侧)转移,接反直接 “翻车”;
- 全程冰浴:转膜缓冲液提前预冷,过程中保持低温(防止蛋白变性、转膜效率下降)。
总结:WB 实验看似流程固定,实则每个环节都藏着 “细节密码”—— 从裂解液选择到转膜操作,每一步都影响最终结果。
四、分子量 “预测值” 与 “实际值” 的差异解析
WB 实验中,目的蛋白条带位置与预测分子量不符是常见 “小插曲”。这并非实验失败,而是蛋白本身特性、实验工具误差等多重因素共同作用的结果。以下拆解核心影响因素,帮你精准定位 “差异原因” 👇
一、预染 Marker 的 “天然误差”:
预染 Marker 是 标准蛋白 + 有色染料 偶联的产物,但偶联过程会改变蛋白表面结构,导致其在 SDS-PAGE 中的迁移率与天然蛋白存在偏差;且不同批次偶联的染料量、蛋白构象有细微差异,最终表现为 5 - 10% 的分子量误差(无法完全避免)。
应对:若需精准分子量,改用 非预染 Marker 标定(天然蛋白无偶联干扰,迁移率更稳定)。
二、物种差异:同源蛋白 “长度不同”:
人源、大鼠源、小鼠源的同源蛋白,氨基酸序列并非 100% 一致 —— 部分蛋白会因物种进化出现 “长度差异”,直接导致分子量预测值与实际值不符。
示例:某些肿瘤相关蛋白(如特定转录因子),小鼠源与人类源的氨基酸序列长度差 10 - 20 个残基,分子量差异可达 2 - 3kDa。
应对:查询蛋白数据库(如 Uniprot)时,需 严格筛选物种来源,确保预测值与实验样本匹配。
三、蛋白自身特性:“动态变化” 的分子量:
蛋白并非静态分子,翻译后修饰、剪切加工、亚型差异等,都会让分子量 “灵活变动”—— 这是导致差异的最核心因素!
1. 翻译后修饰:分子量 “变大”:
磷酸化、乙酰化、糖基化等修饰,会给蛋白 “额外增重”:
- 糖基化:CD 家族蛋白(如 CD44)经糖基化修饰后,分子量可从理论值(~37kDa)飙升至 80 - 100kDa;
- 磷酸化:信号通路蛋白(如 p-ERK)磷酸化后,分子量会因带电基团增加,迁移率变慢(条带偏上)。
2. 剪切加工:分子量 “变小”:
部分蛋白以 酶原形式(前体) 合成,经剪切激活后分子量降低:
- 示例:MMP2 蛋白,酶原(pro-MMP2)分子量~72kDa,激活后剪切为~63kDa 的活性形式。
3. 亚型 / 转录本差异:分子量 “多样”:
一个基因可编码 多个转录本 / 亚型,翻译后蛋白分子量不同:
- 示例:JNK 蛋白分 JNK1、JNK2、JNK3 亚型,每个亚型又有不同转录本(如 JNK1 存在 46kDa、54kDa 两种形式),同源性高但分子量有差异。
四、Uniprot:分子量 “预测的权威参考”:
Uniprot 数据库是蛋白研究的 “百科全书”,可查询:
- 蛋白 理论分子量、亚型分类、转录本种类;
- 最初发现文献、翻译后修饰位点、剪切加工信息。
总结:分子量 “预测值” 与 “实际值” 的差异,本质是蛋白 “动态特性” 与实验工具 “固有误差” 共同作用的结果。遇到差异别慌,从 Marker 类型、物种来源、蛋白修饰 / 剪切 / 亚型 三个维度排查,结合 Uniprot 数据库验证,就能精准解析原因。
五、“白板” 与 “黑板”:WB 结果的 “跷跷板” 困境
WB 实验最让人纠结的,莫过于结果卡在 “白板”(啥信号没有)和 “黑板”(背景糊成一片)之间。本质上,这是 “检测条件不足” vs “检测条件过量” 的博弈,以下拆解核心原因与应对策略 👇
一、白板:“信号不足” 的连锁反应
“白板”≠实验失败,而是某些条件没到位,导致信号无法被检测到。从样本、抗体、孵育、显色 四个维度排查:
1. 样本浓度:基础中的基础:
WB 对蛋白浓度有最低要求 —— 每孔需 20 - 40μg 总蛋白(细胞样本建议浓度 ≥1μg/μL,组织样本因复杂成分需更高浓度)。
应对:
- 用 BCA 法重新定量,确认样本浓度是否达标;
- 若浓度低,可通过 “浓缩样本”(如超滤管浓缩)或 “增加上样体积”(但别超过孔容量)解决。
2. 一抗稀释比例:别死磕说明书:
说明书推荐的一抗比例(1:500 - 1:2000)是 “通用值”,但实际效果受样本丰度、抗体批次影响。
应对:
- 若按最低比例(1:500)仍白板,优先排查其他环节(如样本、转膜);
- 若比例过高(如 1:5000),可尝试 梯度稀释优化(如 1:500、1:1000、1:2000 对比)。
3. 一抗孵育时间:给抗体 “足够反应时间”:
常规条件是 4℃ 过夜(12 - 16h),但部分抗体亲和力低,需延长孵育 “唤醒信号”:
进阶策略:
- 延长时间(4℃ 缓慢孵育,让抗体充分结合);
- 或 4℃ 摇床低速孵育(增加抗体与膜的接触概率);
- 👉 不建议 37℃ 孵育(易导致非特异结合,且加速抗体降解)。
4. 显色体系:灵敏度决定 “信号下限”:
ECL 化学发光的灵敏度 比 DAB 高 5 - 10 倍,优先选 ECL;且 ECL 发光液分 普通型、灵敏型、超灵敏型,信号差异显著:
优化思路:
- 低丰度蛋白→选超灵敏型 ECL;
- 常规样本→用灵敏型即可;
- 同时,延长曝光时间(从 30s 到数分钟梯度尝试),捕捉弱信号。
二、黑板:“信号过量” 的背景灾难
“黑板” 是信号过强或非特异结合过多,导致背景淹没目的条带。核心解决思路是 “减量化”:
1. 上样量:别让蛋白 “堆成山”:
上样量过高(如总蛋白>50μg / 孔),会导致膜上蛋白过度密集,非特异结合暴增。
应对:
- 降低上样量(如从 40μg 减到 20μg);
- 或稀释样本后重新上样。
2. 抗体比例:一抗、二抗 “降浓度”:
- 一抗:若原比例是 1:500,可尝试 1:1000、1:2000 梯度稀释;
- 二抗:虽成熟,但高浓度仍会增加背景。建议用 1:5000 - 1:10000(HRP 二抗常温孵育 30 - 60min 即可)。
3. 曝光时间:别让背景 “喧宾夺主”:
曝光时间过长(如>5min),背景杂带会随目的条带一起被强化。
应对:
- 缩短曝光时间(从 30s 开始梯度尝试,找到 “目的条带清晰、背景干净” 的临界点);
- 配合 预染 Marker 定位目的条带位置,针对性缩短曝光。
六、封闭液:WB 的 “背景调节器”
封闭的核心是阻断膜上非特异结合位点,常规用 5% 脱脂奶粉(溶于 1×TBST),常温摇床封闭 1h。但遇到特殊情况,可换用 0.5% 明胶,两者差异及选择逻辑:
| 封闭液类型 | 优势场景 | 劣势场景 | 替换逻辑 |
|---|---|---|---|
| 5% 脱脂奶粉 | 性价比高,适合多数抗体 | 糖蛋白检测易有背景 | 背景深→换明胶 |
| 0.5% 明胶 | 糖蛋白检测背景低 | 部分抗体封闭效果弱 | 信号弱→换脱脂奶粉 |
进阶技巧:
- 若单一封闭液效果差,可尝试 混合封闭(如 3% 脱脂奶粉 + 0.2% 明胶);
- 封闭时间可延长至 2h(尤其样本复杂时,给封闭液足够时间覆盖非特异位点)。
总结:WB 实验的 “白板” 与 “黑板”,本质是检测条件的 “过犹不及”。遇到白板,从样本浓度、抗体比例、孵育时间、显色灵敏度 逐步优化;遇到黑板,通过降低上样量、稀释抗体、缩短曝光 减少背景。封闭液则是 “背景调节器”,灵活切换脱脂奶粉和明胶,能解决很多疑难问题。
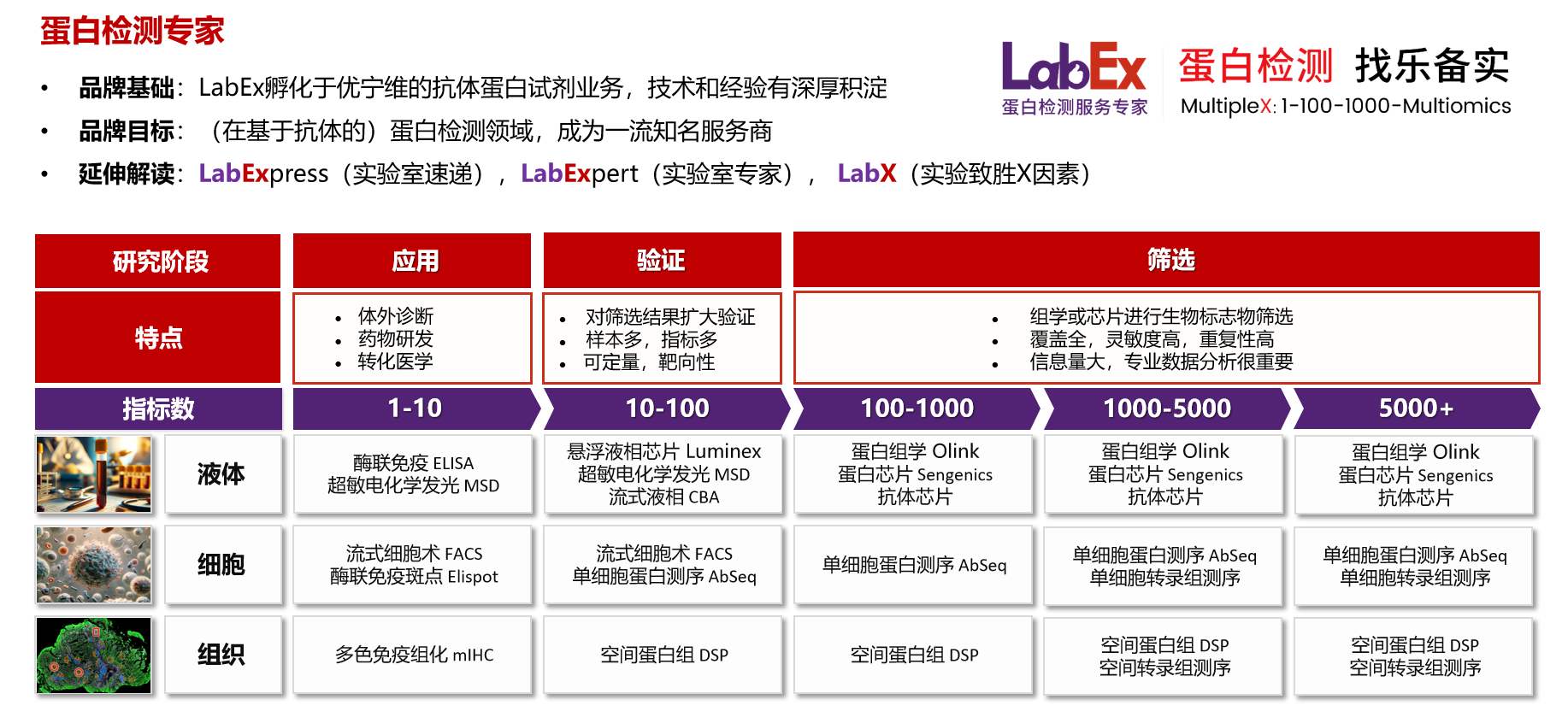
乐备实是国内专注于提供高质量蛋白检测以及组学分析服务的实验服务专家,自2018年成立以来,乐备实不断寻求突破,公司的服务技术平台已扩展到单细胞测序、空间多组学、流式检测、超敏电化学发光、Luminex多因子检测、抗体芯片、PCR Array、ELISA、Elispot、多色免疫组化、PLA等30多个,建立起了一套涵盖基因、蛋白、细胞以及组织水平实验的完整检测体系。
我们可提供从样本运输、储存管理、样本制备、样本检测到检测数据分析的全流程服务。凭借严格的实验室管理流程、标准化实验室操作、原始数据储存体系以及实验项目管理系统,已经为超过3000家客户单位提供服务,年检测样本超过100万,受到了广大客户的信任与支持。











 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


