细胞功能性实验作为解析生命活动分子机制的核心技术手段,通过模拟生理或病理条件下细胞的表型特征与行为模式,为探究基因功能、信号通路调控及药物作用机制提供了直观且可量化的实验依据。从细胞增殖、凋亡等基础生命活动的动态监测,到迁移、侵袭等复杂生物学行为的精准分析,细胞功能性实验不仅是连接分子层面研究与整体生理功能的关键桥梁,更是肿瘤学、药理学、发育生物学等领域揭示疾病发生发展规律、筛选潜在治疗靶点的重要实验支撑。其技术体系的规范化应用,直接影响研究结论的可靠性与科学性,因此成为生命科学研究者必须掌握的核心实验技能。
细胞增殖
细胞增殖与细胞凋亡、细胞周期等共同构成肿瘤研究的核心表型,亦是分子生物学与药理学领域需攻克的关键科学问题。通过在靶细胞中实现特定基因的过表达或沉默,可探究该基因对细胞增殖活性的调控作用,进而阐明基因功能;或采用药物干预细胞,分析药物对增殖过程的影响机制。
细胞增殖作为生物体的核心生命活动特征,通过细胞分裂实现数量增殖,是机体生长发育、繁殖传代及遗传信息传递的物质基础。细胞增殖的研究手段多样,主要涵盖 CCK8、CellTiter-Glo™等检测技术。
CCK-8 实验
Cell Counting Kit-8(CCK-8)试剂盒可用于高效精准的细胞增殖及毒性评估。
目的:分析靶基因对细胞增殖潜能的调控效应,或药物干预对细胞增殖水平的影响
材料:靶细胞、稳定转染细胞株(空载体对照、目的基因表达株)
步骤:细胞收集 —— 接种培养板 ——(药物处理)—— 分别在培养 0、6、24、48、72 小时后加入 CCK-8 试剂孵育,酶标仪检测吸光度值

结果:
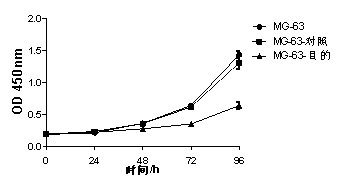
优势:
1.操作流程简便,减少细胞计数中的人为误差;
2.细胞需求量低,检测灵敏度高且结果稳定性强;
3.支持酶标仪多次读数,检测时间灵活,不干扰细胞后续实验进程;
4.CCK-8 生成的甲臜产物具有水溶性,无需换液操作,尤其适用于悬浮细胞检测,较 MTT 法更具操作便利性与安全性。
CTG 实验
目的:分析靶基因对细胞增殖活性的调控作用,或药物干预对细胞增殖能力的影响
材料:靶细胞
步骤:细胞收集 —— 接种培养板 ——(药物处理)—— 分别在培养 0、24、48、72、96 小时后加入 CellTiter-Glo™溶液,经微孔板震荡器处理 5 分钟,室温静置 10 分钟 —— 酶标仪检测荧光强度
结果:
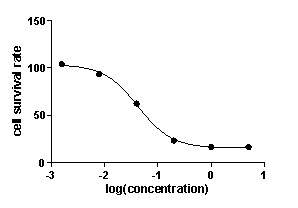
优势:
1.与常规 MTT、CCK8 检测法相比,CellTiter-Glo™发光活细胞检测系统的试剂具有更高灵敏度及更长信号存续时间,该系统已被广泛应用于生命科学研究领域,例如生物活性因子活性测定、大规模抗肿瘤药物筛选、细胞毒性实验及肿瘤放射敏感性评估等;
2.CellTiter-Glo™试剂与细胞培养中常用的培养基具有良好兼容性,包括 RPMI1640、MEM、DMEM 及 Ham's F12 等,且不受酚红及有机溶剂干扰,实验误差小,检测准确率高。
细胞凋亡
细胞凋亡是肿瘤学与发育生物学研究的核心内容,亦是药理学领域的研究热点。细胞凋亡指细胞在特定生理或病理状态下,依据内在程序主动终止生命活动的过程。这一过程具有主动性、高度有序性,受基因调控且涉及多种酶的参与。其大致可划分为以下阶段:接收凋亡信号→凋亡调控分子间的相互作用→蛋白水解酶(Caspase 家族)的激活→启动连续性反应进程。
目的:借助慢病毒感染构建特定基因过表达细胞株,采用 Annexin-PE 与 7-AAD 双染技术,对正常细胞、对照细胞及基因过表达细胞的凋亡状态进行检测,以探究该基因对细胞凋亡的调控效应。
材料:重组质粒及宿主细胞株
步骤:细胞预处理 —— 细胞收集 ——Annexin-PE 与 7-AAD 双染标记 —— 流式细胞仪检测分析
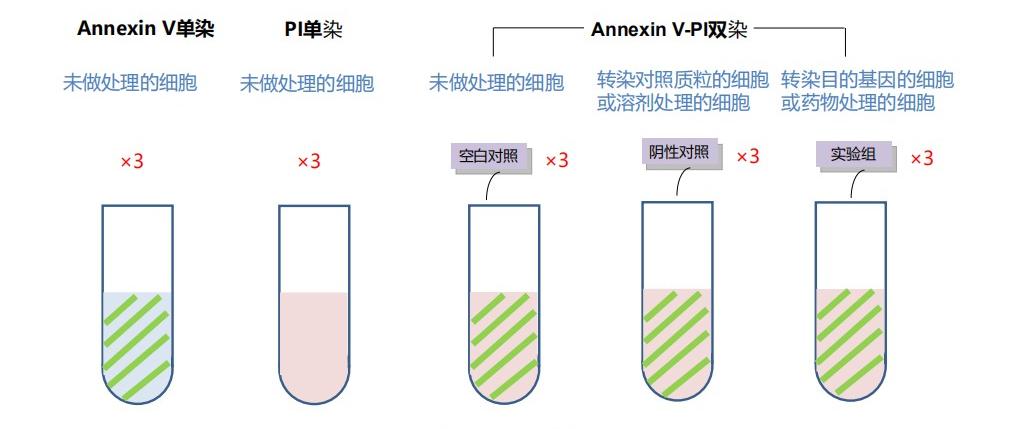
结果:
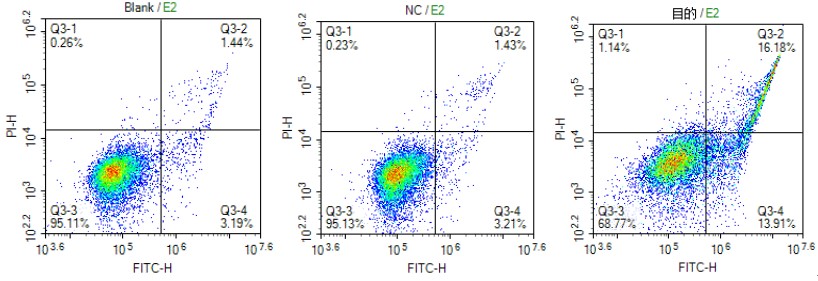
肿瘤细胞侵袭与迁移
在肿瘤演进过程中,癌细胞突破基底膜屏障并进入循环系统的分子机制是肿瘤转移研究的核心内容。相关信号通路主要涉及细胞黏附调控与细胞骨架重塑两大模块。肿瘤细胞的迁移与侵袭生物学行为依赖于细胞骨架动态重组及黏附分子表达调控。目前,检测肿瘤细胞侵袭与迁移能力的经典方法包括 Transwell 实验与细胞划痕实验,其中细胞划痕实验因无法区分细胞增殖与迁移对创面愈合的贡献而存在应用局限性。
Transwell 实验技术原理
Transwell 小室底部的聚碳酸酯滤膜(孔径通常为 8.0-12.0μm)将上下腔室分隔,下层培养液中的趋化因子可通过滤膜渗透至上层,从而诱导具有迁移能力的细胞向营养富集区域定向移动。该技术平台可用于研究趋化因子梯度对细胞运动行为的调控机制。
肿瘤细胞迁移实验
用于评估肿瘤细胞在趋化因子诱导下的定向迁移能力。实验选用 8.0μm 孔径滤膜,上室接种肿瘤细胞悬液,下室添加含胎牛血清或特定趋化因子的培养液。在趋化因子梯度作用下,具有迁移活性的肿瘤细胞穿越滤膜微孔到达下表面,通过计数迁移细胞数量可定量评估肿瘤细胞的迁移潜能。
肿瘤细胞侵袭实验
用于检测肿瘤细胞穿透细胞外基质屏障的能力。实验在聚碳酸酯滤膜表面包被基质胶模拟基底膜结构,上室接种肿瘤细胞,下室添加趋化因子。具有侵袭活性的肿瘤细胞需首先分泌基质金属蛋白酶降解基质胶,然后穿越滤膜到达下表面。通过计数侵袭细胞数量可定量评估肿瘤细胞的侵袭能力。
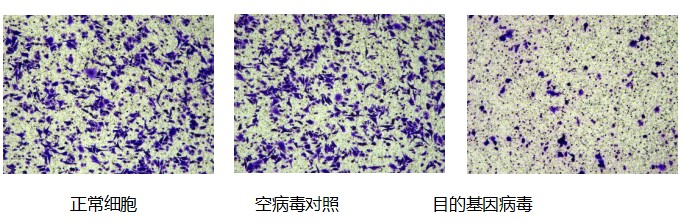
目的:探究目的基因过表达 / 沉默对肿瘤细胞侵袭与转移能力的影响
材料:野生型细胞系、空载慢病毒对照组、目的基因过表达 / 干扰慢病毒感染组
步骤:细胞复苏与传代培养 ——Transwell 小室铺板 —— 细胞接种与条件培养 —— 结晶紫染色 —— 显微镜观察与图像采集

结果:
细胞划痕实验
肿瘤细胞在体外培养条件下仍保留迁移运动的生物学特性。细胞划痕实验是评估肿瘤细胞迁移能力的经典方法之一。该技术基于体外细胞损伤修复模型,通过机械划痕造成单层细胞损伤,然后对比不同处理组细胞向损伤区域迁移的能力差异。
目的:利用筛选获得的稳定细胞株(空载病毒对照组、目的基因过表达组),通过对空白对照、空载稳转及目的基因稳转三组细胞的划痕愈合宽度进行统计学分析,探究目的基因对细胞迁移能力的调控作用。
材料:慢病毒表达载体及宿主细胞系(目的细胞由客户提供,稳定转染株由瀚鸿生物技术构建)
步骤:
- 细胞接种:将对数生长期细胞接种于 6 孔板,待细胞融合度达 90% 以上
- 划痕制备:使用 200μl 无菌枪头垂直于孔板底面匀速划痕
- 条件培养:PBS 洗涤去除脱落细胞,更换无血清培养基继续培养
- 时序观察:分别于 0h、24h、48h、72h 时间点在倒置显微镜下拍照记录
- 数据分析:使用 ImageJ 软件测量划痕宽度并计算愈合率
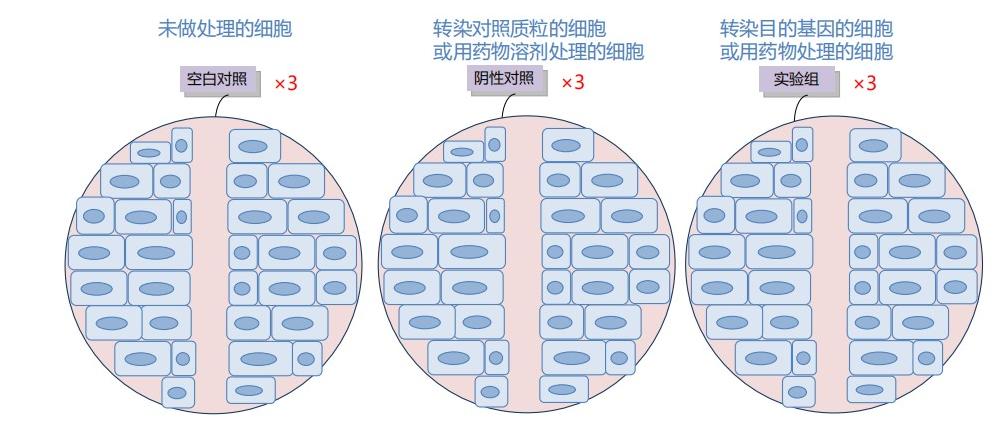
结果:

细胞周期检测
细胞周期(cell cycle)指细胞从一次分裂完成到下一次分裂结束所经历的整个过程,可划分为间期与分裂期两个主要阶段。细胞周期状态直接反映细胞的增殖速率,虽然单个体细胞的周期可通过缩时摄影技术测定,但该方法无法体现细胞群体的周期特征,因此目前多采用其他技术检测细胞群体的周期分布。
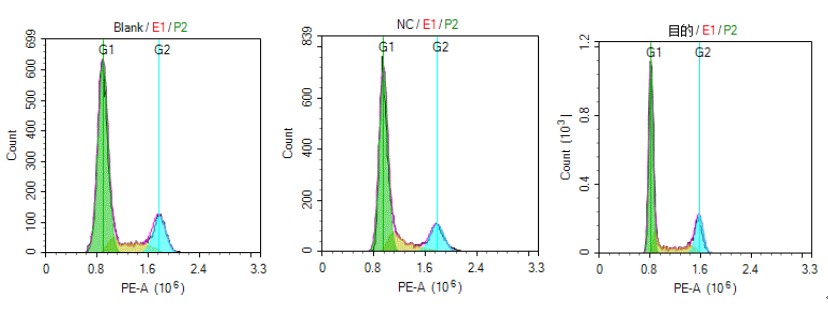
目的:通过慢病毒感染构建目的基因过表达细胞株,采用 PI 染色结合流式细胞术分析各组细胞的周期时相分布变化,进而探究目的基因对细胞周期进程的调控作用。
材料:靶细胞、重组慢病毒(含目的基因序列及对照序列)
流程:细胞预处理 —— 样本收集与固定 ——PI 染色标记 —— 流式细胞仪检测 —— 数据统计分析
结果:
克隆形成实验
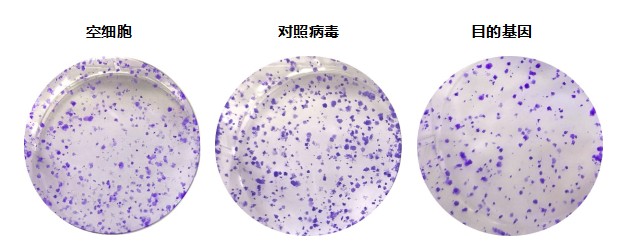
目的:通过对目的基因过表达 / 干扰细胞组、空白细胞组及阴性对照组(空病毒)的克隆形成数量进行统计学分析,探究该基因对细胞群体依赖性及增殖潜能的影响。
材料:重组病毒与宿主细胞株
步骤:细胞接种 —— 传代培养 —— 克隆观察、染色及克隆形成率计算

结果:
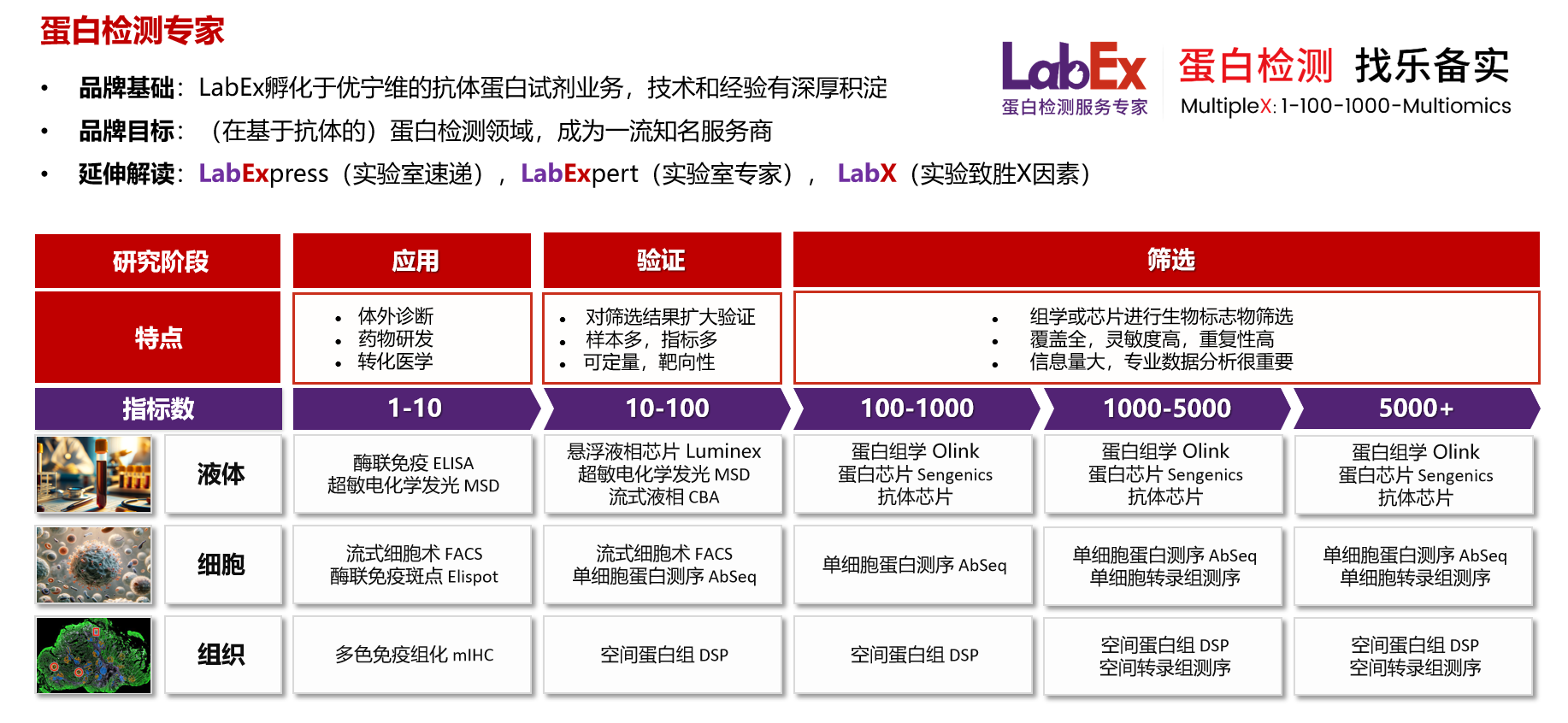
乐备实是国内专注于提供高质量蛋白检测以及组学分析服务的实验服务专家,自2018年成立以来,乐备实不断寻求突破,公司的服务技术平台已扩展到单细胞测序、空间多组学、流式检测、超敏电化学发光、Luminex多因子检测、抗体芯片、PCR Array、ELISA、Elispot、多色免疫组化等30多个,建立起了一套涵盖基因、蛋白、细胞以及组织水平实验的完整检测体系。
我们可提供从样本运输、储存管理、样本制备、样本检测到检测数据分析的全流程服务。凭借严格的实验室管理流程、标准化实验室操作、原始数据储存体系以及实验项目管理系统,已经为超过3000家客户单位提供服务,年检测样本超过100万,受到了广大客户的信任与支持。











 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


