引言:糖尿病治疗面临的挑战与细胞疗法的机遇
糖尿病作为一种全球流行的代谢性疾病,其病理特征主要表现为胰岛素分泌缺陷和/或胰岛素抵抗。尽管传统药物治疗和胰岛素替代疗法取得了一定成效,但均无法从根本上恢复患者的胰岛功能。胰岛移植虽被证实能够有效重建内源性胰岛素分泌系统,却面临着供体严重短缺、免疫排斥反应以及长期免疫抑制治疗带来的并发症等严峻挑战。近年来,随着再生医学的快速发展,基于体细胞重编程技术的细胞替代疗法为糖尿病治疗提供了全新的思路和解决方案。
体细胞重编程技术主要包括诱导多能干细胞(iPSCs)技术、直接谱系重编程技术和囊胚互补技术三大类。这些技术通过重新编程体细胞的表观遗传状态,使其获得新的细胞命运,从而为糖尿病治疗提供潜在的无限细胞来源。本文将系统阐述这些技术在糖尿病领域的研究进展,探讨其临床应用前景及面临的挑战,为未来研究提供理论参考和技术指导。
诱导多能干细胞(iPSCs)技术的研究进展
iPSCs技术的优化与创新
自2006年Yamanaka团队开创性发现以来,iPSCs技术经历了快速发展和不断完善。传统四因子(OSKM)重编程方法虽然有效,但存在效率低、安全性差等明显局限。为提高重编程效率,研究者开发了多种优化策略:通过添加小分子化合物如组蛋白去乙酰化酶抑制剂可显著提升重编程效率;采用microRNA替代部分转录因子可降低致瘤风险;而MBD3基因敲除则能将重编程效率提高到接近100%的水平。
在重编程载体系统方面,科研人员已从最初的逆转录病毒发展到非整合型载体系统,包括附加型载体、蛋白质转导和合成mRNA等技术。特别是合成mRNA技术,不仅避免了基因组整合风险,还能通过核苷酸修饰降低免疫原性,为重编程提供了更安全的解决方案。此外,表观遗传调控因子的应用,如组蛋白变体H3.3和染色质重塑因子BAF复合物,也被证明能显著促进重编程过程。
iPSCs向胰岛β细胞的分化
建立高效、稳定的胰岛β细胞分化体系是iPSCs临床应用的关键。目前,研究者已开发出多步诱导方案,模拟胚胎胰腺发育过程:首先将iPSCs定向分化为定型内胚层,继而诱导为胰腺前体细胞,最终分化为功能成熟的胰岛β细胞。通过优化细胞因子组合(如激活素A、FGF10和视黄酸等)和培养条件(三维培养、生物材料支架等),获得的胰岛样细胞已具备葡萄糖刺激的胰岛素分泌能力。
值得注意的是,不同来源的iPSCs在分化效率上存在显著差异。研究者已成功建立了包括1型糖尿病、2型糖尿病和单基因糖尿病等多种糖尿病患者的iPSCs系,这些疾病特异性iPSCs不仅为研究糖尿病发病机制提供了独特模型,也为个体化治疗奠定了基础。例如,MODY患者来源的iPSCs在分化过程中表现出特定的基因表达模式和功能缺陷,这为理解特定基因突变如何影响β细胞发育和功能提供了重要线索。
iPSCs技术的临床转化
iPSCs技术已开始从实验室走向临床。2013年日本批准了首例iPSCs来源的视网膜色素上皮细胞移植治疗年龄相关性黄斑变性的临床试验,标志着iPSCs临床应用的里程碑。在糖尿病领域,虽然尚未有iPSCs来源的β细胞进入临床试验,但ESCs来源的胰腺前体细胞治疗1型糖尿病的临床试验已获得FDA批准,为iPSCs的临床应用铺平了道路。
免疫排斥问题一直是细胞移植的主要障碍。理论上,自体iPSCs来源的β细胞移植可避免免疫排斥,但这一过程的成本和时间限制了其广泛应用。为解决这一问题,研究者提出了建立HLA匹配的iPSCs库、使用通用供体细胞(如通过基因编辑敲除免疫相关基因)等策略。灵长类动物研究显示,自体iPSCs来源的多巴胺能神经元移植后存活率显著高于异体移植,证实了个体化治疗在克服免疫排斥方面的优势。
直接谱系重编程技术在糖尿病中的应用
跨谱系重编程策略
直接谱系重编程技术避开了多能干细胞阶段,将一种终末分化细胞直接转化为另一种功能细胞,这一策略在糖尿病治疗中展现出独特优势。研究者已成功将成纤维细胞、肝细胞、胰腺外分泌细胞等多种体细胞直接重编程为胰岛β样细胞。这一过程通常需要过表达胰腺发育关键转录因子(如Pdx1、Ngn3、MafA等),并结合小分子化合物调控相关信号通路。
特别值得关注的是,在胰腺内部存在的细胞命运可塑性为β细胞再生提供了新思路。研究表明,在β细胞大量缺失的情况下,α细胞可自发转分化为β细胞。通过基因操作调控关键转录因子(如Pax4过表达或Arx敲除)可促进这一转化过程。这种内源性细胞转分化策略避免了体外操作和细胞移植,具有显著的临床应用潜力。
重编程机制与效率优化
直接重编程的分子机制涉及染色质重塑、表观遗传修饰和代谢重编程等多个层面。研究发现,中间过渡状态的出现是重编程成功的关键,例如在成纤维细胞向β细胞重编程过程中,细胞会先获得内胚层特性,再逐步获得胰腺内分泌细胞特征。通过单细胞测序技术,研究者能够精确解析重编程轨迹,识别关键调控节点,从而设计更高效的重编程方案。
提高重编程效率和功能成熟度是当前研究的重点。组合筛选发现,小分子化合物如5-氮杂胞苷(DNA甲基化抑制剂)和SB431542(TGF-β信号抑制剂)可显著提升重编程效率。此外,三维培养环境和机械力刺激也被证明能促进重编程细胞的成熟和功能。最近研究还发现,代谢干预如糖酵解抑制可通过改变细胞表观遗传状态来促进重编程过程。
囊胚互补技术的探索与前景
种间器官再生技术
囊胚互补技术是一项革命性的器官再生策略,其核心原理是利用基因修饰使宿主动物特定器官发育缺陷,然后通过植入供体多能干细胞在宿主体内形成完整的异种器官。日本研究者通过在Pdx1敲除(胰腺发育缺陷)小鼠囊胚中注入大鼠多能干细胞,成功在小鼠体内培育出功能正常的大鼠胰腺。这一突破性成果证明了利用大型动物为人类培育器官的可能性。
在大型动物模型中,研究人员通过调控Hes1基因表达构建了胰腺发育缺陷的猪模型,为未来人类胰腺培育奠定了基础。理论上,将患者特异性iPSCs注入经过基因修饰的猪胚胎,有望在猪体内培育出具有完整血管和神经支配的人源化胰腺,这将从根本上解决器官短缺问题。
技术挑战与伦理考量
尽管前景广阔,囊胚互补技术仍面临诸多挑战。异种器官可能含有宿主来源的血管和基质细胞,导致移植后免疫排斥风险。此外,供体细胞在宿主体内的分布难以精确控制,可能形成嵌合现象,特别是生殖系嵌合引发的伦理问题备受关注。技术层面,如何确保器官的大小、结构和功能与人类需求相匹配,以及如何实现规模化生产都是亟待解决的难题。
总结与展望
体细胞重编程技术为糖尿病治疗带来了前所未有的机遇。iPSCs技术通过建立疾病模型和提供替代细胞来源,在基础研究和临床应用中展现出巨大潜力;直接谱系重编程技术简化了细胞制备流程,降低了致瘤风险;而囊胚互补技术则可能彻底解决器官短缺问题。这些技术的发展和完善将推动糖尿病治疗进入精准医学和再生医学的新时代。
未来研究应着重解决几个关键问题:(1)提高重编程细胞的功能成熟度和稳定性;(2)开发更安全、高效的重编程方法;(3)建立标准化质量控制体系;(4)解决免疫排斥问题;(5)完善临床转化路径。随着这些问题的逐步解决,体细胞重编程技术有望为糖尿病患者带来根治性疗法,实现从症状控制到功能重建的治疗模式转变。
多学科交叉融合将加速这一进程。基因编辑技术(如CRISPR)可精确调控重编程过程;生物材料科学可提供更理想的细胞培养微环境;人工智能有助于优化重编程方案;微流控技术则能实现细胞制备的标准化和自动化。这些技术的协同发展将推动糖尿病细胞治疗从实验室走向临床,最终造福广大患者。
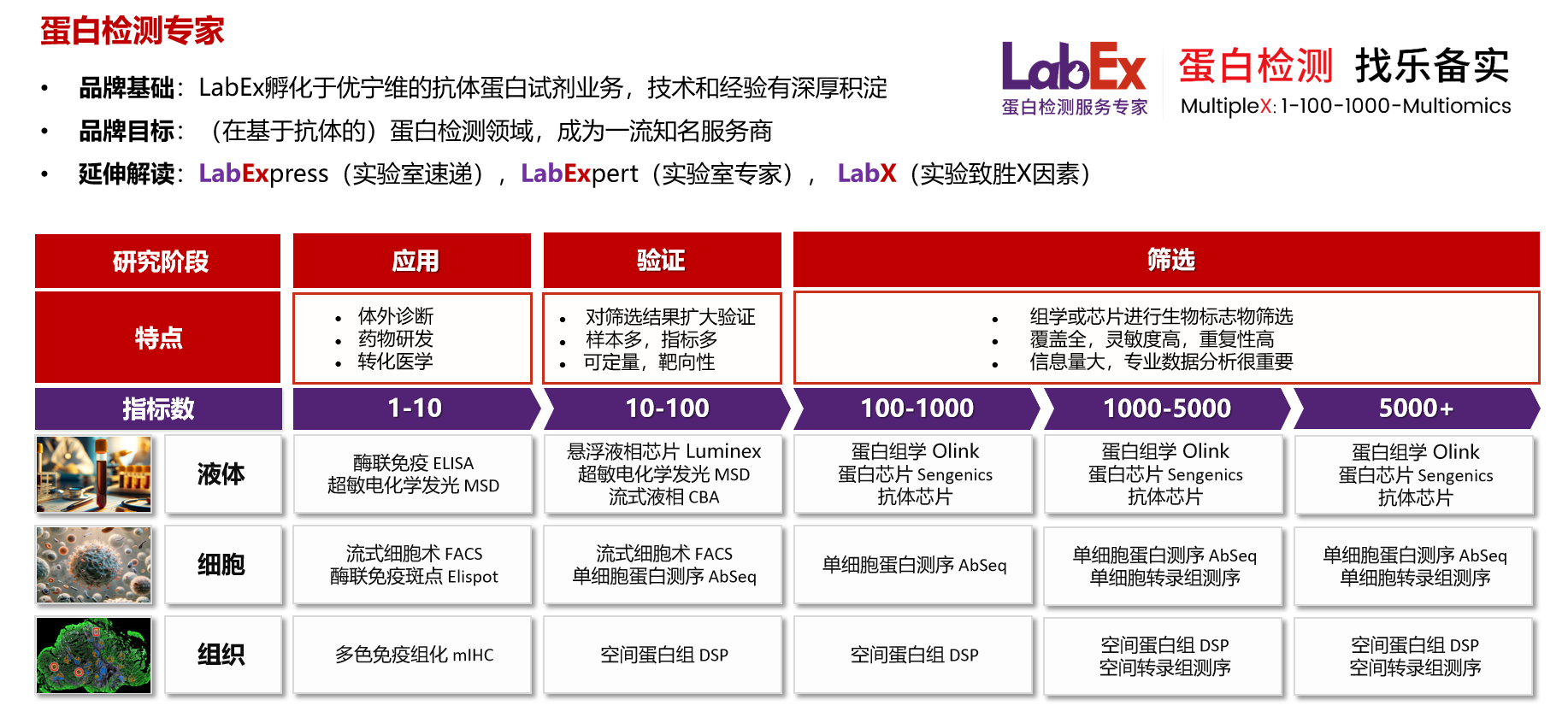
乐备实是国内专注于提供高质量蛋白检测以及组学分析服务的实验服务专家,自2018年成立以来,乐备实不断寻求突破,公司的服务技术平台已扩展到单细胞测序、空间多组学、流式检测、超敏电化学发光、Luminex多因子检测、抗体芯片、PCR Array、ELISA、Elispot、多色免疫组化等30多个,建立起了一套涵盖基因、蛋白、细胞以及组织水平实验的完整检测体系。
我们可提供从样本运输、储存管理、样本制备、样本检测到检测数据分析的全流程服务。凭借严格的实验室管理流程、标准化实验室操作、原始数据储存体系以及实验项目管理系统,已经为超过3000家客户单位提供服务,年检测样本超过100万,受到了广大客户的信任与支持。











 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


