自噬过程的概述与生物学功能
细胞自噬(Autophagy)是一种高度保守的细胞内降解系统,通过形成双层膜结构的自噬体包裹胞质成分,最终与溶酶体融合完成内容物的降解与回收。这一精密调控的细胞过程在维持细胞内稳态中扮演着核心角色,参与营养缺乏时的能量供应、受损细胞器的清除以及细胞内病原体的防御等多种生理功能。自噬过程的异常与多种人类疾病密切相关,包括神经退行性疾病、感染性疾病、心血管疾病和恶性肿瘤等,因此深入理解自噬的分子调控机制具有重要的基础研究和临床价值。
根据底物运输方式的不同,哺乳动物细胞自噬主要分为三种类型:巨自噬(Macroautophagy)、微自噬(Microautophagy)和分子伴侣介导的自噬(Chaperone-mediated autophagy)。其中巨自噬是最主要的形式,其特征是形成典型的自噬体结构,这也是本文讨论的重点。从分子层面看,自噬过程可划分为四个连续的阶段:起始诱导、成核延伸、成熟融合和降解回收,每个阶段都受到精细的分子调控。
自噬的起始调控机制
能量感受与营养信号通路
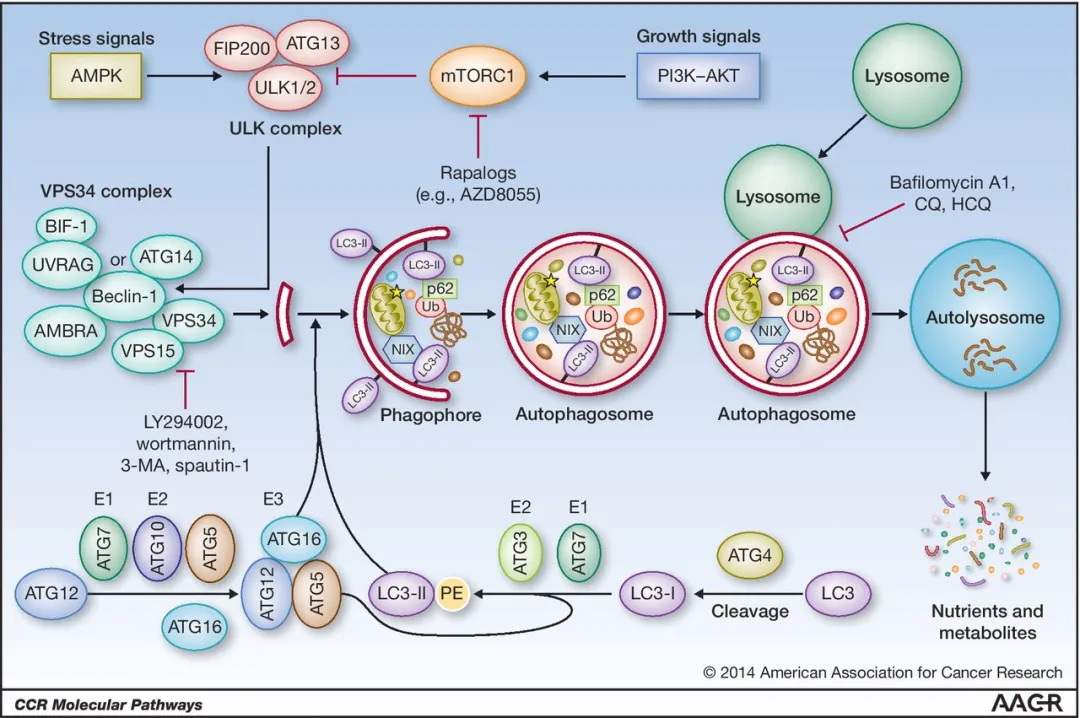
自噬的起始阶段主要受到细胞内能量状态和营养水平的调控。AMP激活的蛋白激酶(AMPK)作为细胞内重要的能量传感器,在ATP水平下降时被激活,通过直接磷酸化UNC-51样激酶1/2(ULK1/2)复合物中的多个位点来启动自噬过程。ULK复合物由ULK1/2、FAK家族相互作用蛋白200(FIP200)和自噬相关蛋白13(ATG13)组成,是自噬体形成的核心调控节点。
哺乳动物雷帕霉素靶蛋白复合物1(mTORC1)是另一关键的调控枢纽,整合多种上游信号包括生长因子、氨基酸和能量状态。在营养充足条件下,激活的mTORC1通过磷酸化ULK1/2和ATG13抑制自噬起始;而在饥饿或雷帕霉素处理等条件下,mTORC1活性受抑,解除对ULK复合物的抑制,从而触发自噬。值得注意的是,AMPK和mTORC1对ULK1的磷酸化位点不同且相互拮抗,形成了精细的双向调控网络。
Ⅲ类磷脂酰肌醇3-激酶复合物
自噬起始的另一关键事件是Ⅲ类磷脂酰肌醇3-激酶(VPS34)复合物的募集与激活。VPS34可产生磷脂酰肌醇3-磷酸(PI3P),为自噬前体膜(又称隔离膜或吞噬泡)的形成提供平台。根据所含调节亚基的不同,VPS34复合物可分为两种形式:复合物Ⅰ包含ATG14L,主要参与自噬体的形成;复合物Ⅱ包含UVRAG,更多参与自噬体与溶酶体的融合过程。Beclin 1作为VPS34的核心调节亚基,其活性受到多种翻译后修饰的调控,如Bcl-2家族蛋白通过结合Beclin 1抑制其功能,而TNF受体相关因子6(TRAF6)介导的K63连接的多聚泛素化则可增强其活性。
自噬体的形成与成熟机制
泛素样偶联系统
自噬体膜延伸过程依赖于两个泛素样偶联系统:ATG12-ATG5系统和LC3-PE系统。在ATG12-ATG5系统中,ATG12通过E1样酶ATG7和E2样酶ATG10的作用与ATG5形成共价结合物,随后与ATG16L1结合形成ATG12-ATG5-ATG16L1复合物,定位于自噬前体膜的外膜,决定膜的延伸方向。
LC3(微管相关蛋白1轻链3)系统是自噬体形成的另一关键机制。新合成的LC3前体首先被半胱氨酸蛋白酶ATG4切割产生LC3-I,随后在E1样酶ATG7和E2样酶ATG3的作用下与磷脂酰乙醇胺(PE)偶联形成膜结合的LC3-II。LC3-II定位于自噬前体膜和成熟自噬体的内外膜,不仅是自噬体形成的标志物,还通过与其他ATG蛋白的相互作用参与自噬体的延伸和封闭过程。值得注意的是,ATG4除了在LC3加工中发挥作用外,还可从膜上切割LC3-II实现LC3的循环利用。
自噬底物的识别与选择性自噬
虽然传统认为自噬是非选择性的批量降解过程,但近年研究发现自噬具有高度选择性。选择性自噬通过特定的受体蛋白识别泛素化标记的底物,如p62/SQSTM1、NBR1和OPTN等。这些受体蛋白通常含有LC3相互作用区(LIR)和泛素结合区(UBD),能够同时结合LC3和泛素化底物,形成"自噬货物-受体-LC3"三元复合物,将特定底物靶向至自噬体。
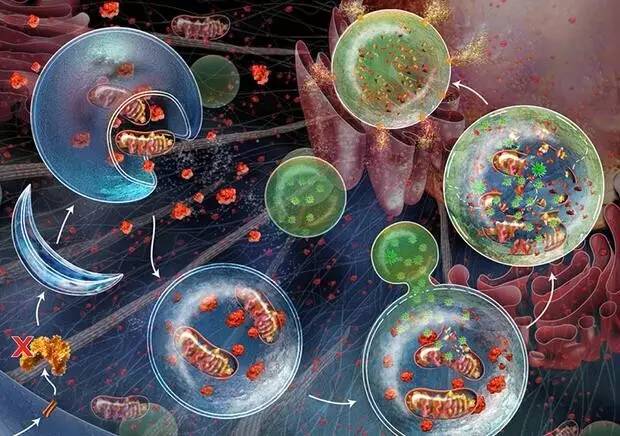
根据降解底物的不同,选择性自噬可分为多种类型:线粒体自噬(Mitophagy)清除受损线粒体;内质网自噬(Reticulophagy)降解多余的内质网膜;过氧化物酶体自噬(Pexophagy)清除过氧化物酶体;核糖体自噬(Ribophagy)降解核糖体;以及脂噬(Lipophagy)参与脂滴的降解等。这些选择性自噬过程在维持细胞器质量和代谢平衡中发挥重要作用。
自噬体与溶酶体的融合及降解
自噬体成熟与运输
新形成的自噬体需要经历成熟过程才能获得降解能力。这一过程涉及自噬体膜成分的重塑、酸化以及与内体-溶酶体系统的融合。Rab GTP酶家族成员,特别是Rab7,在自噬体运输和成熟中起关键作用。Rab7通过招募效应蛋白如HOPS复合物促进自噬体与溶酶体的对接和融合。此外,SNARE蛋白如Syntaxin 17、SNAP29和VAMP8也参与膜融合过程。
溶酶体融合与内容物降解
自噬体与溶酶体融合形成自噬溶酶体后,溶酶体水解酶降解包裹的内容物,释放出氨基酸、脂肪酸等小分子物质,通过溶酶体膜转运体回输至胞质重新利用。溶酶体的再生和功能维持对自噬通量的完整性至关重要。转录因子EB(TFEB)是调控溶酶体生物发生和自噬的主要转录因子,在营养缺乏时发生核转位,激活溶酶体和自噬相关基因的表达。
自噬与疾病的关系及治疗前景
自噬在疾病中的作用
自噬异常与多种疾病密切相关。在神经退行性疾病中,自噬功能受损导致异常蛋白聚集,如阿尔茨海默病的β-淀粉样蛋白和tau蛋白、帕金森病的α-突触核蛋白等。在癌症中,自噬具有双重作用:早期抑制肿瘤发生,晚期则可能帮助肿瘤细胞应对代谢压力。在感染性疾病中,自噬可清除细胞内病原体,但某些病原体也进化出逃避或利用自噬的机制。
靶向自噬的治疗策略
基于对自噬分子机制的深入理解,多种靶向自噬的治疗策略正在开发中:
1)自噬诱导剂(如雷帕霉素类似物)用于神经退行性疾病和感染性疾病;
2)自噬抑制剂(如羟氯喹)与化疗联合用于癌症治疗;
3)选择性自噬调节剂(如线粒体自噬激活剂)用于线粒体相关疾病;
4)基因治疗恢复缺陷的自噬功能。
然而,自噬调控的复杂性和组织特异性给药物开发带来挑战,需要更精确的靶向递送系统和时空特异性调控策略。随着对自噬分子机制认识的不断深入,以及基因编辑、单细胞技术等新方法的应用,靶向自噬的精准治疗将迎来新的发展机遇。
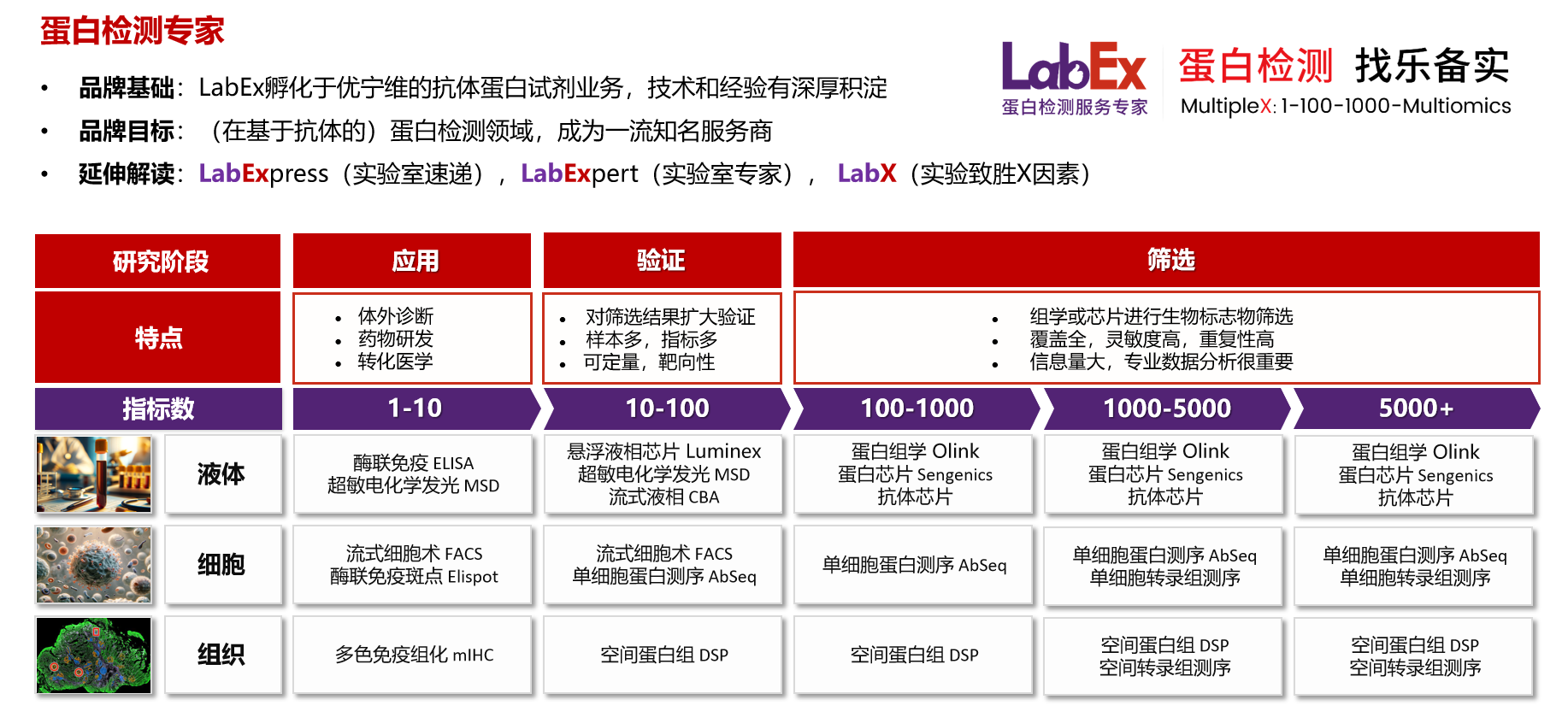
乐备实是国内专注于提供高质量蛋白检测以及组学分析服务的实验服务专家,自2018年成立以来,乐备实不断寻求突破,公司的服务技术平台已扩展到单细胞测序、空间多组学、流式检测、超敏电化学发光、Luminex多因子检测、抗体芯片、PCR Array、ELISA、Elispot、多色免疫组化等30多个,建立起了一套涵盖基因、蛋白、细胞以及组织水平实验的完整检测体系。
我们可提供从样本运输、储存管理、样本制备、样本检测到检测数据分析的全流程服务。凭借严格的实验室管理流程、标准化实验室操作、原始数据储存体系以及实验项目管理系统,已经为超过3000家客户单位提供服务,年检测样本超过100万,受到了广大客户的信任与支持。











 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


