CAR-T细胞疗法的发展现状
嵌合抗原受体T细胞(CAR-T)疗法作为肿瘤免疫治疗的重要突破,已在血液系统恶性肿瘤治疗中展现出显著的临床价值。自2017年首款CAR-T产品获批以来,全球范围内已有多种针对CD19和B细胞成熟抗原(BCMA)的CAR-T细胞产品被批准用于复发/难治性B细胞恶性肿瘤的治疗,包括急性B淋巴细胞白血病(B-ALL)、弥漫性大B细胞淋巴瘤(DLBCL)和多发性骨髓瘤(MM)等。临床数据显示,CAR-T疗法在这些难治性血液肿瘤中可达到60-90%的客观缓解率,其中相当比例患者可获得长期缓解。
然而,CAR-T细胞治疗仍面临多重挑战。治疗后复发(包括抗原阳性复发和抗原阴性复发)影响了约30-60%患者的长期疗效。此外,细胞因子释放综合征(CRS)和免疫效应细胞相关神经毒性综合征(ICANS)等治疗相关不良事件仍是临床应用的重要限制因素。在技术层面,复杂的制备工艺、高昂的治疗成本以及较长的生产周期也制约了该疗法的广泛应用。针对这些挑战,近年来研究者从CAR结构设计、靶点选择、生产工艺和临床应用等多个维度进行了系统性优化。
CAR分子结构与靶点策略的优化
CAR分子设计的工程化改进
CAR分子的结构优化是提高疗效和安全性的核心环节。典型的二代CAR包含单链抗体片段(scFv)抗原识别区、铰链区、跨膜区和胞内信号域(CD3ζ加共刺激分子)。研究者通过多种策略改进CAR设计:优化scFv的亲和力以平衡靶向特异性和脱靶风险;调整铰链区长度和组成以改善受体寡聚化和信号转导;探索新型共刺激分子(如ICOS、OX40)的组合应用;开发可调控的CAR系统(如iCAR、SUPRA CAR)以增强安全性。
双靶点CAR-T设计是克服抗原逃逸的重要策略。同时靶向CD19和CD22的双特异性CAR-T在B-ALL治疗中显示出更高的完全缓解率和更低的复发率。类似地,靶向BCMA和CD19或CD38的双靶点CAR-T也为多发性骨髓瘤患者提供了新的治疗选择。此外,串联CAR、正交CAR等新型结构设计进一步丰富了CAR-T的技术路线,为个体化治疗提供了更多可能。
创新靶点的开发与验证
除CD19和BCMA等成熟靶点外,研究者不断探索新的治疗靶点。在急性髓系白血病(AML)领域,针对CD33、CD123、CLL-1等靶点的CAR-T疗法已进入临床研究阶段。对于T细胞恶性肿瘤,通过基因编辑技术开发了靶向CD7、CD5等标志物的通用型CAR-T产品。在淋巴瘤方面,CD30 CAR-T对霍奇金淋巴瘤显示出良好的治疗效果,而CD20/CD22双靶点CAR-T则为难治性B细胞淋巴瘤患者带来了希望。
靶点选择的关键考量包括肿瘤特异性、表达均匀性和生物学必要性。通过单细胞测序和蛋白质组学技术,研究者系统分析了不同血液肿瘤的抗原表达谱,为靶点选择提供了科学依据。同时,计算机辅助设计和人工智能预测加速了新靶点的发现和验证过程。
生产工艺与治疗方案的优化
细胞制备工艺的技术革新
CAR-T细胞的生产制备是影响治疗效果的关键环节。研究者对生产工艺进行了多方面优化:改进白细胞分离技术以提高起始T细胞质量;探索新型激活方法(如纳米材料刺激)增强T细胞扩增能力;优化转染条件提高基因编辑效率;开发自动化封闭式生产系统降低污染风险。微流控技术的应用显著缩短了生产时间并提高了产品一致性。
质量控制体系的完善是保证疗效的重要保障。研究者建立了包括细胞表型分析、功能测定和分子特征检测等多维度的评估指标。通过转录组学和代谢组学分析,鉴定了与临床疗效相关的生物标志物,为细胞产品的质控提供了新的工具。
治疗策略的优化与创新
治疗方案的优化是提高CAR-T疗效的重要方向。在淋巴细胞清除方案方面,研究者根据患者特征调整化疗药物组合和剂量,平衡免疫抑制效果和毒性反应。在治疗时机选择上,探索了早期应用和微小残留病(MRD)阳性阶段的干预策略。
联合治疗是增强CAR-T疗效的重要途径。临床研究显示,免疫检查点抑制剂与CAR-T联用可克服免疫微环境介导的耐药;去甲基化药物可能通过调节肿瘤微环境增强CAR-T细胞活性;靶向药物(如BTK抑制剂、BCL-2抑制剂)与CAR-T的协同效应也正在评估中。此外,将CAR-T疗法与放射治疗、表观遗传调节剂等联合应用的策略也显示出良好前景。

毒性管理与疗效提升策略
CRS和ICANS的防控体系
CRS和ICANS是CAR-T治疗最常见的不良反应。研究者建立了多层次的防控体系:通过CAR结构优化降低细胞因子释放强度;采用分次输注策略减轻毒性反应;开发预测模型早期识别高风险患者。在治疗方面,形成了以IL-6受体拮抗剂(托珠单抗)为基础,联合糖皮质激素、TNF-α抑制剂等的阶梯式干预策略。
值得注意的是,不同人群ICANS发生率存在显著差异,这可能与遗传背景、肿瘤生物学特征和治疗方案等多因素相关。研究者通过多组学分析揭示了神经毒性的潜在机制,为个体化防控提供了理论基础。
持久性提升与耐药克服
提高CAR-T细胞的持久性是改善长期疗效的关键。研究者从多个角度进行探索:筛选具有记忆表型的T细胞亚群用于生产;通过表观遗传调控延缓细胞耗竭;联合免疫调节剂维持CAR-T细胞活性。代谢重编程(如增强线粒体功能)也被证明可延长CAR-T细胞的体内存活时间。
针对耐药机制,研究者开发了动态监测技术和早期干预策略,包括MRD指导的维持治疗和抗原逃逸后的靶向转换。同时,通过调节肿瘤微环境(如靶向免疫抑制细胞或细胞因子)来克服微环境介导的耐药也取得了初步成效。
未来发展方向与挑战
CAR-T细胞疗法在血液恶性肿瘤中的应用仍面临诸多挑战。在技术层面,需要进一步提高疗效、降低毒性并简化生产工艺;在临床转化方面,需建立标准化的治疗规范和长期随访体系;在可及性方面,应通过技术创新和政策优化降低治疗成本。
未来发展方向包括:开发智能化CAR系统实现精准调控;探索新型递送技术提高转染效率;结合单细胞多组学和人工智能预测治疗反应;建立真实世界研究数据库指导临床决策。通用型CAR-T产品的优化和实体瘤适应症的拓展也将是重要研究领域。
随着技术的不断进步和临床经验的积累,CAR-T细胞疗法有望为更多血液肿瘤患者带来长期生存获益。通过多学科交叉融合和产学研医协同创新,这一革命性治疗手段将不断完善,最终实现从"治疗选择"到"治愈手段"的跨越。
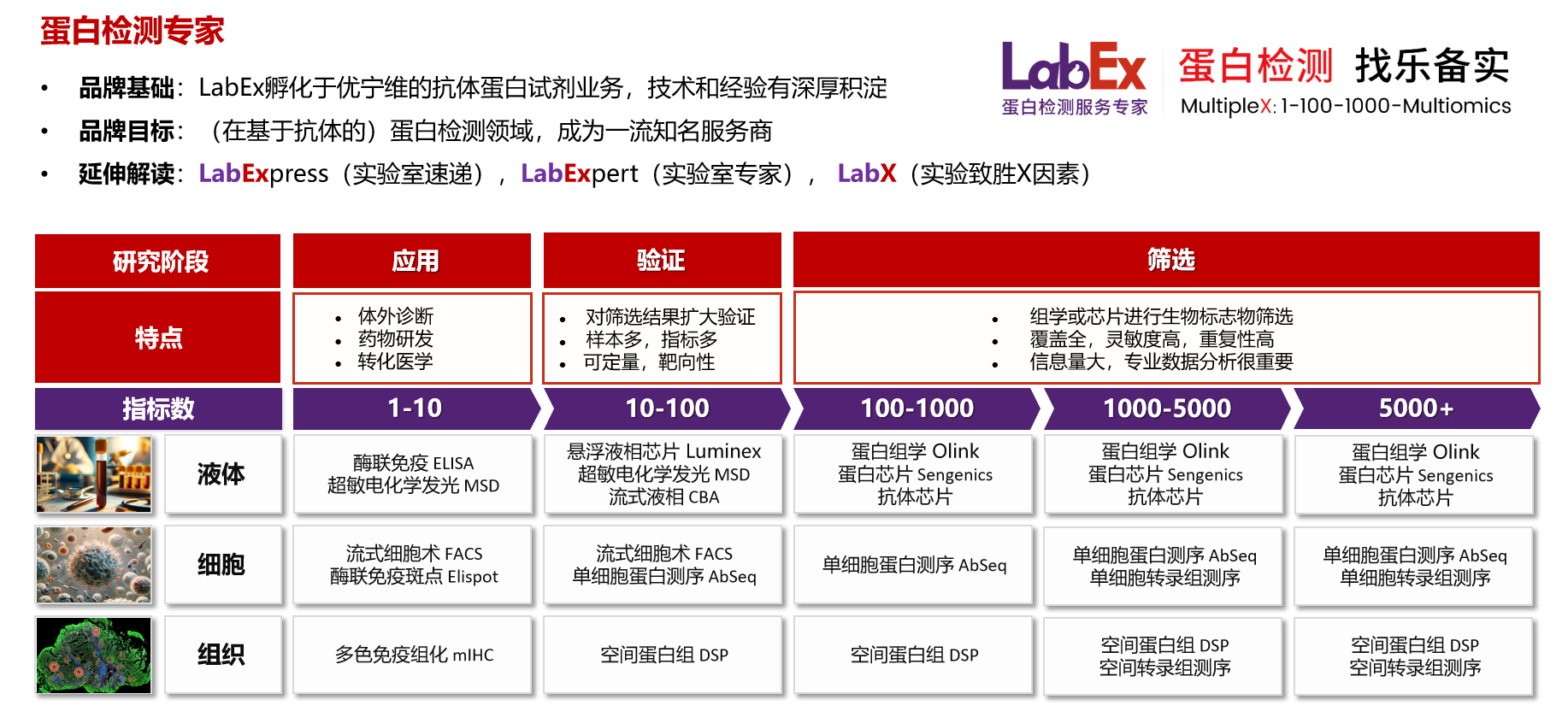
乐备实是国内专注于提供高质量蛋白检测以及组学分析服务的实验服务专家,自2018年成立以来,乐备实不断寻求突破,公司的服务技术平台已扩展到单细胞测序、空间多组学、流式检测、超敏电化学发光、Luminex多因子检测、抗体芯片、PCR Array、ELISA、Elispot、多色免疫组化等30多个,建立起了一套涵盖基因、蛋白、细胞以及组织水平实验的完整检测体系。
我们可提供从样本运输、储存管理、样本制备、样本检测到检测数据分析的全流程服务。凭借严格的实验室管理流程、标准化实验室操作、原始数据储存体系以及实验项目管理系统,已经为超过3000家客户单位提供服务,年检测样本超过100万,受到了广大客户的信任与支持。











 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


