一、流式细胞术的基本概念与技术特点
流式细胞术(Flow Cytometry,FCM)是一种基于流体动力学原理和光学检测技术的细胞分析手段,其名称源自 "Fluid(流体)"、"Cell(细胞)" 与 "Measurement(测量)" 的组合。作为现代细胞生物学研究的核心技术之一,流式细胞术通过自动化仪器对悬浮于液体中的单细胞或生物颗粒进行快速定量分析和分选,能够同时获取单个细胞的多项生物物理和生物化学特征参数。
该技术的核心优势体现在四个方面:一是动态分析特性,实现了在流动状态下对细胞的实时检测;二是高速处理能力,每秒可分析数千至上万个细胞,显著提高实验效率;三是高特异性与灵敏度,通过特异性标记和精密光学系统,可检测低丰度生物分子;四是多参数同步分析,能同时测定单个细胞的多种特征,为细胞群体的精细解析提供可能。这些特性使流式细胞术成为细胞分群、功能分析和表型鉴定的不可或缺的工具。
二、流式细胞术的样本要求与制备规范
流式细胞术对样本质量有严格要求,适用的样本类型广泛,包括各类原代细胞(如外周血、骨髓、穿刺样本、灌洗液等)、实体组织消化后的单细胞悬液、培养细胞系,以及微生物、人工合成微球等非细胞样本,同时也可分析血清、血浆等体液样本中的可溶性成分。
样本制备的关键标准包括:一是单细胞悬液制备,天然单细胞样本可直接使用,实体组织需通过机械研磨或酶消化获得单细胞悬液,避免细胞聚集影响检测;二是浓度控制, optimal 浓度范围为 5×10⁵~1×10⁷cells/ml,体积通常为 0.5~1ml,确保细胞在液流中均匀分布;三是过滤处理,样本使用前需经 300 目筛网过滤,去除杂质和细胞团块,减少检测干扰。规范的样本制备是保证流式分析准确性的基础,直接影响后续数据质量。

三、流式细胞仪的核心组成系统
3.1 液流系统
液流系统是流式细胞仪的基础,其核心元件为流动室(Flow Cell),通常由光学玻璃或石英等透明材料制成,包含样品管、鞘液管和喷嘴等结构。工作时,鞘液从四周包裹样品液形成稳定的层流,使细胞在液流轴线上单个排列通过检测区域,液流速度一般控制在 10m/s 以内以保证稳定性。
流动室的设计需满足激光与细胞的正交激发条件,这是实现高效荧光检测的前提。实验中需严格避免气泡进入,否则会导致细胞偏离轴线,影响信号检测的准确性,通常表现为变异系数(CV 值)增大;同时需定期清洁流动室,防止污染物对激光的反射或散射干扰;上样过程中需避免样品耗尽导致气泡进入,以免造成激光对流动室的灼伤。
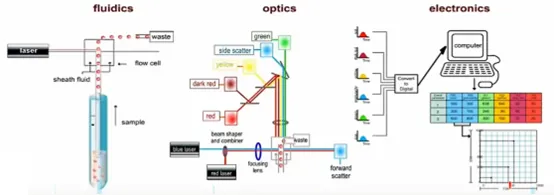
3.2 光学检测系统
光学系统负责信号的产生与收集,主要检测两类信号:散射光信号和荧光信号。散射光信号包括前向角散射光(FSC)和侧向角散射光(SSC),无需荧光标记即可获得细胞物理特征:FSC 反映细胞相对大小,信号强度随细胞体积增大而增强;SSC 反映细胞内部颗粒度和复杂度,与细胞内细胞器数量、胞质颗粒等相关。
在人类外周血分析中,利用 FSC-SSC 散点图可实现白细胞的初步分群:淋巴细胞因体积小、结构简单,位于 FSC 和 SSC 均较低的区域;中性粒细胞体积中等但颗粒丰富,位于两者均较高的区域;单核细胞体积最大但颗粒较少,位于 FSC 高而 SSC 中等的区域;左下角的低信号区域通常为细胞碎片或杂质。这种基于物理特征的分群为后续特异性分析奠定基础。
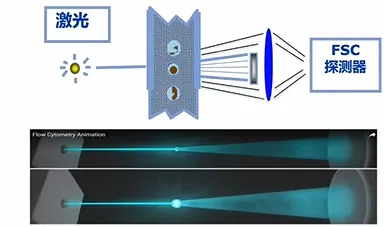
荧光信号检测依赖特异性标记技术,通过将荧光染料偶联到抗体上,利用抗原 - 抗体反应实现细胞表面或内部分子的标记。荧光强度与抗原表达量正相关,可定量反映生物分子的丰度。不同荧光素具有特定的激发和发射光谱,常用激发波长包括 375nm、405nm、488nm 和 633nm,其中 488nm 和 633nm 最为常用。
3.3 数据计算与分析系统
分析系统负责数据的采集、处理与可视化,通过三种主要图形展示结果:流式直方图以单参数分布展示细胞数量与信号强度的关系,x 轴为信号值,y 轴为细胞数,适用于单一指标的定量分析;二维散点图以坐标点表示单个细胞的两个参数特征,可直观展示细胞群体的分布和分群关系,是细胞亚群鉴定的主要工具;等高线图借鉴地理等高线原理,以环线密度表示细胞聚集程度,便于识别细胞群的集中区域。
分析过程中常用 "设门(Gating)" 技术,通过划定特定区域聚焦感兴趣的细胞群体,排除无关细胞干扰。门的设置通常基于 FSC-SSC 物理参数先进行初步分群,再针对目标群体进行特异性标记分析,逐步缩小分析范围,提高结果的准确性。
四、荧光标记策略与染料选择原则
4.1 常用荧光素特性
488nm 激发波长的荧光素包括:异硫氰酸荧光素(FITC),发射黄绿色荧光(525nm),但荧光强度受 pH 影响较大;Alexa Fluor 488 稳定性优于 FITC,在 pH4-10 范围内表现稳定;藻红蛋白(PE)发射橙黄色荧光(575nm),光量子产率高,适合低表达抗原检测;复合染料如 PE-Cy5、PE-Cy7 等通过能量传递扩展检测通道,需注意光谱重叠问题。
633nm激发的荧光素主要有:别藻青蛋白(APC)发射红光(660nm),常与 FITC、PE 组成经典三色组合;Alexa Fluor 647 光稳定性好,是 APC 和 Cy5 的优质替代品;PI 和 7-AAD 常用于细胞活力检测,通过嵌入核酸发射红色荧光,其中 7-AAD 的光谱干扰更小,更适合多色分析。
4.2 荧光素选择原则
荧光素选择需综合考虑仪器配置、抗原表达量、光谱特性等因素:首先需匹配仪器的激光器和探测器;低表达抗原应选择强荧光染料(如 PE),高表达抗原可选用弱荧光染料(如 FITC);优先选择光谱重叠小的组合(如 FITC/APC),减少荧光溢漏;复合染料需注意稳定性,避免与固定剂反应导致信号衰减;对自发荧光强的样本,推荐使用红光激发的长波长荧光素(如 APC)以提高信噪比。
五、流式细胞术的应用价值
流式细胞术凭借其多参数分析能力,在细胞分群和荧光标记检测中发挥核心作用。通过物理参数与荧光标记的结合,可实现免疫细胞亚群的精细分类(如 T 细胞、B 细胞、NK 细胞的鉴定)、细胞活性分析、细胞周期检测及细胞因子分泌等功能研究。在临床诊断中,可用于白血病分型、免疫功能评估等;在基础研究中,为细胞异质性分析、信号通路研究提供强大工具。随着技术发展,流式细胞术正朝着更高参数、更高通量的方向发展,不断拓展在生命科学领域的应用边界。
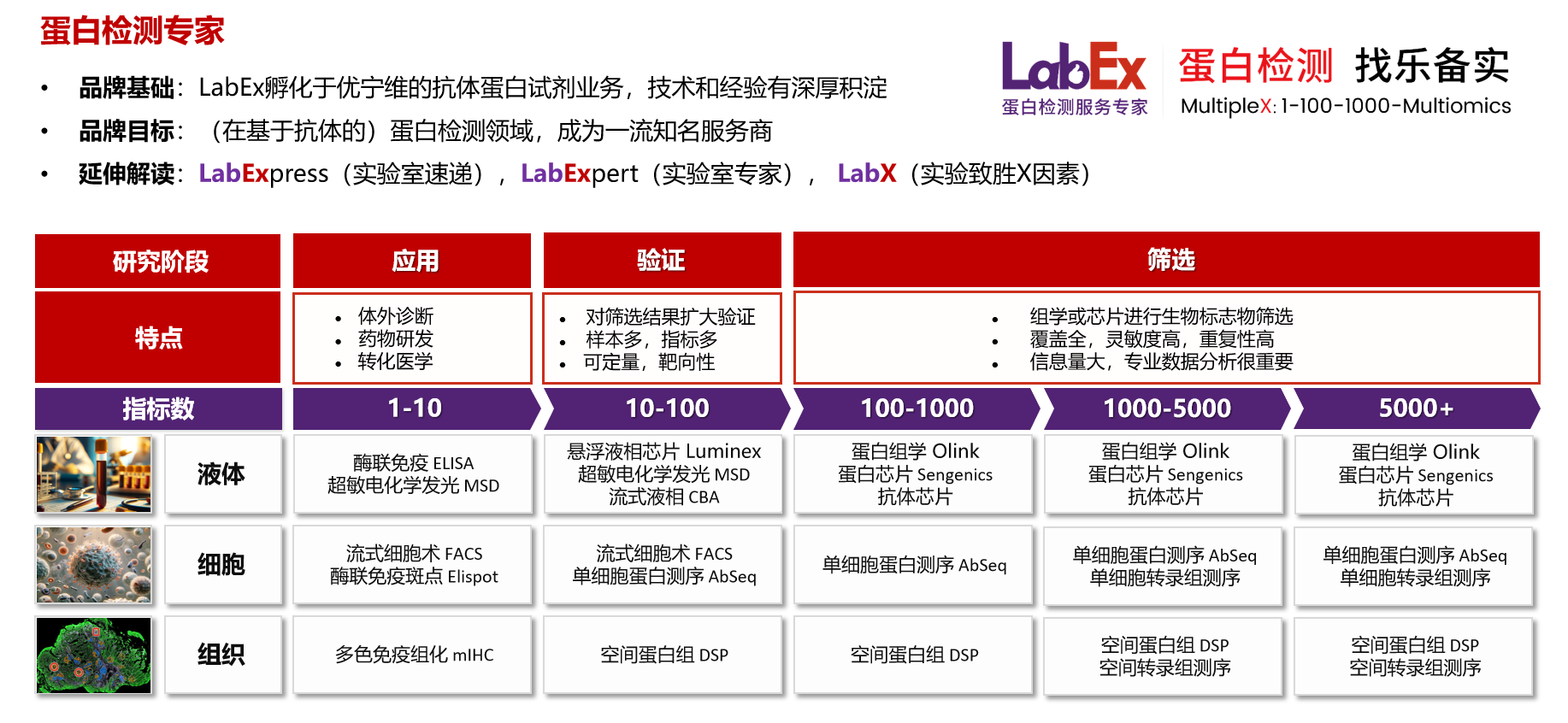
乐备实是国内专注于提供高质量蛋白检测以及组学分析服务的实验服务专家,自2018年成立以来,乐备实不断寻求突破,公司的服务技术平台已扩展到单细胞测序、空间多组学、流式检测、超敏电化学发光、Luminex多因子检测、抗体芯片、PCR Array、ELISA、Elispot、多色免疫组化等30多个,建立起了一套涵盖基因、蛋白、细胞以及组织水平实验的完整检测体系。
我们可提供从样本运输、储存管理、样本制备、样本检测到检测数据分析的全流程服务。凭借严格的实验室管理流程、标准化实验室操作、原始数据储存体系以及实验项目管理系统,已经为超过3000家客户单位提供服务,年检测样本超过100万,受到了广大客户的信任与支持。











 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


