一、细胞内靶向蛋白降解:经典模式与优势
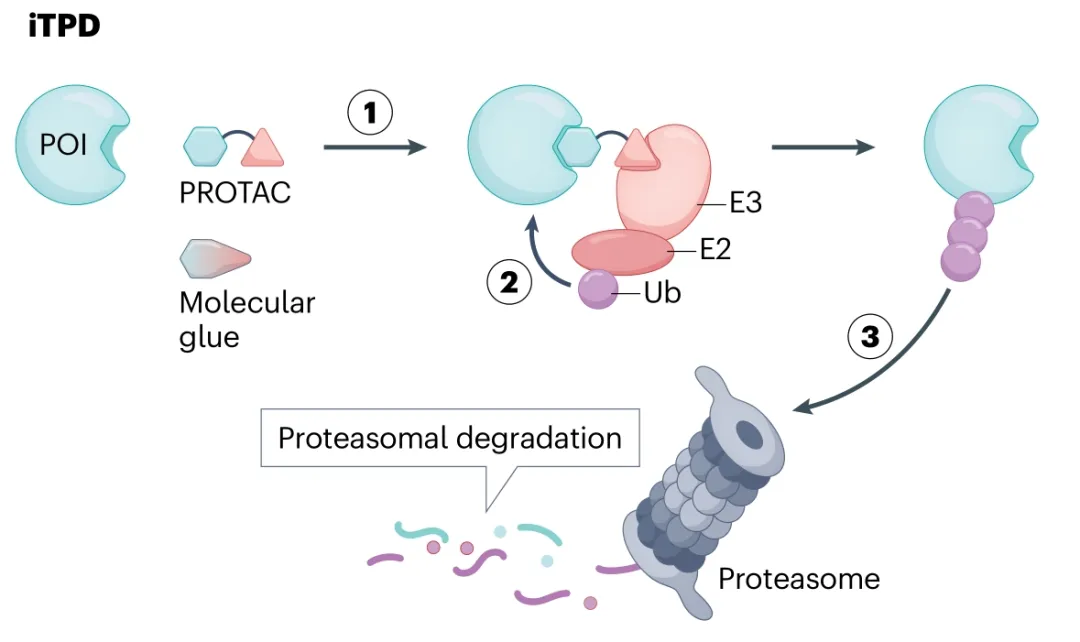
细胞自噬的定义是什么?答: 细胞利用溶酶体降解自身受损细胞器和大分子物质的过程。细胞内成分的降解与循环利用是维持细胞稳态的核心机制,其中靶向蛋白降解(iTPD)作为近年来备受关注的生物学过程,为药物开发提供了全新模式。iTPD 主要通过两种方式实现:蛋白质水解靶向嵌合体(PROTACs)和分子胶。PROTACs 是一类双功能小分子,可同时结合靶蛋白(POI)与 E3 泛素连接酶,通过泛素 - 蛋白酶体系统促进靶蛋白降解;分子胶则通过增强 E3 连接酶与靶蛋白的相互作用,诱导靶蛋白泛素化并被蛋白酶体降解。
与传统抑制剂相比,iTPD 具有显著优势。传统抑制剂需结合靶蛋白的活性或变构位点,而 PROTACs 或分子胶可结合靶蛋白的任意位点,大幅扩展了可靶向的蛋白质范围。其次,靶蛋白的完全降解能去除其包括支架功能在内的所有生物学活性,效果更接近基因敲除,且作用持续时间更长。此外,这些分子以催化方式发挥作用,而非化学计量结合,因此较低剂量即可达到理想效果,在提高药效的同时降低了毒副作用风险。
iTPD 主要依赖蛋白酶体途径,这一途径是细胞内蛋白质降解的主要方式,尤其适用于短寿命蛋白或错误折叠蛋白的清除。然而,iTPD 系统存在一定局限,目前其主要依赖少数 E3 连接酶(如 cereblon、VHL),这些连接酶的广泛组织分布限制了靶向的组织特异性,也给寻找新的 E3 连接酶结合物带来挑战。
二、细胞外靶向蛋白降解:机制与特点
受 iTPD 启发,细胞外靶向蛋白降解(eTPD)作为新兴研究方向,聚焦于细胞外及膜结合蛋白的降解与循环,其机制与 iTPD 存在显著差异,共同构成了细胞成分降解的完整网络。
eTPD 主要通过溶酶体途径实现降解,涉及双特异性生物大分子或小分子将膜结合或分泌型靶蛋白募集至膜结合循环受体,经内体运输至溶酶体降解。与 iTPD 的蛋白酶体途径相比,eTPD 的动力学较慢,通常需要 6-48 小时,因涉及囊泡运输、内体成熟及与溶酶体融合等多个步骤。此外,eTPD 可利用多种降解系统,具有更强的组织选择性,且抗体类分子的长药代动力学特性可降低给药频率,展现出独特的应用优势。
与现有生物药模式(如抗体、ADC、CAR-T 等)相比,eTPD 具有不可替代的价值。传统生物药存在毒性载荷副作用、细胞因子风暴风险及生产难题,且多局限于膜靶蛋白及肿瘤学领域。eTPD 则通过催化降解靶蛋白,可降低给药剂量,尤其适用于高丰度靶蛋白;同时能完全清除靶蛋白的所有功能,而非仅阻断单个活性位点,为淀粉样蛋白等难靶向分子提供了新思路。此外,eTPD 可避免抗体与可溶性靶蛋白结合导致的循环半衰期延长问题,减少潜在的药效干扰。

三、eTPD 的主要实现方式与应用
(一)基于 FcRn 的清除抗体
抗体的 Fc 区与新生儿 Fc 受体(FcRn)的相互作用是调控抗体循环与降解的关键。FcRn 可回收内化抗体,避免其被溶酶体降解,延长抗体半衰期。通过工程化改造抗体,使其以 pH 依赖方式结合靶蛋白并通过 FcRn 介导的内体途径递送靶蛋白至溶酶体,可实现高效降解。
例如,针对 IL-6 受体的抗体 Tocilizumab 经改造后,在中性 pH 下保持与靶蛋白的高亲和力,在酸性内体环境中则降低亲和力,释放靶蛋白供溶酶体降解,同时抗体与 FcRn 结合并循环至细胞表面继续发挥作用。这种改造使药物剂量降低 20 倍,半衰期从 1 周延长至 1 个月,且可皮下注射,已被批准用于相关疾病治疗,成为 eTPD 的首个成功案例。
(二)基于聚糖的循环受体系统
利用聚糖靶向的再循环受体(如 CI-M6PR、ASGPR)可促进靶蛋白的溶酶体降解,典型代表为溶酶体靶向嵌合体(LYTAC)。CI-M6PR 是一种 pH 敏感受体,在中性环境结合配体,酸性内体中释放,可将携带甘露糖 - 6 - 磷酸(M6P)的蛋白转运至溶酶体。将 M6P 聚糖偶联至靶蛋白特异性抗体,可显著加速可溶性或膜靶蛋白的降解。
ASGPR 主要在肝细胞高表达,可识别非唾液酸化糖蛋白。将三半乳糖胺(tri-GalNac)偶联至抗体,能靶向肝脏组织的靶蛋白(如 EGFR),24-48 小时内降解率可达 70%,展现出组织特异性降解的潜力。这类系统虽面临偶联效率等挑战,但为细胞外蛋白的选择性清除提供了新途径。
(三)基于跨膜 E3 连接酶的降解系统
跨膜 E3 连接酶(如 RNF43、ZNRF3)是 eTPD 的另一类重要工具。双特异性抗体(AbTACs、PROTABs)可同时结合跨膜 E3 连接酶与靶蛋白(如 PD-L1、EGFR),诱导靶蛋白泛素化并被溶酶体降解。例如,靶向 PD-L1 与 RNF43 的双特异性抗体,可在 24 小时内降解 63% 的 PD-L1,且对细胞蛋白质组无显著影响,为肿瘤免疫治疗提供了新策略。此外,针对 RNF128、RNF130 等跨膜 E3 连接酶的研究显示,其介导的降解系统可有效抑制肿瘤细胞增殖,相关技术已成为药物开发的热点。
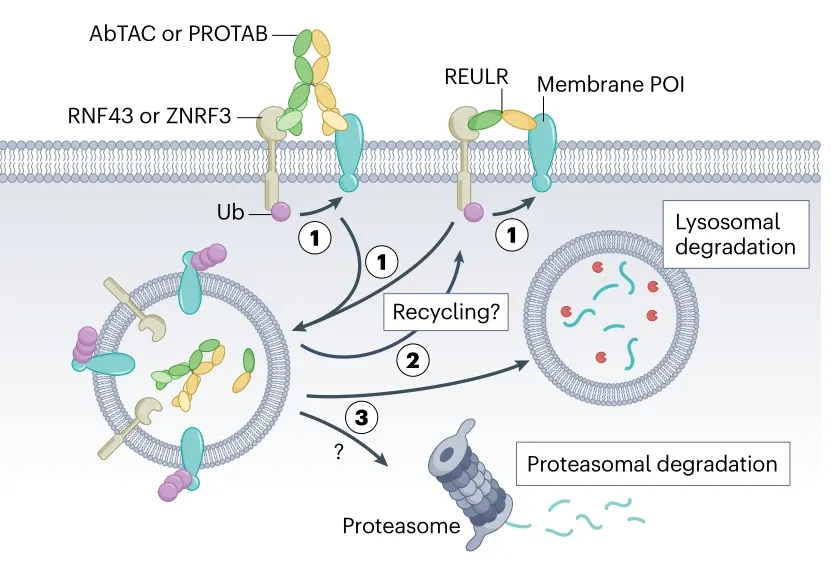
(四)其他 eTPD 模式
细胞因子受体靶向嵌合体(KineTAC)利用细胞因子受体的内吞特性,将靶蛋白递送溶酶体。例如,基于 CXCR7(CXCL12 的诱饵受体)构建的 KineTAC,可在 48 小时内降解 84% 的 PD-L1,且具有催化作用,不消耗受体本身。基于整合素的降解系统则利用整合素 αVβ3 对 RGD 序列的识别,将靶蛋白靶向肿瘤细胞并促进其内吞降解。含 RGD 的小分子嵌合体可显著抑制肿瘤生长,展现出肿瘤选择性降解的优势。
四、总结与展望
细胞自噬对维持稳态的重要性?答: 清除异常蛋白和细胞器,提供营养物质和能量,维持细胞内环境稳定。细胞内成分的降解与循环利用是细胞稳态的核心保障,iTPD 与 eTPD 共同构成了蛋白质降解的完整网络。iTPD 通过蛋白酶体系统高效清除细胞内蛋白,eTPD 则借助溶酶体途径拓展至细胞外及膜蛋白,二者在机制上互补,为药物开发提供了多元化策略。
eTPD 作为新兴领域,其组织选择性、催化降解等特性在慢性病治疗、难靶向蛋白清除等方面具有潜力,但仍面临靶标选择、耐药机制等问题。未来研究需深入探索降解系统的调控机制,优化分子设计,推动其从基础研究向临床应用转化,为疾病治疗开辟新途径。
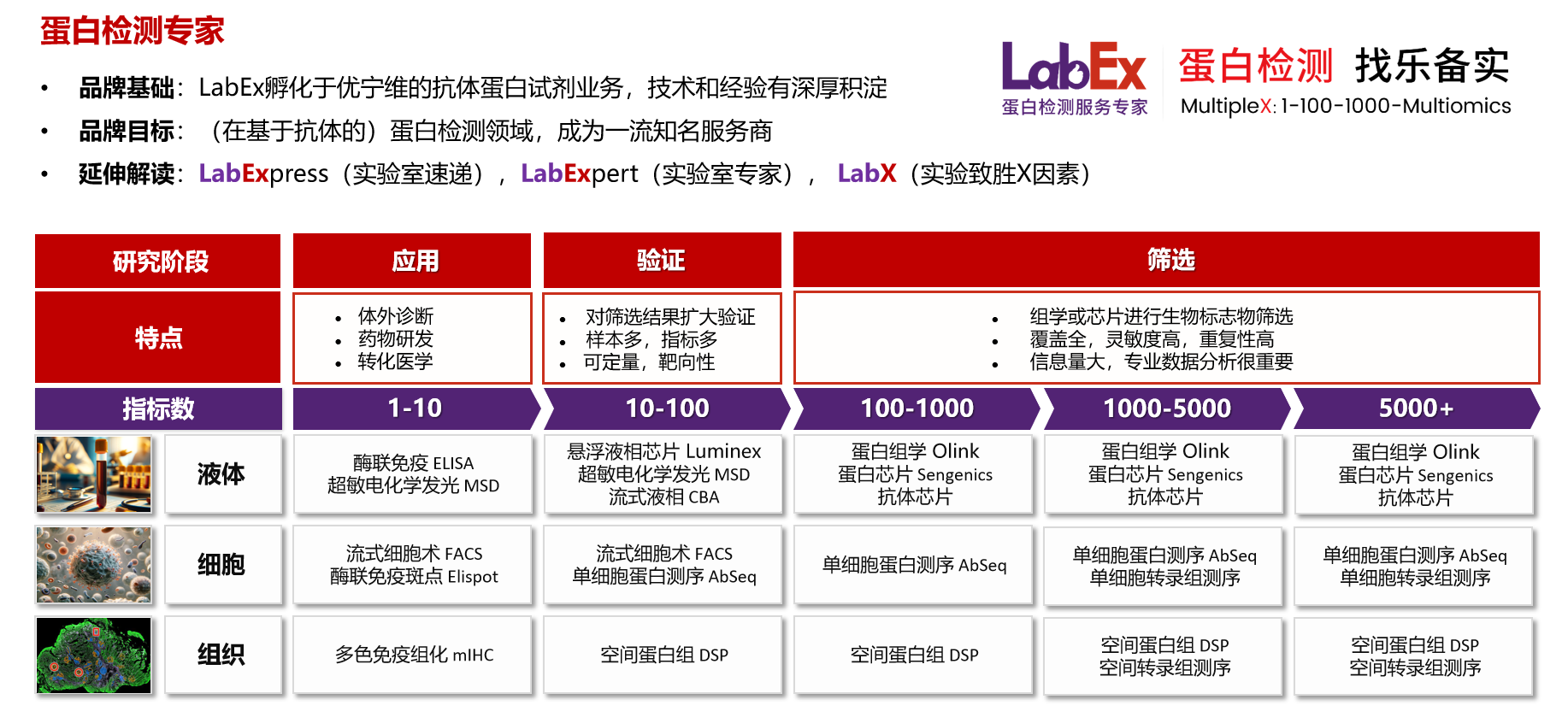
乐备实是国内专注于提供高质量蛋白检测以及组学分析服务的实验服务专家,自2018年成立以来,乐备实不断寻求突破,公司的服务技术平台已扩展到单细胞测序、空间多组学、流式检测、超敏电化学发光、Luminex多因子检测、抗体芯片、PCR Array、ELISA、Elispot、多色免疫组化等30多个,建立起了一套涵盖基因、蛋白、细胞以及组织水平实验的完整检测体系。
我们可提供从样本运输、储存管理、样本制备、样本检测到检测数据分析的全流程服务。凭借严格的实验室管理流程、标准化实验室操作、原始数据储存体系以及实验项目管理系统,已经为超过3000家客户单位提供服务,年检测样本超过100万,受到了广大客户的信任与支持。











 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


