细胞分选的定义与重要性
常见细胞分选方法概述
流式细胞分选
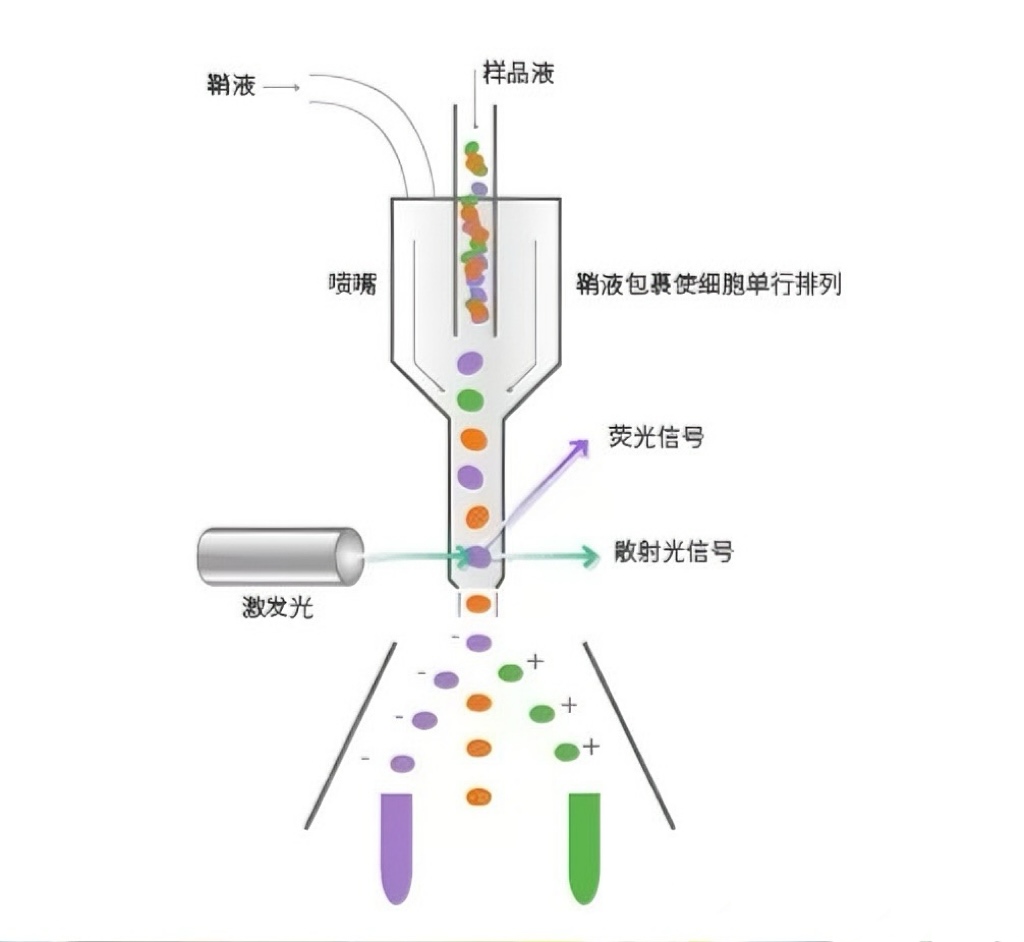
(一)技术原理
流式细胞分选技术原理:基于细胞荧光和物理特性进行高速分选。流式细胞分选在流式细胞术检测细胞表型基础上,借助充电分选技术分离多种特定表型细胞。分选型流式细胞仪由液流、光路、检测分析和分选系统组成。其分选依赖鞘液流形成的带电液滴:流动室喷嘴的高速振荡器以每秒几万次频率使鞘液流分裂为液滴,细胞进入液滴前已被测定,符合分选特性的细胞形成液滴时,液柱被充以指定电荷(带荧光素的带负电,未标记的带正电,无细胞的不带电)。带电液流经高压电场偏转板时,依电荷性质偏转入对应收集管,未带电液滴入废液槽,完成分选。
(二)技术优势
(三)应用领域
免疫磁性细胞分选
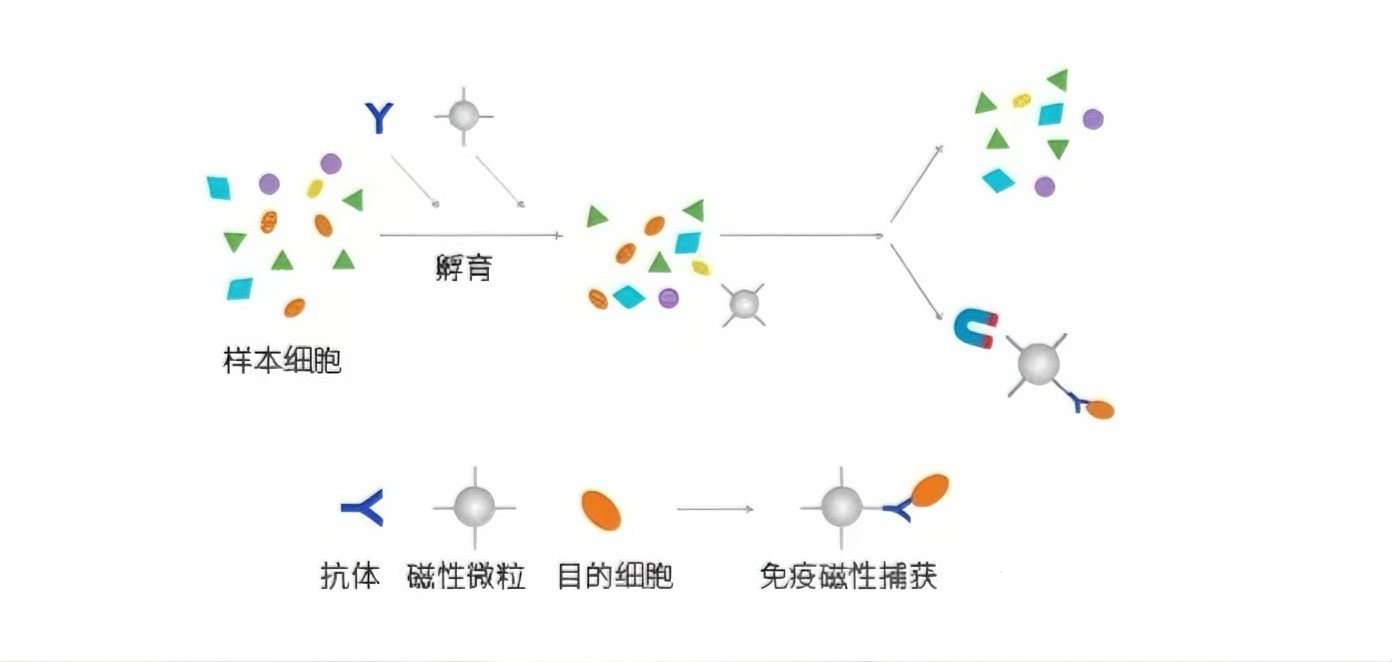
(一)技术原理
(二)技术优势
(三)分选策略
按标记细胞不同,分阳性、阴性和复合分选。阳性分选是将特异性抗体连磁珠后与混合细胞孵育,磁分离获取目的细胞;阴性分选通过去除非目的细胞得到目的细胞,但靶细胞比例低时易因非特异性吸附损失;复合分选联合多种策略,如先阴选去杂再阳选获目的细胞,用于细胞亚群或高纯度稀有细胞分选。
按分选方法不同,分直接和间接分选。直接分选将抗体包被磁珠形成复合颗粒,与细胞孵育后,带磁珠的目的细胞在磁场中滞留;间接分选先让细胞与一抗孵育,清洗后加包被二抗的磁珠,借助抗原抗体作用使磁珠结合目的细胞,磁场中滞留实现分选。
细胞分选方法的选择
流式细胞分选的注意事项
乐备实是国内专注于提供高质量蛋白检测以及组学分析服务的实验服务专家,自2018年成立以来,乐备实不断寻求突破,公司的服务技术平台已扩展到单细胞测序、空间多组学、流式检测、超敏电化学发光、Luminex多因子检测、抗体芯片、PCR Array、ELISA、Elispot、多色免疫组化等30多个,建立起了一套涵盖基因、蛋白、细胞以及组织水平实验的完整检测体系。
我们可提供从样本运输、储存管理、样本制备、样本检测到检测数据分析的全流程服务。凭借严格的实验室管理流程、标准化实验室操作、原始数据储存体系以及实验项目管理系统,已经为超过3000家客户单位提供服务,年检测样本超过100万,受到了广大客户的信任与支持。











 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


