单细胞蛋白测序技术的进步为解析免疫细胞异质性提供了有力工具,AbSeq(寡核苷酸偶联抗体)技术凭借同时检测单细胞基因表达与蛋白标志物的能力,成为连接转录组与蛋白质组的关键桥梁。在自身免疫性疾病治疗研究中,低剂量白细胞介素 - 2(IL-2)通过选择性激活调节性 T 细胞(Treg)发挥作用,AbSeq 技术为揭示其分子机制提供了多维度视角。本文以 1 型糖尿病(T1D)的低剂量 IL-2 治疗研究为例,阐述 AbSeq 技术在免疫细胞亚群鉴定、功能分析及治疗响应评估中的应用价值。
一、AbSeq 技术原理与单细胞多组学分析平台
AbSeq 技术基于寡核苷酸标记抗体与高通量测序的联合应用,实现单细胞蛋白质表达的精准量化。其核心原理是将特异性抗体与独特序列的寡核苷酸标签共价偶联,通过抗体与细胞表面蛋白的特异性结合,将蛋白质表达信息转化为可测序的核酸信号;结合单细胞转录组测序技术,可同时获取单个细胞的 mRNA 表达谱与蛋白质标志物信息,构建 “基因 - 蛋白” 关联的多维图谱。AbSeq单细胞蛋白测序技术原理与应用: 利用抗体-DNA条形码,在单细胞水平精准量化蛋白质。
BD Rhapsody™单细胞多组学分析平台整合了 AbSeq 技术与靶向转录组测序能力,通过微流控芯片实现单细胞捕获,利用 barcode 技术区分不同细胞来源,经高通量测序同时产出转录组数据与蛋白标志物数据。这种整合分析克服了传统流式细胞术检测参数有限的缺陷,能通过转录组与蛋白组的关联分析,揭示基因表达与蛋白质水平的调控关系,为解析细胞功能状态提供全面依据。
与传统蛋白质检测技术相比,AbSeq 技术优势显著:一是高通量,可同时检测数百种蛋白质标志物,远超流式细胞术的检测通道限制;二是高特异性,通过抗体 - 抗原结合与寡核苷酸序列双重验证,降低非特异性信号干扰;三是可追溯性,测序数据的数字化特征便于长期存储与二次分析,且能与其他组学数据整合。这些特性使其适合复杂免疫细胞群体的深度解析,尤其在疾病治疗中细胞亚群动态变化研究中价值独特。
二、AbSeq 技术在低剂量 IL-2 治疗 T1D 研究中的应用
(一)研究背景与实验设计
1 型糖尿病作为自身免疫性疾病,发病机制与 Treg 细胞功能缺陷导致的免疫耐受失衡密切相关。低剂量 IL-2 可选择性激活高表达三聚体 IL-2 受体的 Treg 细胞,恢复免疫平衡,在临床前研究中显示出潜在价值。为深入解析其作用机制,牛津大学研究团队采用间隔低剂量 IL-2(iLD-IL-2)给药方案,对 13 例长期 T1D 患者进行治疗,利用 BD Rhapsody™平台结合 AbSeq 技术,对治疗前(Day 0)、治疗末期(Day 27)及治疗后 4 周(Day 55)三个时间点的外周血免疫细胞进行单细胞多组学分析,共获得 482,531 个未刺激细胞和 323,839 个刺激细胞的测序数据,为解析治疗过程中免疫细胞动态变化提供了海量数据基础。
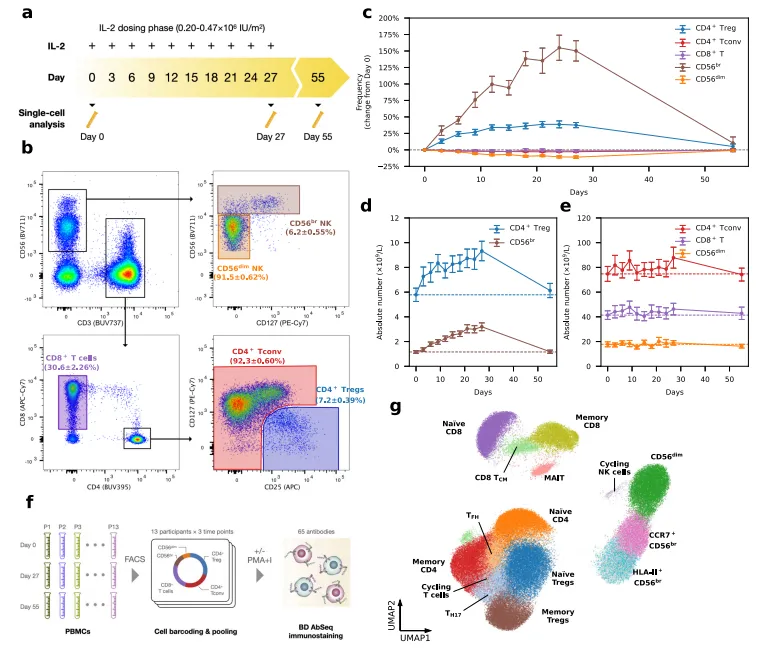
(二)免疫细胞亚群的精准鉴定与动态追踪
通过 AbSeq 技术对细胞表面标志物(如 CD4、CD25、CD127、CD56 等)的检测,结合转录组数据的聚类分析,研究团队成功鉴定出 15 个不同的免疫细胞亚群,包括 CD4+ T 细胞、CD8+ T 细胞、NK 细胞等主要群体及其亚型,为后续分析奠定基础。
动态变化分析中,AbSeq 技术的蛋白检测结果显示:iLD-IL-2 给药显著增加了 CD4+CD127lowCD25hi Treg 细胞的比例,这一变化在治疗末期(Day 27)最显著,并可持续至治疗后 4 周(Day 55);同时,CD56bright NK 细胞亚群也呈现相似动态变化,而传统 CD4+ T 细胞、CD8+ T 细胞及 CD56dim NK 细胞比例无明显改变。该发现通过转录组数据中 Treg 特征基因(如 FOXP3、IKZF2)的表达变化得到验证,证实了 iLD-IL-2 对特定免疫细胞亚群的选择性激活作用。
AbSeq 技术的多参数分析能力揭示了 Treg 细胞亚群的内部异质性:治疗后增加的 Treg 细胞主要为 FOXP3+HELIOS + 未成熟亚群,比例较基线提升约 2 倍,而效应性 Treg 亚群(HLA-II+)比例无显著变化。拟时序分析显示,这些未成熟 Treg 细胞源于胸腺来源的前体群体,且 iLD-IL-2 主要促进其存活而非分化,这一发现为理解 Treg 细胞池的动态更新机制提供了新视角,该深度解析依赖于蛋白标志物与转录组数据的联合分析,是传统技术难以实现的。
(三)促炎细胞亚群的抑制与抗炎基因表达特征
AbSeq 技术揭示了 iLD-IL-2 对促炎细胞亚群的调控作用。通过对 IL-21+ T 细胞的追踪(结合 IL-21 蛋白检测与转录组中 IL21 基因表达),研究发现:治疗后产生 IL-21 的滤泡辅助性 T 细胞(TFH)亚群比例显著降低,尤其是 CXCR5 + 记忆性 T 细胞和 CD25+ IL-21+ TFH 早期亚群减少最明显。IL-21 作为促炎细胞因子,在 T1D 发病中参与胰岛 β 细胞损伤过程,其产生细胞的减少为 iLD-IL-2 的治疗效果提供了直接证据。
基因表达层面,AbSeq 技术结合转录组数据的关联分析显示:治疗后多个抗炎相关基因(如 CISH,细胞因子信号抑制因子)表达上调,而促炎基因(如 AREG,分泌型 TNF 诱导蛋白)表达下调,且这些变化主要富集在 CD4+CD127lowCD25hi Treg 和 CD56bright NK 细胞中。重要的是,这种抗炎基因表达特征在治疗后 4 周仍持续存在,提示 iLD-IL-2 可能诱导了持久的免疫表型重塑。
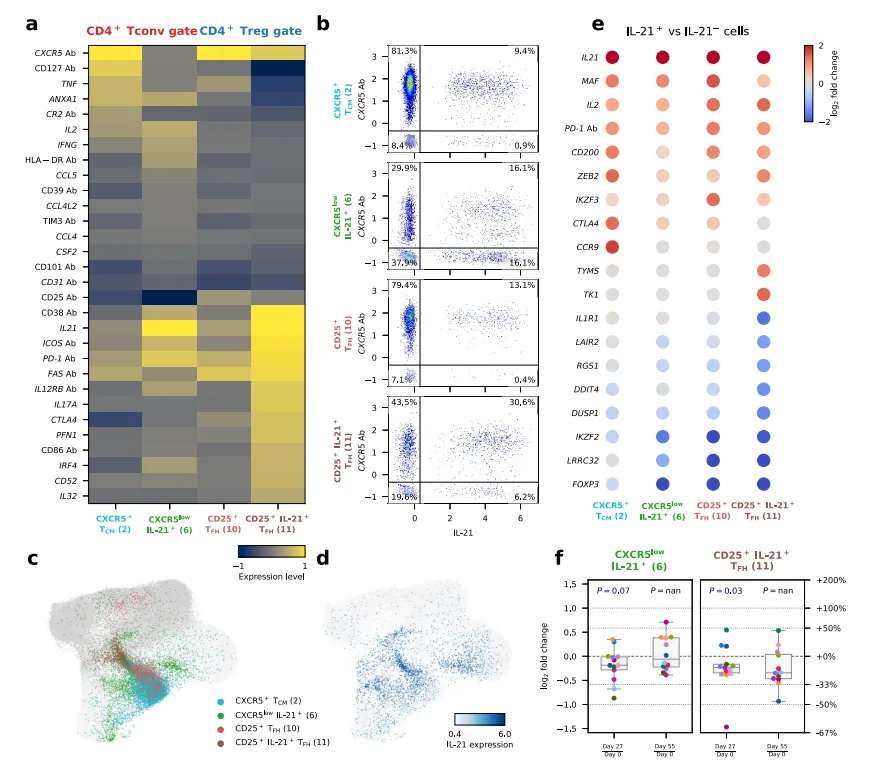
三、AbSeq 技术的应用价值与未来展望
在低剂量 IL-2 治疗 T1D 的研究中,AbSeq 技术展现出三大核心价值:一是实现免疫细胞亚群的高精度分型,克服传统方法对细胞异质性解析不足的缺陷;二是通过 “蛋白 - 基因” 联合分析,明确细胞表型变化与功能状态的关联,为解析治疗机制提供多维度证据;三是捕捉治疗过程中动态细微的细胞变化,为评估治疗响应与优化给药方案提供精准指标。
未来,AbSeq 技术在免疫治疗研究中的应用将更广泛:基础研究层面,可解析疾病发生发展中免疫细胞的分化轨迹与功能异质性;临床转化层面,有望成为评估治疗效果的生物标志物发现工具,助力个性化治疗方案制定;技术整合层面,与空间转录组、表观基因组等技术结合,将进一步拓展对免疫微环境的整体认知。AbSeq揭示疾病细胞特异性蛋白标记物: 为精准医疗与靶向治疗提供关键分子表型信息。
该技术也面临挑战:检测成本较高,限制大规模临床样本应用;抗体 panel 设计依赖已知标志物,可能遗漏未知亚群;数据分析复杂性要求跨学科专业知识支持。随着技术迭代与成本降低,AbSeq 技术有望在免疫相关疾病的研究与临床实践中发挥更大作用,为精准免疫治疗提供有力技术支撑。
乐备实是国内专注于提供高质量蛋白检测以及组学分析服务的实验服务专家,自2018年成立以来,乐备实不断寻求突破,公司的服务技术平台已扩展到单细胞测序、空间多组学、流式检测、超敏电化学发光、Luminex多因子检测、抗体芯片、PCR Array、ELISA、Elispot、多色免疫组化等30多个,建立起了一套涵盖基因、蛋白、细胞以及组织水平实验的完整检测体系。
我们可提供从样本运输、储存管理、样本制备、样本检测到检测数据分析的全流程服务。凭借严格的实验室管理流程、标准化实验室操作、原始数据储存体系以及实验项目管理系统,已经为超过3000家客户单位提供服务,年检测样本超过100万,受到了广大客户的信任与支持。











 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


