一、铁死亡的定义与特征
铁死亡是 2012 年被正式命名的铁依赖型程序性细胞死亡方式,以脂质过氧化累积为核心特征,区别于凋亡、坏死性凋亡等其他细胞死亡形式。形态学上,铁死亡细胞的典型标志集中于线粒体:体积缩小、膜密度增加、嵴结构减少或消失,甚至外膜破裂;而细胞膜保持完整,细胞核形态正常,无染色质凝聚现象,这与凋亡(染色质浓缩、核碎裂)和坏死性凋亡(细胞膜早期破裂)形成显著差异。生化层面,铁死亡的核心是多不饱和脂肪酸(PUFA)组成的磷脂发生过氧化,其产物破坏细胞膜功能,最终导致细胞死亡。该过程严格依赖游离 Fe²⁺,Fe²⁺通过芬顿反应催化过氧化氢生成羟自由基,加速脂质过氧化。生理功能上,铁死亡参与肿瘤抑制(清除异常增殖细胞)、神经退行性疾病(如阿尔茨海默病中神经元损伤)等多种病理生理过程,是当前医学研究的重要靶点。细胞程序性死亡的意义:维持内环境稳定与机体发育的关键过程。
二、铁死亡的关键调控机制
(一)铁稳态的调控
细胞外 Fe³⁺与转铁蛋白结合后,通过转铁蛋白受体(TfR1)介导的内吞作用进入细胞。在细胞内体中,STEAP3 将 Fe³⁺还原为 Fe²⁺并释放至胞质,为后续代谢或铁死亡提供底物。
胞内多余 Fe²⁺被铁蛋白(由 FTH1 和 FTL 组成)以 Fe³⁺形式储存。当细胞需铁时,核受体共激活因子 4(NCOA4)介导铁蛋白自噬,通过溶酶体降解铁蛋白释放 Fe²⁺,促进铁死亡发生。
铁转运蛋白 1(FPN1)是唯一已知的细胞铁外排蛋白,其活性受铁调素调控。铁调素与 FPN1 结合可诱导其降解,抑制铁外排导致胞内铁积累,间接促进铁死亡。
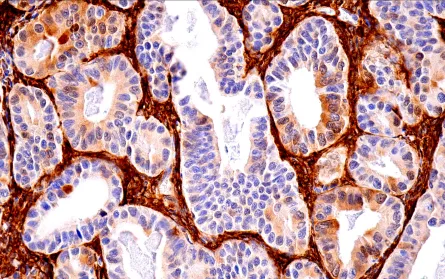
(二)氧化应激防御系统的作用
GPX4 利用 GSH 将脂质过氧化物还原为无毒产物,阻断过氧化链式反应。抑制 GPX4(如 RSL3 处理)可直接诱导铁死亡,而增强其活性则显著抑制该过程。
GSH 合成依赖半胱氨酸,后者主要通过 system Xc⁻(由 SLC7A11 和 SLC3A2 组成)转运胞外胱氨酸进入细胞并还原生成。抑制 system Xc⁻(如 erastin 处理)会导致 GSH 合成不足,间接抑制 GPX4 活性,诱发铁死亡。
转录因子 NRF2 通过激活 GPX4、SLC7A11 等靶基因增强抗氧化能力。生理状态下,KEAP1 促进 NRF2 降解;氧化应激时,KEAP1 构象改变释放 NRF2,启动抗氧化基因转录。自噬受体 p62 可竞争性结合 KEAP1,进一步激活 NRF2,形成协同调控网络。
(三)脂质代谢的重塑
脂酰辅酶 A 合成酶 4(ACSL4)催化 PUFA 与辅酶 A 结合,形成脂酰辅酶 A,为磷脂合成提供原料。ACSL4 高表达会增加膜上 PUFA 磷脂含量,提高细胞对铁死亡的敏感性;反之则抑制该过程。
溶血磷脂酰胆碱酰基转移酶(LPCAT)将 PUFA 整合至磷脂,形成易被氧化的脂质分子。脂氧合酶(LOX)作为非血红素铁依赖酶,可直接催化 PUFA 双键加氧生成氢过氧化物,加速铁死亡进程。
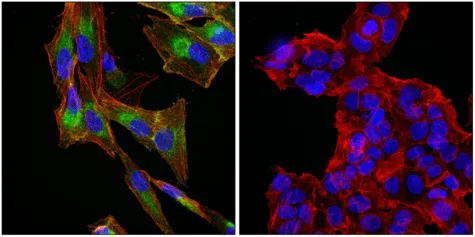
三、铁死亡的研究方法
形态学检测:透射电镜观察线粒体结构变化;荧光显微镜通过线粒体探针监测形态动态。
生化指标分析:C11-BODIPY 探针检测脂质过氧化;硫代巴比妥酸法测定丙二醛含量;4 - 羟基壬烯醛染色评估氧化程度。
铁稳态检测:calcein-AM 探针评估游离铁水平;免疫印迹检测铁蛋白(FTH1/FTL)表达;共定位分析 NCOA4 与 FTH1 评估铁蛋白自噬活性。
氧化代谢检测:比色法测定 GPX4 活性;Ellman 试剂检测 GSH 含量;同位素标记法评估 system Xc⁻功能。
药理学工具:erastin、RSL3 诱导铁死亡;ferrostatin-1、去铁胺抑制该过程,用于机制验证。
结语
乐备实是国内专注于提供高质量蛋白检测以及组学分析服务的实验服务专家,自2018年成立以来,乐备实不断寻求突破,公司的服务技术平台已扩展到单细胞测序、空间多组学、流式检测、超敏电化学发光、Luminex多因子检测、抗体芯片、PCR Array、ELISA、Elispot、多色免疫组化等30多个,建立起了一套涵盖基因、蛋白、细胞以及组织水平实验的完整检测体系。
我们可提供从样本运输、储存管理、样本制备、样本检测到检测数据分析的全流程服务。凭借严格的实验室管理流程、标准化实验室操作、原始数据储存体系以及实验项目管理系统,已经为超过3000家客户单位提供服务,年检测样本超过100万,受到了广大客户的信任与支持。











 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


