一、引言
二、Luminex 技术的原理与核心优势
(一)技术原理
荧光编码微球:采用两种荧光染料按比例混合形成 100 种独特编码微球,每种微球包被特异性抗体,可识别特定靶分子;
三明治免疫反应:样本与微球孵育后,靶分子与抗体结合,再加入荧光标记的检测抗体形成复合物(如图);
双激光检测:一束激光识别微球编码(确定检测指标),另一束激光定量荧光信号(反映靶分子浓度),实现单一样本中多指标同步分析。
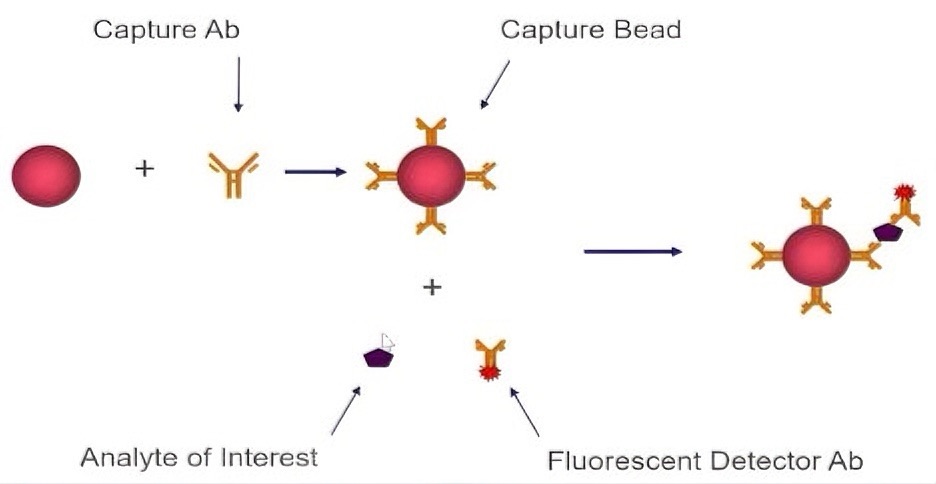
(二)技术优势
高通量多参数分析:单一样本(25-50μL)可同时检测 100 种分析物,满足 CAR-T 研究中细胞因子、表面标志物等多指标联合分析需求;
高灵敏度与宽动态范围:检测下限达 pg 级,动态范围覆盖 4-5 个数量级,可同时量化高低丰度分子;
样本兼容性强:适用于细胞培养液、血清等多种样本类型,尤其适合体外扩增中少量样本的检测;
良好重复性:自动化流程确保批内 / 批间变异系数 < 10%,结果可靠性高。
三、在 CAR-T 细胞制备过程中的应用
(一)T 细胞分选的质量控制
分选后 T 细胞纯度(通常需 > 85%);
记忆性 T 细胞亚群(如 CD45RA⁺CD62L⁺中央记忆 T 细胞)比例,这类细胞因增殖能力强、持久性好,是 CAR-T 的理想来源。
通过多参数分析可优化分选方案,为后续基因修饰提供优质细胞原料。
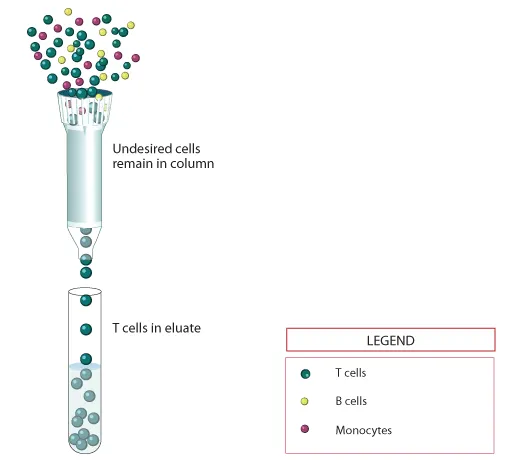
T细胞富集柱
(二)激活与扩增的动态监测
促增殖因子(IL-2、IL-7、IL-15):反映 T 细胞增殖潜力;
效应因子(IFN-γ、TNF-α):指示细胞毒性功能;
免疫调节因子(IL-10、TGF-β):预警过度抑制或耗竭。
动态监测这些因子的浓度变化,可优化激活剂组合与培养时间,避免 T 细胞功能异常。
(三)基因修饰效率的评估
CAR 蛋白表达水平(针对胞外标签的特异性抗体);
编辑相关标志物(如脱靶效应导致的炎症因子异常分泌),评估修饰的特异性与安全性。
对靶向敲除 PD-1 等免疫检查点的 CAR-T 细胞,可同步验证编辑效果。
四、在信号通路解析与实体瘤研究中的价值
(一)CAR 与 TCR 信号通路的差异分析
CAR 与 TCR 激活后细胞因子分泌的异同(如 IL-2、IFN-γ 的分泌动力学);
共刺激结构域(4-1BB vs CD28)对信号通路的影响,为 CAR 结构优化提供依据。
(二)肿瘤微环境的复杂性解析
免疫抑制因子(TGF-β、IL-10、VEGF)浓度;
免疫检查点分子(PD-L1、CTLA-4)表达水平;
基质细胞分泌的趋化因子(IL-6、CXCL12),揭示其对 CAR-T 浸润、存活的抑制机制。
这些数据为开发联合疗法(如 CAR-T 与 PD-1 抑制剂联用)提供靶点依据。

CAR-T细胞在肿瘤微环境中面临内源性和外源性代谢挑战
五、与其他技术的比较及应用前景
(一)技术互补性
悬浮液相芯片 Luminex 与 ELISA 比较
相较于ELISA,其多重检测能力更强,效率更高且节省样本。
较流式细胞术(擅长细胞表型),更适合可溶性因子的多参数分析;
与蛋白质芯片相比,具有更高灵敏度和更广动态范围。
Luminex 与上述技术形成互补,满足 CAR-T 研究中 “少量样本 - 多指标” 的检测需求。
(二)应用前景
临床前研究:加速 CAR-T 候选疗法的功能筛选与优化;
临床监测:通过外周血分析预测治疗应答与不良反应(如细胞因子释放综合征);
联合疗法开发:解析 CAR-T 与放化疗、靶向药联用的免疫微环境变化。
六、总结











 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


