引言
细胞代谢是生命活动的核心支撑,对癌细胞的无限增殖与免疫细胞的功能活化而言,精准的代谢重编程是其适应微环境的关键。在肿瘤微环境(TME)中,癌细胞凭借 “Warburg 效应”(有氧条件下优先糖酵解)主导代谢资源分配,导致微环境缺氧、酸性增强且关键营养耗尽,形成抑制免疫细胞的 “代谢屏障”。免疫疗法(如免疫检查点抑制剂、CAR-T)虽已成为肿瘤治疗支柱,但 TME 的代谢紊乱常使其疗效受限。2020 年 Jonathan D. Powell 教授团队在《Nat Rev Cancer》的综述,系统揭示了癌细胞与免疫细胞的代谢相互作用,为通过代谢干预增强免疫疗效提供了理论基础。本文围绕 “细胞代谢” 核心,解析 TME 中的代谢博弈机制及干预策略。细胞代谢的核心原理,其核心原理是通过分解代谢释放能量,再通过合成代谢利用这些能量构建细胞组分。这两个过程相辅相成,共同维持着细胞的能量与物质平衡,是生命得以延续的根本机制。
一、TME 的代谢失衡:癌细胞主导的 “生存战场”
TME 的代谢稳态被癌细胞彻底打破,形成不利于免疫细胞的 “代谢荒漠”,而不同免疫细胞的代谢偏好进一步加剧了微环境复杂性。
1.1 癌细胞重塑 TME 代谢特征
癌细胞通过 “Warburg 效应” 满足高合成需求:大量摄取葡萄糖后,90% 经有氧糖酵解生成乳酸,仅 10% 进入三羧酸(TCA)循环,导致 TME pH 降至 6.0-6.5(正常组织约 7.2-7.4);同时高表达 GLUT1/3 等转运体,与免疫细胞争夺葡萄糖,使 TME 葡萄糖浓度低至 0.1-0.5 mM(正常组织 5-7 mM)。此外,癌细胞高氧消耗与紊乱脉管系统引发缺氧(氧分压 < 2%),缺氧通过 HIF-1α 进一步上调糖酵解酶(如 HK2、LDHA),形成 “缺氧 - 糖酵解 - 酸性” 恶性循环。癌细胞还会产生腺苷、犬尿氨酸等毒性代谢物,蓄积后直接抑制免疫细胞功能(图 1,反映 TME 中代谢异常)。
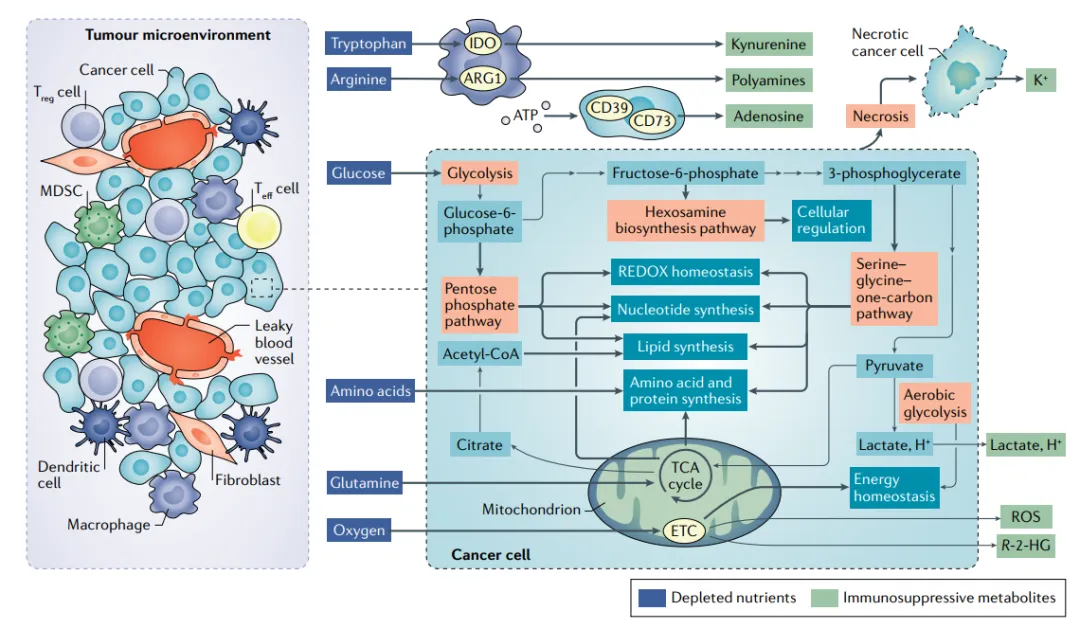
图1 TME中的癌细胞代谢和异常
1.2 TME 细胞组成的代谢需求差异
TME 细胞的代谢偏好决定其生存能力:效应免疫细胞(CD4 + 常规 T 细胞、CD8+Teff、NK 细胞)活化后依赖有氧糖酵解与谷氨酰胺分解,需大量葡萄糖与氨基酸;免疫抑制细胞(Treg、MDSC、M2 型 TAM)优先依赖氧化磷酸化(OXPHOS)与脂肪酸 β- 氧化(FAO),在低葡萄糖、高乳酸环境中更具适应性;抗原呈递细胞(DC)成熟需从 OXPHOS 转向有氧糖酵解,葡萄糖缺乏会抑制其抗原提呈功能。
二、抗肿瘤免疫细胞的代谢机制:功能依赖的 “能量策略”
抗肿瘤免疫细胞的活化、分化与功能,均依赖精准的代谢重编程,TME 代谢紊乱会直接破坏这一平衡。
2.1 效应 T 细胞的葡萄糖代谢
CD4 + 常规 T 细胞与 CD8+Teff 活化后 6 小时内快速上调有氧糖酵解,24 小时内激活 TCA 循环与磷酸戊糖途径(PPP),由 MYC 与 HIF-1α 调控:有氧糖酵解快速生成 ATP 与乳酸,支持增殖;PPP 生成 NADPH(维持 redox 稳态)与 5 - 磷酸核糖(核苷酸合成原料);己糖胺生物合成途径(HBP)生成 UDP - 葡萄糖胺,参与 TCR 等蛋白糖基化;TCA 循环中间体(如柠檬酸)转运至细胞质生成乙酰辅酶 A,用于细胞膜脂质合成。
2.2 葡萄糖受限对 T 细胞的抑制
TME 葡萄糖缺乏会抑制 Teff 细胞 PEP 生成,阻断钙依赖性 NFAT 信号,减少 IL-2、IFN-γ 产生;同时降低 mTORC1 活性,抑制 Teff 分化并促进 Treg 生成。卵巢癌细胞条件培养基中的葡萄糖限制还会通过 microRNA 抑制 EZH2,减少 NOTCH 信号,降低 Teff 活力。此外,肿瘤浸润 CD8+T 细胞线粒体质量降低、ROS 升高,补充丙酮酸或 ROS 清除剂可部分恢复功能,提示线粒体损伤是 T 细胞耗竭的重要原因(图 2,反映代谢紊乱对 T 细胞的抑制)。
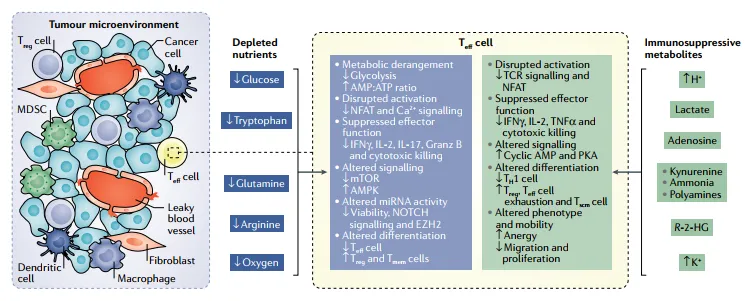
图2 TME中的代谢紊乱抑制T细胞功能
2.3 氨基酸代谢的调控作用
氨基酸代谢紊乱直接影响免疫功能:亮氨酸通过 SLC7A5 激活 mTORC1,调控 Teff 分化;TME 中 MDSC、TAM 通过 ARG1 消耗精氨酸,抑制 T 细胞增殖;IDO1 将色氨酸代谢为犬尿氨酸,既导致色氨酸缺乏,又上调 Teff 细胞 PD-1 表达;谷氨酰胺经 GLS/GLUD1 生成 αKG 进入 TCA 循环,其受限会促进 Teff 向记忆 T 细胞(Tmem)分化,由 αKG 介导的表观遗传重塑调控。
2.4 毒性代谢物的免疫抑制
TME 中的乳酸、腺苷、犬尿氨酸等通过多种机制抑制免疫细胞:乳酸与酸性 pH 抑制 Teff 细胞 NFAT 与 MAPK 通路;腺苷结合 A2A/A2B 受体,降低 Teff 增殖与 NK 细胞毒性;犬尿氨酸上调 Teff 细胞 PD-1,减少 IFN-γ 产生(图 2)。
三、癌症免疫逃逸的代谢基础:抑制性细胞的 “代谢优势”
癌细胞通过塑造 TME 代谢,为免疫抑制细胞提供 “优势”,同时抑制效应细胞,实现免疫逃逸。细胞代谢与疾病关联,代谢紊乱与众多疾病密切相关,如癌症细胞的瓦博格效应(Warburg Effect)、糖尿病、肥胖症及神经退行性疾病等。因此,研究细胞代谢与疾病关联已成为开发新型诊疗策略的关键突破口。
3.1 Treg 细胞的代谢适应性
Treg 优先依赖 OXPHOS 与 FAO,转录因子 FOXP3 通过抑制 MYC,促进其在低葡萄糖、高乳酸环境中存活,且对乳酸不敏感,甚至可通过乳酸增强抑制功能。缺氧通过 HIF-1α 上调 Treg 趋化因子受体(如 CCR5),促进其向肿瘤迁移,腺苷 - A2A 信号还可增强 Treg 增殖与活性。
3.2 M2 型 TAM 与 MDSC 的代谢特征
M2 型 TAM 依赖 OXPHOS 与 FAO,高表达 ARG1 消耗精氨酸生成免疫抑制多胺,乳酸可促进其极化;MDSC 有氧糖酵解与 OXPHOS 均上调,2-DG(糖酵解抑制剂)可通过增加 ROS 抑制其扩增,减弱免疫抑制。
3.3 免疫检查点与代谢的交互
免疫检查点与代谢双向调控:癌细胞 PD-L1 激活 Akt-mTOR 通路,上调糖酵解以争夺葡萄糖;T 细胞 PD-1 信号抑制有氧糖酵解与 mTORC1,导致功能耗竭。而抗 PD-1 等检查点抑制剂可恢复 T 细胞葡萄糖摄取与糖酵解,改善功能。
四、代谢干预的策略与展望
基于代谢差异,可通过三类策略增强免疫疗效(图 3,反映代谢干预靶点):靶向肿瘤代谢(如抑制 HK2),减少 TME 酸性与毒性代谢物;靶向抑制性细胞代谢(如抑制 Treg 的 FAO),减弱免疫抑制;在 CAR-T 制备中体外代谢重编程(如抑制糖酵解),促进 Tmem 生成,增强体内持久性。
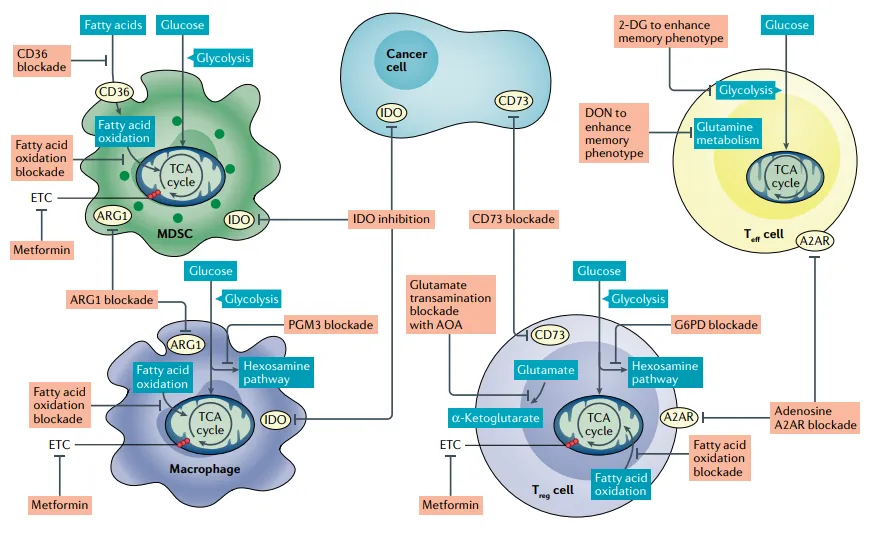
图3 增强癌症免疫反应的潜在代谢靶点
临床前研究显示,ACAT1 抑制剂可增强 CD8+T 细胞 TCR 信号,培美曲塞与抗 PD-L1 联合可增强 T 细胞代谢适应性。未来,随着免疫代谢机制的深入解析,代谢干预与免疫疗法的联合有望突破疗效瓶颈,为肿瘤治疗提供新方向。
乐备实是国内专注于提供高质量蛋白检测以及组学分析服务的实验服务专家,自2018年成立以来,乐备实不断寻求突破,公司的服务技术平台已扩展到单细胞测序、空间多组学、流式检测、超敏电化学发光、Luminex多因子检测、抗体芯片、PCR Array、ELISA、Elispot、PLA蛋白互作、多色免疫组化、DSP空间多组学等30多个,建立起了一套涵盖基因、蛋白、细胞以及组织水平实验的完整检测体系。
我们可提供从样本运输、储存管理、样本制备、样本检测到检测数据分析的全流程服务。凭借严格的实验室管理流程、标准化实验室操作、原始数据储存体系以及实验项目管理系统,已经为超过3000家客户单位提供服务,年检测样本超过100万,受到了广大客户的信任与支持。











 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


