引言
结直肠腺瘤(CRA)是结直肠癌(CRC)最主要的癌前病变,超过 80% 的 CRC 由 CRA 恶性转化而来,因此 CRA 的早期风险分层对 CRC 预防至关重要。传统研究依赖大块组织蛋白组学,难以区分肿瘤微环境中不同细胞或区域的分子差异,无法捕捉 CRA 进展的空间特异性变化。而临床样本多以福尔马林固定 - 石蜡包埋(FFPE)形式长期保存,对检测技术的灵敏度与精准度提出极高要求。
近年来,空间蛋白组学技术(结合激光捕获显微切割 LCM、高分辨率影像与超高灵敏度质谱)实现突破,可在细胞级分辨率下同步获取蛋白表达的空间定位与定量信息,完美适配 FFPE 样本研究。蛋白质组学领军者 Matthias Mann 团队此前已用该技术绘制小鼠脑组织、人类心脏斑块的空间分子图谱,近日其在 medRxiv 发表的最新研究,进一步将空间蛋白组学用于 CRA 风险分层,为临床转化提供关键范式。空间蛋白组学指在保留原始组织空间位置信息的前提下,对组织中所有蛋白质进行鉴定、定量和功能分析的技术。它揭示了细胞在原生微环境中的蛋白表达异质性和细胞间相互作用。
一、空间蛋白组学:解析临床样本的核心技术体系
空间蛋白组学的核心优势在于 “空间定位” 与 “高深度定量” 的结合,其技术框架专为临床 FFPE 样本设计:
首先通过免疫组化(IHC)标记特定细胞类型(如上皮细胞标志物 CDX2),结合宽视场成像与机器学习分割模型,精准识别目标细胞群;再用 LCM 在显微镜下切割收集微量目标细胞(约 100 个细胞量级),最大程度保留空间结构,避免非目标细胞干扰;最后通过超高灵敏度质谱(如 DIA、PRM 技术),对微量蛋白进行定量分析,即使保存超 10 年的 FFPE 样本,仍能稳定鉴定数千种蛋白。Mann 团队此前开发的 DISCO-MS 技术,还可直接分析完整器官组织块,进一步拓展了应用场景。空间蛋白组学原理其核心原理通常基于激光捕获显微切割或高通量多重荧光成像。后者通过使用带有DNA条形码的抗体,与目标蛋白结合后逐轮成像,再将图像叠加解卷积,最终绘制出蛋白在组织原位的精确分布图。
二、CRA 空间蛋白组学研究:严谨的队列与技术设计
Mann 团队以 “CRA 复发风险分层” 为目标,构建临床导向的研究设计:
1. 样本队列:按临床结局精准分组
研究纳入 9 例保存超 11 年的高级别(HG)不典型增生 CRA FFPE 样本,均经形态学与 IHC 确诊为 HG CRA,结合最长 10 年的临床随访分为三组:C 组(3 例,1 年内确诊异时性 CRC,高癌变风险)、HAD 组(3 例,复发 HG 腺瘤,中度风险)、NMN 组(3 例,10 年无新病变,低风险)。该队列通过临床结局反向筛选,确保分子标志物与实际复发风险直接关联。
2. 技术流程:双模式构建蛋白组数据库
研究采用 “大块组织 + 空间蛋白组学” 双模式(图 1):先刮取未染色 FFPE 组织做大块分析,获取整体蛋白轮廓;再用结直肠上皮特异性标志物 CDX2(兼具肿瘤调控与免疫调节功能)进行 IHC 染色,结合机器学习将细胞分为 CDX2++(高表达上皮细胞)、CDX2+(低表达上皮细胞)、CDX2-(间质细胞)三类;最后用 LCM 对每类细胞切割 1000 个形态单位(重复 3 次,约 100 个完整细胞),经超高灵敏度质谱检测,构建覆盖大块组织与数百个空间微区的 CRA 蛋白组数据集。

图1 基于LCM的空间蛋白组学技术流程
三、关键发现:空间蛋白组学揭示 CRA 异质性与标志物
1. 单样本空间分析:定位代谢重编程的区域特异性
研究先以 1 例 “进展为 CRC 的 CRA 样本” 探索异质性,基于 CDX2 染色与形态选取三个关键区域(图 2):区域 1(紫色,高度异型增生区)、区域 2(黄色,低度异型增生区)、区域 3(绿色,正常腺体伴淋巴细胞浸润区)。
通过 LCM - 质谱,每个区域平均鉴定 3433 个独特蛋白,对比 CDX2++ 上皮细胞与 CDX2 - 间质细胞,发现 1324 个差异蛋白。聚焦 CDX2++ 细胞,高度异型区相较于正常区有 70 个蛋白显著差异:糖酵解相关蛋白上调,线粒体氧化磷酸化蛋白下调—— 这是对 “Warburg 效应” 的原位、细胞特异性验证,且明确该代谢转变仅发生在 “高度异型区的 CDX2++ 上皮细胞”,而非整个腺瘤,揭示 CRA 代谢重编程的空间局限性。
通过 LCM - 质谱,每个区域平均鉴定 3433 个独特蛋白,对比 CDX2++ 上皮细胞与 CDX2 - 间质细胞,发现 1324 个差异蛋白。聚焦 CDX2++ 细胞,高度异型区相较于正常区有 70 个蛋白显著差异:糖酵解相关蛋白上调,线粒体氧化磷酸化蛋白下调—— 这是对 “Warburg 效应” 的原位、细胞特异性验证,且明确该代谢转变仅发生在 “高度异型区的 CDX2++ 上皮细胞”,而非整个腺瘤,揭示 CRA 代谢重编程的空间局限性。
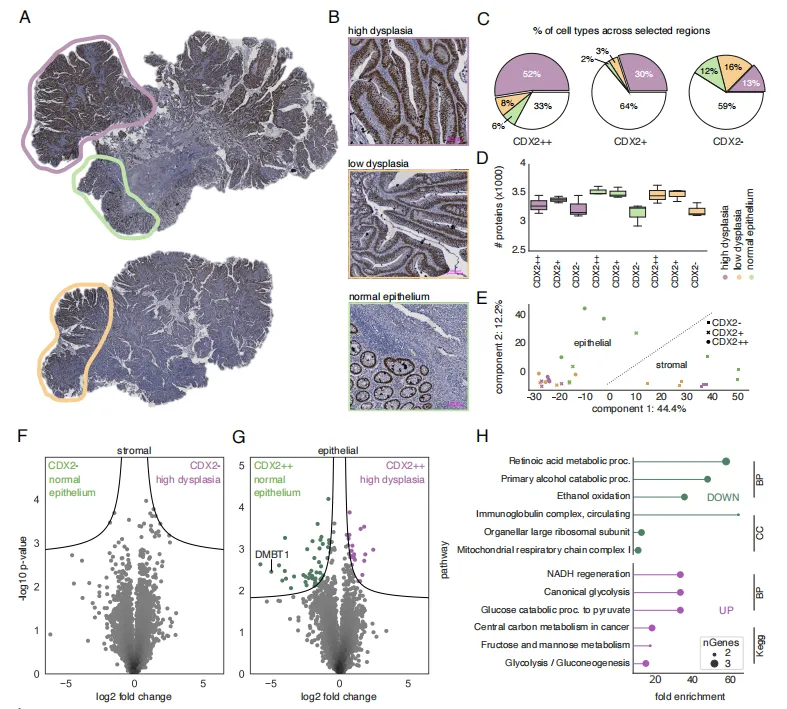
图2 空间蛋白组学表征强异质性CRA样本中区域特异性代谢变化
2. 多样本标志物筛选:锁定复发风险分子
针对 9 例样本的 CDX2++ 细胞(最能反映腺瘤 - 癌转化),研究定量超 4200 个独特蛋白,对 244 个差异蛋白进行无监督聚类,最终锁定 3 个复发风险相关标志物(图 3):
DMBT1 在高风险 C 组显著下调,低风险 NMN 组与中度风险 HAD 组高表达,差异幅度超传统标志物 CDX2;CD99 与 MARCKS 在 C 组、HAD 组(高 / 中度风险)高表达,NMN 组(低风险)显著降低。IHC 验证显示,三者表达模式与质谱结果完全一致,且与 CRA 恶性进展趋势(C 组 > HAD 组 > NMN 组)高度吻合,证实其作为风险分层标志物的潜力。
DMBT1 在高风险 C 组显著下调,低风险 NMN 组与中度风险 HAD 组高表达,差异幅度超传统标志物 CDX2;CD99 与 MARCKS 在 C 组、HAD 组(高 / 中度风险)高表达,NMN 组(低风险)显著降低。IHC 验证显示,三者表达模式与质谱结果完全一致,且与 CRA 恶性进展趋势(C 组 > HAD 组 > NMN 组)高度吻合,证实其作为风险分层标志物的潜力。
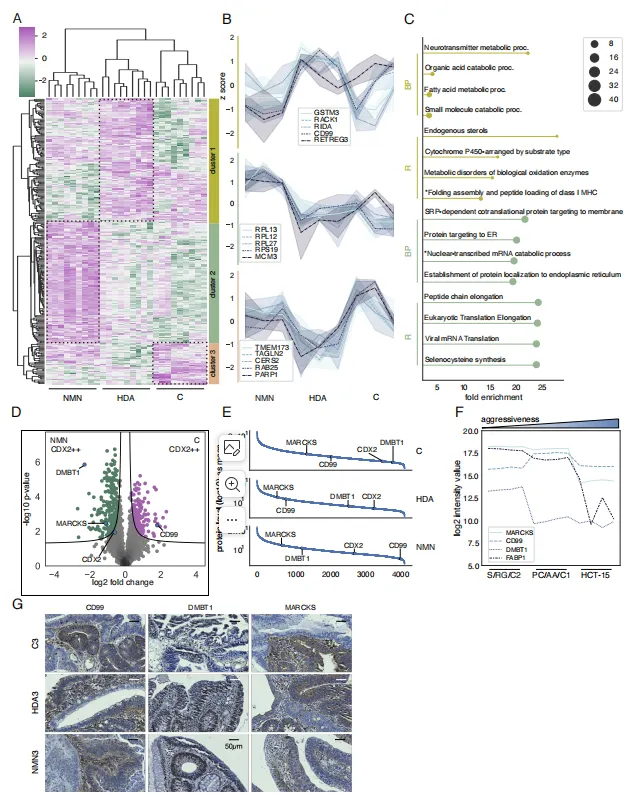
图3 CDX2++细胞揭示结直肠腺瘤患者分层的潜在生物标志物
四、技术价值与展望
该研究充分体现空间蛋白组学的独特价值:精准解析 CRA 的细胞与区域异质性,避免传统大块分析的 “平均化误差”;首次在 FFPE 样本中定位 CRA 代谢重编程的空间特异性;筛选的 DMBT1、MARCKS、CD99 为 CRA 风险分层提供潜在标志物,助力临床个性化管理。
未来,空间蛋白组学可进一步用于胃腺瘤、乳腺不典型增生等癌前病变研究,指导靶向药物递送与治疗响应评估,为肿瘤精准医学搭建 “分子机制 - 空间定位 - 临床应用” 的桥梁,推动 CRC 预防与诊疗进入更高分辨率时代。
乐备实是国内专注于提供高质量蛋白检测以及组学分析服务的实验服务专家,自2018年成立以来,乐备实不断寻求突破,公司的服务技术平台已扩展到单细胞测序、空间多组学、流式检测、超敏电化学发光、Luminex多因子检测、抗体芯片、PCR Array、ELISA、Elispot、PLA蛋白互作、多色免疫组化、DSP空间多组学等30多个,建立起了一套涵盖基因、蛋白、细胞以及组织水平实验的完整检测体系。
我们可提供从样本运输、储存管理、样本制备、样本检测到检测数据分析的全流程服务。凭借严格的实验室管理流程、标准化实验室操作、原始数据储存体系以及实验项目管理系统,已经为超过3000家客户单位提供服务,年检测样本超过100万,受到了广大客户的信任与支持。











 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


