引言
程序性细胞死亡(PCD)在机体免疫防御及炎症调控中发挥核心作用。炎症程序中细胞死亡通路的交叉对话机制: 炎症反应中,多种程序性细胞死亡方式(如焦亡、凋亡、坏死性凋亡)并非孤立发生,而是存在复杂的交互作用。这种“交叉对话”使免疫系统能够灵活调整细胞死亡方式,从而精准调控炎症强度与持续时间,对宿主防御及自身免疫疾病的发生至关重要。多项研究表明,不同炎症小体配体可特异性激活对应的传感器分子(如NLRP3、AIM2、NLRC4和Pyrin),从而启动下游信号通路。然而,这些通路是否能够协同作用,共同调控一类新型细胞死亡方式——PANoptosis,仍是当前研究的焦点。
一、多种炎症小体配体协同激活诱导复合细胞死亡表型
已有研究证实,单一炎症小体配体(如LPS+ATP、poly(dA:dT)、flagellin或TcdB)可特异性激活相应传感器分子,并主要引发以GSDMD介导的焦亡为主的细胞死亡。焦亡依赖caspase-1的激活及GSDMD孔道形成,导致细胞肿胀、膜破裂及IL-1β等促炎因子释放。然而,最新实验证据表明,当使用多种配体组合(Cocktail)同时刺激时,可显著增强细胞死亡水平和IL-1β释放,且该效应呈时间依赖性。进一步分子表征显示,联合配体处理不仅激活典型的焦亡相关分子(caspase-1、GSDMD和GSDME),还引起凋亡标志分子(caspase-8、caspase-3、caspase-7)的切割及坏死关键调控蛋白MLKL的磷酸化。这一发现提示,多种PAMP/DAMP的共同存在可协同诱发焦亡、凋亡和坏死等多重死亡程序,即PANoptosis。
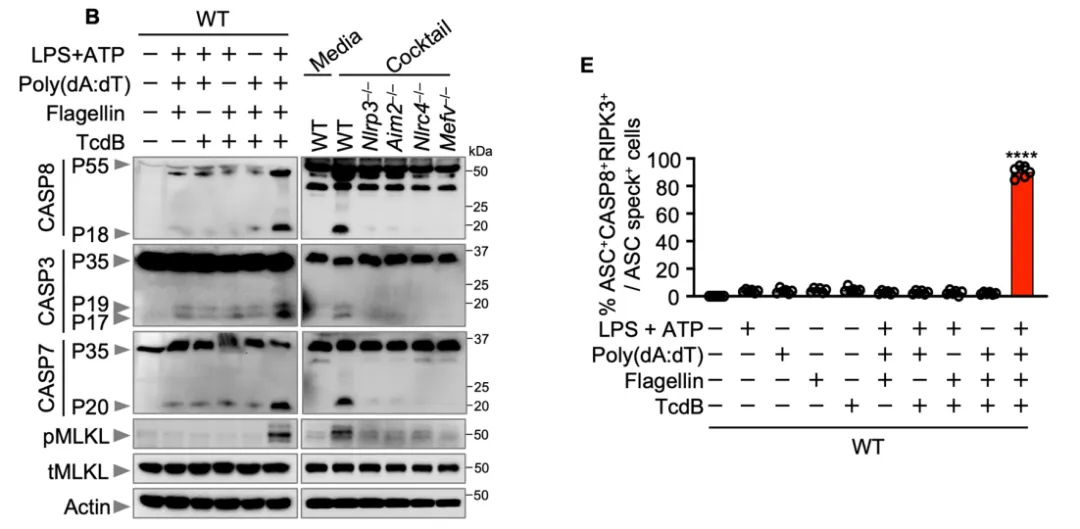
二、多炎症小体传感器与细胞死亡调节因子形成功能复合物
为阐明不同炎症小体在协同激活中的分子机制,研究者聚焦于传感器蛋白(NLRP3、AIM2、NLRC4、Pyrin)与接头蛋白ASC之间的相互作用。实验发现,在联合配体存在下,内源性ASC可与上述四种传感器蛋白、caspase-8及RIPK3发生免疫共沉淀,且这些分子在ASC斑点结构中发生共定位。而在单一配体刺激下,未观察到该多蛋白复合物的形成。
基因敲除实验进一步证实,缺失任一炎症小体传感器均削弱caspase-8与RIPK3的招募及活化,说明该复合物的组装依赖于多种传感器的共同参与。这一机制在病原体共感染模型(如IAV与HSV1合并感染)中也得到验证,进一步支持了多种危险信号可协同诱导炎症小体复合物的形成。
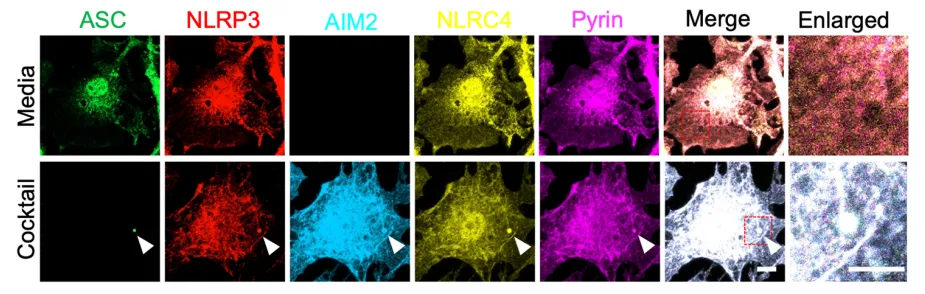
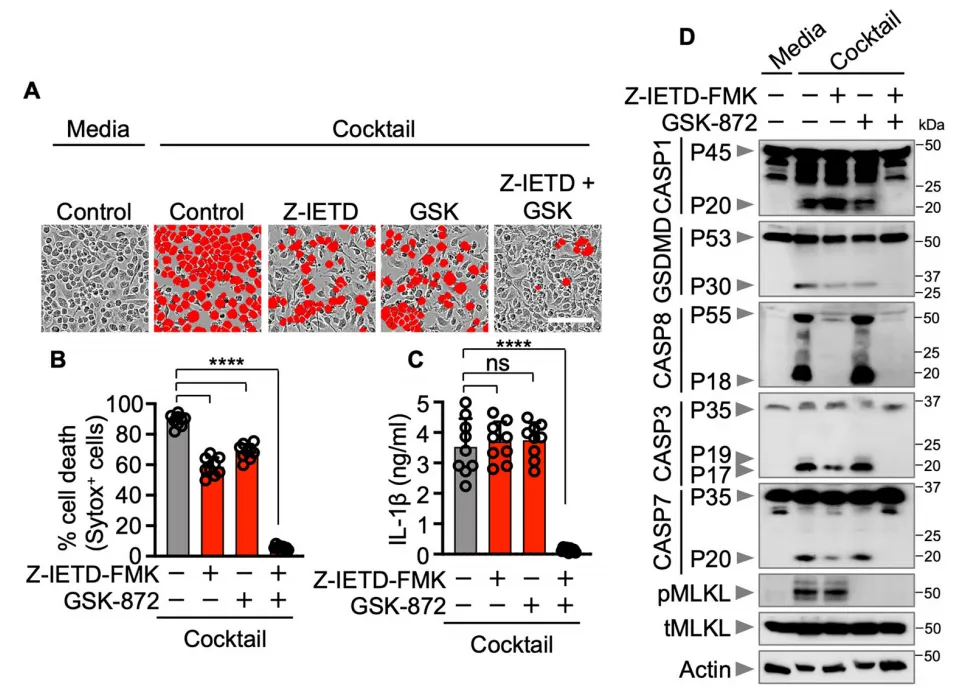
三、Caspase-8–RIPK3轴是调控PANoptosis的核心分子开关
为明确caspase-8与RIPK3在多重细胞死亡中的功能,研究者运用特异性抑制剂及基因缺失模型进行验证。结果表明,抑制caspase-8或RIPK3活性可显著减弱联合配体诱导的细胞死亡、IL-1β释放及各死亡通路关键分子的活化。在Ripk3–/–Casp8–/–双敲细胞中,PANoptosis表型被完全消除。
共定位分析显示,caspase-8与RIPK3在多蛋白复合物中与ASC斑点紧密结合,且该过程不依赖于caspase-1的酶活,但需pro-caspase-1的参与。这些结果确立了caspase-8–RIPK3分子轴作为整合多重死亡信号、触发PANoptosis的核心枢纽。
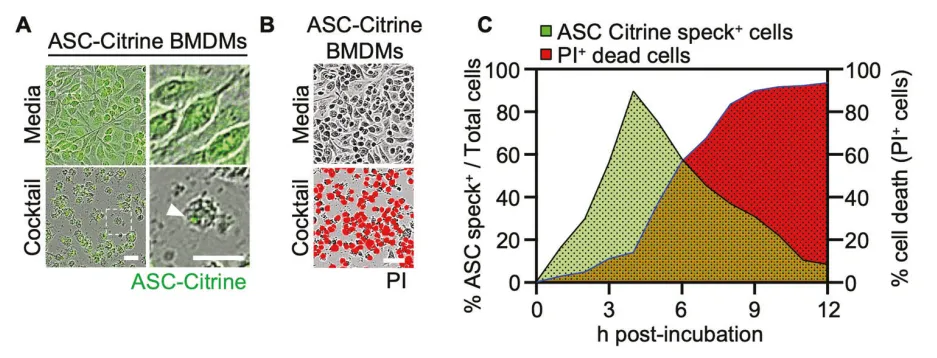
四、细胞外ASC斑点的释放与免疫放大效应
活细胞成像显示,ASC斑点的形成与细胞膜完整性丧失高度同步,表明其与细胞死亡密切关联。进一步研究发现,该多蛋白复合物可被释放至胞外空间。通过梯度离心可从培养基中分离出含ASC、NLRP3、AIM2、NLRC4及Pyrin的细胞外颗粒。更为重要的是,这些释放的ASC斑点可被周围巨噬细胞吞噬,并引发强烈的IL-1β释放及炎症细胞浸润。动物实验中,鼻内给予外源性ASC斑点可引起显著的体重下降及肺部炎症,该表型在Casp1–/–小鼠或经caspase-8及RIPK3抑制剂联合处理的野生型小鼠中明显缓解,说明该过程依赖caspase-1及caspase-8–RIPK3通路。
五、总结与展望
本研究系统揭示了多种炎症小体信号协同激活条件下的新型细胞死亡调控机制。不同传感器蛋白可组装为包含ASC、caspase-1、caspase-8和RIPK3的多蛋白复合物,从而同时启动焦亡、凋亡和坏死程序,即PANoptosis。该过程不仅扩大了细胞死亡的类型和强度,还通过释放胞外ASC斑点介导了免疫信号的放大与传播,在感染与炎症性疾病中可能发挥关键作用。
多组学与时空动态解析揭示细胞死亡网络: 结合单细胞测序、活细胞成像及空间转录组等新技术,能够在时间和空间尺度上解析炎症性细胞死亡的动态过程与异质性。这将深化我们对免疫微环境中不同细胞死亡方式互作关系的理解,为干预炎症相关疾病提供全新视角和靶点。未来研究应致力于解析该多蛋白复合物的精确组装顺序和空间结构,并探索其在自身炎症性疾病、慢性感染及肿瘤免疫中的潜在作用。针对PANoptosis关键节点(如caspase-8–RIPK3轴)的干预策略,可能为多种炎症性疾病提供新的治疗思路。
乐备实是国内专注于提供高质量蛋白检测以及组学分析服务的实验服务专家,自2018年成立以来,乐备实不断寻求突破,公司的服务技术平台已扩展到单细胞测序、空间多组学、流式检测、超敏电化学发光、Luminex多因子检测、抗体芯片、PCR Array、ELISA、Elispot、多色免疫组化等30多个,建立起了一套涵盖基因、蛋白、细胞以及组织水平实验的完整检测体系。
我们可提供从样本运输、储存管理、样本制备、样本检测到检测数据分析的全流程服务。凭借严格的实验室管理流程、标准化实验室操作、原始数据储存体系以及实验项目管理系统,已经为超过3000家客户单位提供服务,年检测样本超过100万,受到了广大客户的信任与支持。












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


