一、蛋白质合成与分选信号系统
蛋白质在细胞内的定向运输过程高度依赖于其自身携带的分选信号和细胞器的精密协作。核糖体作为蛋白质合成的场所,分为游离型和膜结合型,分别负责合成不同去向的蛋白质。细胞通过识别蛋白质的分选信号,将其准确地靶向至特定部位。分选信号主要包括信号肽和信号斑两类:信号肽是位于肽链N端的一段氨基酸序列,可被信号识别颗粒(SRP)识别,引导蛋白质进入内质网,并在完成运输后被切除;信号斑则是通过三维折叠形成的空间结构,作为永久性分选信号发挥作用。此外,某些蛋白质还通过翻译后修饰获得分选信号,如溶酶体酶上的甘露糖-6-磷酸标记。
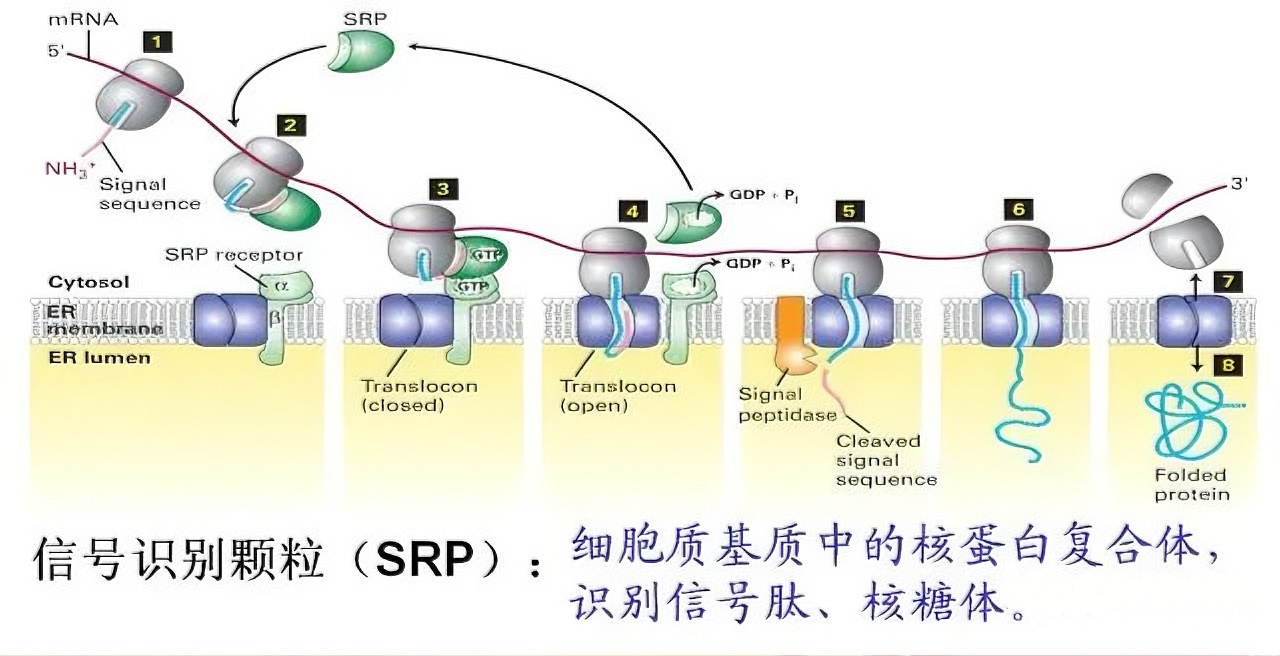
二、蛋白质运输的两大途径:共翻译与翻译后转运
蛋白质的运输途径可分为共翻译转运和翻译后转运。共翻译转运发生在内质网附着的核糖体上,新生肽链在合成的同时即通过SRP及其受体、Sec61通道等复合物导入内质网腔或嵌入膜中,无需直接能量输入,主要服务于向内质网、高尔基体、溶酶体、细胞膜及细胞外分泌的蛋白质。翻译后转运则是在细胞质中完成合成后,通过特定机制将蛋白质送入目标细胞器,如线粒体蛋白质通过TOM/TIM复合体转运,过氧化物酶体蛋白质依赖PEX蛋白家族,核蛋白则通过核孔复合体进行主动运输,这些过程需要分子伴侣协助并消耗能量。
三、内质网中的蛋白质修饰与膜蛋白嵌入
内质网蛋白质共翻译转运机制:核糖体与内质网协同工作,在合成同时将蛋白转入内质网腔。内质网是蛋白质修饰和分选的关键细胞器。进入内质网腔的蛋白质经历糖基化、二硫键形成和正确折叠等初步修饰。跨膜蛋白通过信号肽或停止转移序列嵌入脂质双层,形成特定拓扑结构,这一过程决定了蛋白质最终在膜上的分布不对称性。此后,蛋白质通过小泡运输系统继续向后继区室转运,开启下一阶段的加工与分选旅程。
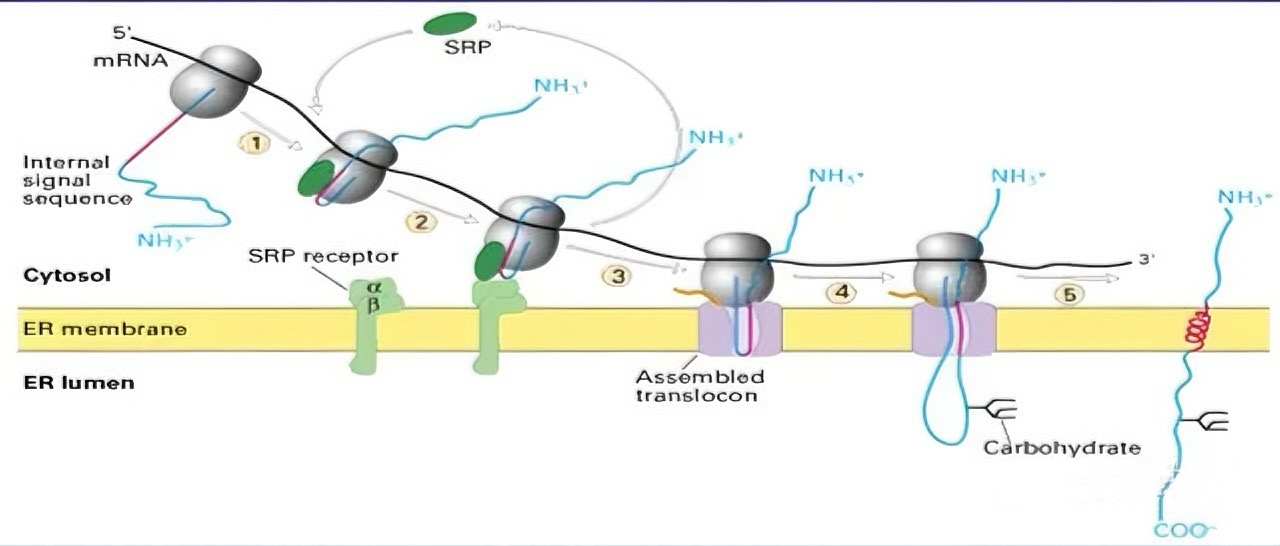
四、小泡运输系统:从内质网到高尔基体及更远
小泡运输是蛋白质在细胞器间传递的主要方式。COPII包被小泡负责从内质网向高尔基体顺面运输蛋白质,COPI包被小泡则在高尔基体不同区室之间介导物质交换。在反面高尔基网络(TGN),蛋白质根据其分选信号被包装进不同运输小泡:溶酶体酶通过M-6-P标记被特异识别并运往溶酶体,分泌蛋白通过组成型或调节型胞吐途径释放,膜蛋白则通过小泡整合至细胞膜。小泡与靶膜的融合由v-SNARE/t-SNARE蛋白特异性识别介导,在Rab GTP酶等辅助下完成,确保货物的准确投递。
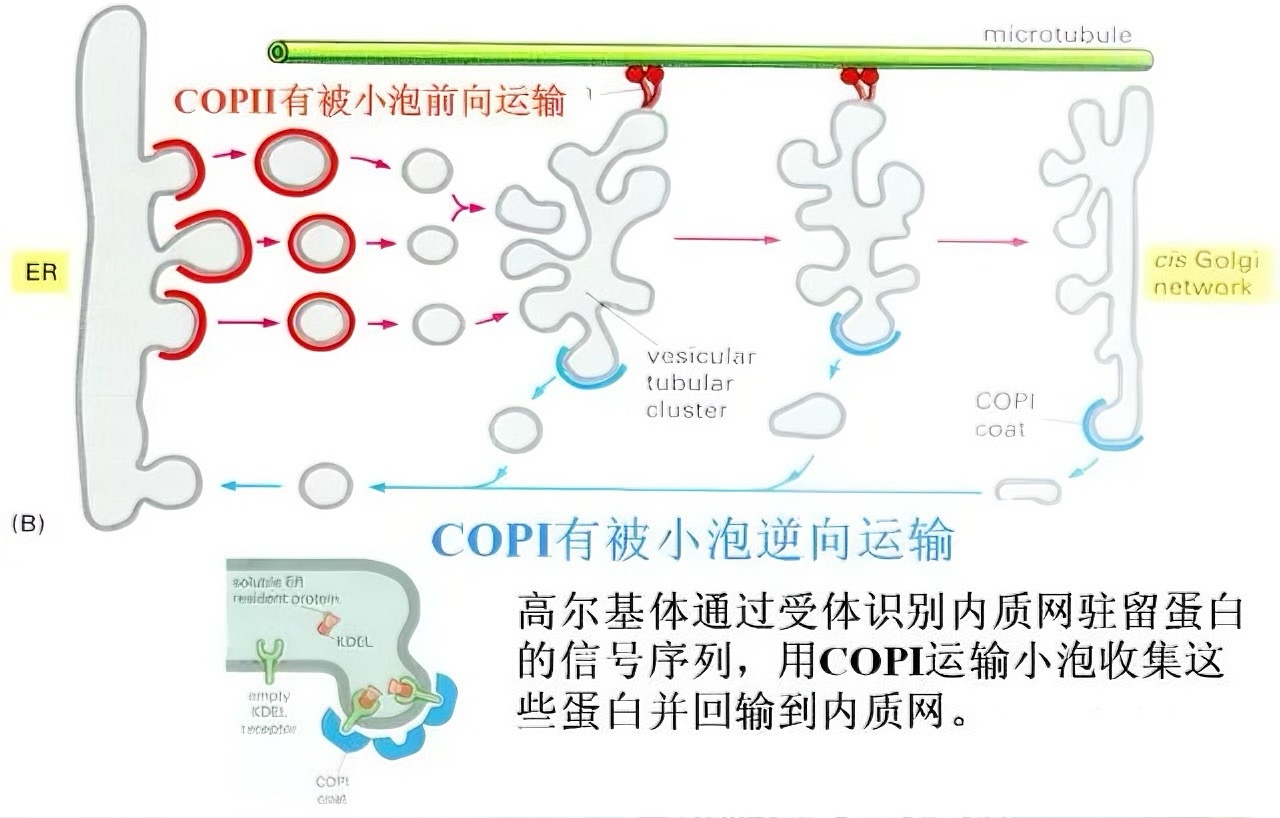
五、其他细胞器的蛋白质输入机制
除内质网-高尔基体途径外,其他细胞器也具备独特的蛋白质输入机制。细胞核通过核孔复合体进行选择性门控运输,核输入信号(NLS)和核输出信号(NES)分别被importin和exportin识别,实现蛋白质和RNA的核质交换。线粒体核编码蛋白翻译后转运:在胞质合成后,通过特定转运复合体被精准识别并送入线粒体。线粒体蛋白质依靠N端前序列和TOM/TIM复合体实现穿膜运输,而过氧化物酶体蛋白质则通过PTS1或PTS2信号与受体Pex5/Pex7结合,经PEX复合体转运至内部。这些过程均具有高度的特异性和能量依赖性。
六、总结与展望
细胞内蛋白质的合成、修饰与定向运输是一个多组件、多步骤的精密系统,涉及核糖体、内质网、高尔基体、线粒体、过氧化物酶体及细胞核等多种细胞器的功能协同。从分选信号的编码与识别,到不同运输途径的调度与执行,细胞通过这一网络确保蛋白质在正确的时间和位置发挥功能。对该机制的深入理解不仅揭示了细胞内部的组织原则,也为相关疾病机制研究和靶向药物开发提供了重要理论基础。
乐备实是国内专注于提供高质量蛋白检测以及组学分析服务的实验服务专家,自2018年成立以来,乐备实不断寻求突破,公司的服务技术平台已扩展到单细胞测序、空间多组学、流式检测、超敏电化学发光、Luminex多因子检测、抗体芯片、PCR Array、ELISA、Elispot、多色免疫组化等30多个,建立起了一套涵盖基因、蛋白、细胞以及组织水平实验的完整检测体系。
我们可提供从样本运输、储存管理、样本制备、样本检测到检测数据分析的全流程服务。凭借严格的实验室管理流程、标准化实验室操作、原始数据储存体系以及实验项目管理系统,已经为超过3000家客户单位提供服务,年检测样本超过100万,受到了广大客户的信任与支持。












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


