概述
流式细胞术(Flow Cytometry,FCM)是一项综合性的细胞分析技术,融合了光学、电子工程、流体力学、免疫学、激光及计算机科学等多领域先进技术。该技术通过流式细胞仪实现对单个细胞的高速、多参数定量检测,可精确测量细胞的荧光、光散射及光吸收等特性,从而客观反映细胞大小、表面抗原表达、受体分布等关键生物学指标。本文旨在系统探讨流式细胞术在急性白血病(Acute Leukemia, AL)诊断中的应用价值与技术特点。
流式细胞术的工作原理
流式细胞术(细胞分群 / 荧光标记检测)基于荧光标记的单克隆抗体与细胞表面或内部抗原的特异性结合,实现对目标细胞的精准标记,这一过程是流式细胞术荧光标记单克隆抗体检测急性白血病细胞抗原的核心技术基础。标记后的细胞在鞘液包裹下形成单细胞悬液,经流体聚焦后形成单细胞流,依次通过激光检测区。
细胞经过激光束时,产生三类光学信号:前向散射光(FSC,0°角),反映细胞大小;侧向散射光(SSC,90°角),反映细胞内复杂度和颗粒性;以及不同波长的荧光信号(如FL1、FL2等),用于识别特定抗原的表达。这些光学信号经光电转换系统变为电信号,由计算机进行采集与分析。
白血病细胞的流式识别策略
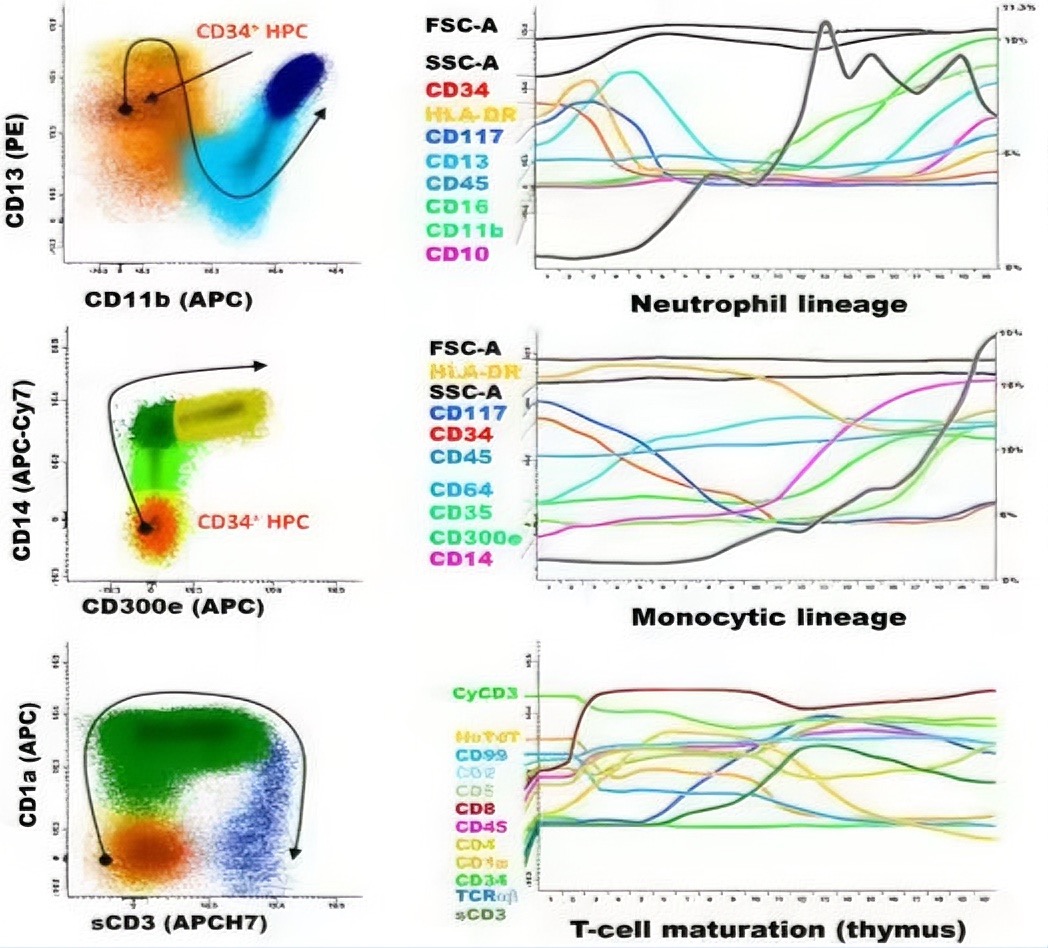
图1 粒系、单核及T系部分抗原的表达规律
急性白血病的免疫分型
根据细胞来源,急性白血病可分为急性髓系白血病(AML)、急性淋巴细胞白血病(ALL)以及特殊类型白血病(如MPAL、AUL等)。

表1 各系列鉴别标志
WHO将AML分为三类,本文重点讨论AML非特指型(AML-NOS),包括M0至M7多个亚型:
M0:原始髓系细胞,分化程度低,髓系抗原表达少;
M1、M2:以原始粒细胞为主,表达更多髓系标志;
M3:异常早幼粒细胞,对维甲酸及砷剂治疗敏感,易并发DIC,需早期诊断;
M4:异质细胞群,含原始粒细胞和幼稚单核细胞;
M5:原始/幼稚单核细胞,部分需结合形态与化学染色鉴别;
M6:红系恶性增殖,表达CD235a;
M7:巨核系增殖,表达CD41、CD42b、CD61。
ALL分为B-ALL与T-ALL。B-ALL常强表达CD19、CD10,CD20弱/阴性,CD34、TDT阳性,CD58强而CD38弱;按CD10与cμ表达可分为pro-B、Common-B和pre-B-ALL。T-ALL多表达CD7、cCD3、CD34、TDT、CD38、CD99,按CD1a、CD2、CD4、CD8可分为Pro-T、Pre-T、皮质T和髓质T亚型。
特殊类型白血病如MPAL需根据系列标志判断,AUL则不表达任何系列特异抗原,不能分类者则标志复杂难以归类。
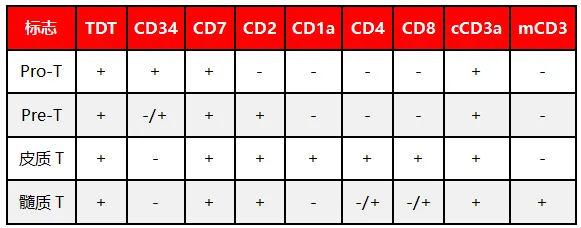
表2 急性B淋巴细胞分类
流式细胞术的技术优势
流式细胞术应用前,白血病诊断主要依赖形态学与细胞化学,主观性强且难以准确分型。FAB分类法不能区分T、B细胞来源,流式细胞术则凭借多参数、单细胞水平分析,实现客观、快速、准确的免疫分型。
流式细胞术是现代MICM分型(形态、免疫、遗传、分子)的核心免疫学手段,检测速度可达每秒数千至数万个细胞,支持多种样本类型(骨髓、外周血、脑脊液等),对髓外浸润亦具诊断价值。
其检测灵敏度高,在获取50万细胞时可达10⁻⁴,更多细胞时媲美PCR,且更快速、操作更简便。PCR和遗传学检测仅适用于特定异常病例,流式则无此限制,并具备细胞分选功能,便于后续研究。
流式细胞术的局限性
流式细胞术也存在一定局限。样本需经过前处理(如裂红、洗涤),可能导致细胞损耗。在AML-NOS中,粒、单核细胞分型偶有困难,有待新标志物发现以改进。多参数分析对操作者经验要求高,人员培训周期较长。
结论
先进检测技术如流式细胞术显著提高了急性白血病的诊断精度,从而改善治疗与预后。对医生而言,此类技术犹如“照妖镜”,揭示疾病本质。然而,诊断需综合多项技术,依托多学科协作,取长补短。更重要的是,技术效用的发挥取决于使用者的能力,持续学习与进步方能更好地服务于临床。
乐备实是国内专注于提供高质量蛋白检测以及组学分析服务的实验服务专家,自2018年成立以来,乐备实不断寻求突破,公司的服务技术平台已扩展到单细胞测序、空间多组学、流式检测、超敏电化学发光、Luminex多因子检测、抗体芯片、PCR Array、ELISA、Elispot、多色免疫组化等30多个,建立起了一套涵盖基因、蛋白、细胞以及组织水平实验的完整检测体系。
我们可提供从样本运输、储存管理、样本制备、样本检测到检测数据分析的全流程服务。凭借严格的实验室管理流程、标准化实验室操作、原始数据储存体系以及实验项目管理系统,已经为超过3000家客户单位提供服务,年检测样本超过100万,受到了广大客户的信任与支持。












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


