1 研究背景
2 实验设计
样本获取与细胞分离:从健康人外周血分离外周血单个核细胞(PBMCs),采用 CD4+T 细胞分离试剂结合流式细胞术纯化目标细胞,确保纯度满足实验需求。
样本分组处理:将纯化的 CD4+T 细胞分为两组 —— 刺激组(加 T-Activator 激活)与未刺激组(无激活,作对照),相同条件孵育,控制无关变量一致。
文库构建与测序:经 10X Genomics 平台完成单细胞分离与文库制备,通过 Illumina HiSeq 4000 测序获取原始数据。
数据子集设计:设计两类子集:一是多梯度测序深度子集(基于原始数据随机抽样,设置不同 reads / 细胞);二是多梯度细胞数量子集(基于全深度数据,设置不同检测细胞数)。
分群准确性评估:以 “全测序深度 + 全细胞数量” 数据为金标准,用随机森林分类模型计算各子集分群准确率,量化与金标准的一致性。
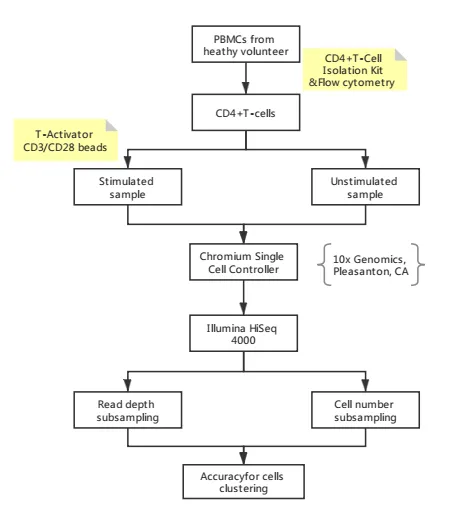
实验设计流程图
3 细胞分群与统计结果
3.1 基础测序指标分析
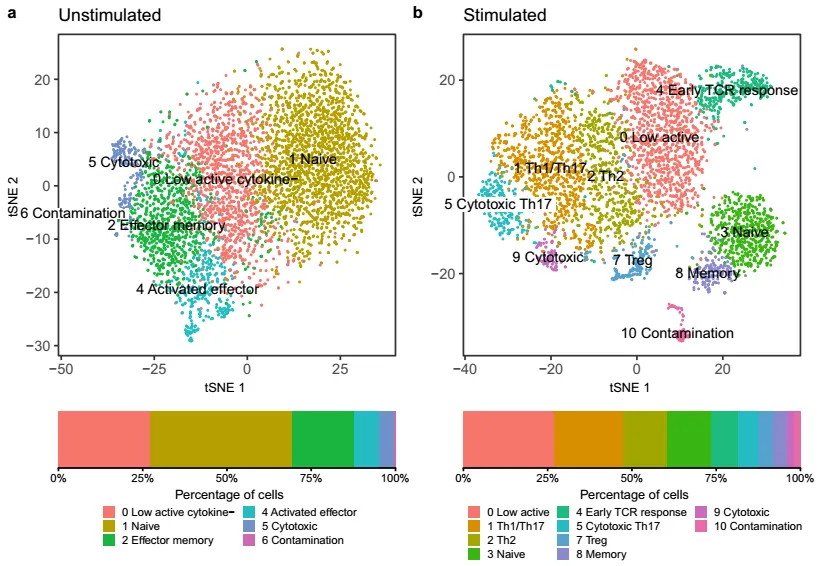
3.2 细胞聚类特征
4 细胞质量与测序深度无关
测序饱和度变化:随深度提升,饱和度先快速升至 90% 左右,随后趋稳,对应每细胞约 70000-90000 个 reads,此深度可基本覆盖转录本,继续提深增益有限。
基因检测数差异:相同深度下,刺激组基因检测数始终高于未刺激组,进一步印证刺激提升细胞转录活性,激活更多基因。
细胞质量与深度的关联性:QC 过滤前后,两组在不同深度下的检测细胞数均稳定,说明识别低质量细胞仅依赖细胞自身指标(如基因检测数、线粒体基因占比),与测序深度无关,排除 “深度影响质量评估” 的干扰。
5 Unstimulated 细胞分群更易受测序深度影响
分群稳定性:刺激组分群稳定性高,即使每细胞仅 5000 个 reads,结果仍与金标准一致;未刺激组在不同平均 reads / 细胞(MRPC)下稳定性差,低深度时部分细胞群无法区分。
分群准确性:未刺激组准确率始终低于刺激组 —— 深度接近每细胞 65000 个 reads 时,未刺激组准确率 82.6%,刺激组达 91.3%。
细胞类型匹配一致性:图 3(全深度与低 / 高深度子集细胞类型比较统计)热图显示,深度大幅变动时,未刺激组细胞错误分类比例更高,证实其分群对测序深度更敏感。

图2 不同条件下两数据集细胞分类的准确性

图3 全测序深度和低/高深度子集的细胞类型比较统计
6 细胞数量比测序深度更重要
细胞数量对准确性的影响:两组细胞数量减少均导致准确率显著下降。高深度下,未刺激组 2500 个细胞时准确率降至 80%,500 个细胞时不足 60%;刺激组 3500 个细胞时准确率低于 90%,1000 个细胞时降至 70% 以下,500 个细胞时亦低于 60%。
两者影响权重比较:相同细胞数量下,不同深度的准确率差异小;相同深度下,不同细胞数量的准确率差异显著。这证实细胞数量对 CD4+T 细胞分群准确性影响更深远,且至少需 2500 个检测细胞保证分群精准。

图4 热图展示测序深度和细胞量对细胞分群精度的影响
7 受刺激细胞的细胞类型更易识别
8 讨论与总结
测序深度优化阈值:未刺激 CD4+T 细胞需每细胞约 6-7 万 reads 实现精准分群;刺激组因转录组特异性强,对深度要求低,低深度即可保证高准确率。
细胞数量临界值:无论刺激状态,CD4+T 细胞分群需至少 2500 个检测细胞,低于该数量将导致准确率大幅下降,无法反映真实异质性。
实验设计指导意义:为 scRNA-seq 实验提供量化参考 —— 静息态细胞(如未刺激 CD4+T 细胞)需优先保证测序深度;活化态细胞可适当降深节约成本,但需确保检测细胞数≥2500 个。研究结论对其他高异质性细胞的实验设计亦有参考价值,助力优化方案、平衡成本与数据质量。
乐备实是国内专注于提供高质量蛋白检测以及组学分析服务的实验服务专家,自2018年成立以来,乐备实不断寻求突破,公司的服务技术平台已扩展到单细胞测序、空间多组学、流式检测、超敏电化学发光、Luminex多因子检测、抗体芯片、PCR Array、ELISA、Elispot、多色免疫组化等30多个,建立起了一套涵盖基因、蛋白、细胞以及组织水平实验的完整检测体系。
我们可提供从样本运输、储存管理、样本制备、样本检测到检测数据分析的全流程服务。凭借严格的实验室管理流程、标准化实验室操作、原始数据储存体系以及实验项目管理系统,已经为超过3000家客户单位提供服务,年检测样本超过100万,受到了广大客户的信任与支持。













 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


