肿瘤相关巨噬细胞(TAMs)是构建免疫抑制性肿瘤微环境(TME)的核心力量,其通过维持自身线粒体活性,为肿瘤免疫逃逸提供关键支撑。但长期以来,TAMs 如何通过线粒体代谢重编程调控自身免疫抑制功能,这一核心机制始终未被阐明。
近日,俄亥俄州立大学综合癌症中心在肿瘤免疫机制研究中取得突破:
- 首次明确线粒体 HSP90 家族伴侣蛋白 TRAP1 的 “代谢检查点” 作用 —— 通过整合线粒体代谢与表观遗传调控,抑制 TAMs 的免疫抑制功能;
- 阐明肿瘤逃逸机制:肿瘤利用 TIM4–AMPK 信号通路下调 TRAP1,驱动 TAMs 代谢重编程与免疫抑制表型;
- 提出治疗新方向:靶向 TIM4 或 JMJD3 恢复 TRAP1 活性,可重塑 TME、增强抗肿瘤免疫,为癌症免疫治疗提供全新靶点与策略。
一、TRAP1 缺失:介导 TAMs 产生免疫抑制效应的关键驱动因子
借助临床样本与动物模型的双重验证,研究明确:
- 针对人结直肠癌组织:TRAP1 的表达差异直接关联巨噬细胞的功能分型 ——TRAP1 低表达(TRAP1lo)巨噬细胞以高表达 CD163 为特征(偏向免疫抑制),TRAP1 高表达(TRAP1hi)巨噬细胞则以富集 CD86 为标志(偏向促炎)。
- 针对黑色素瘤荷瘤小鼠:TAMs 的 TRAP1 表达显著低于脾脏、腹腔来源的巨噬细胞;且该表达水平与免疫抑制基因(MRC1、CD163)及 T 细胞耗竭标志物(PDCD1、LAG3)呈负相关,进一步印证 TRAP1 对免疫抑制表型的调控作用。
通过体外细胞实验验证:用肿瘤条件培养基(TCM)处理骨髓来源巨噬细胞(BMDMs)后,TRAP1 表达水平显著下降,且伴随免疫抑制标志物(CD206、ARG1)的显著上调及促炎基因的表达降低。该现象清晰表明,TRAP1 缺失是驱动巨噬细胞向免疫抑制表型转化的关键因素。
为验证 TRAP1 在体内的功能,研究构建巨噬细胞特异性 TRAP1 敲除(Trap1cKO)小鼠:对其接种黑色素瘤或肺癌后,不仅肿瘤生长加速、重量增加、小鼠生存期缩短,还伴随肿瘤微环境的显著重塑 ——
- TAMs 表型失衡:CD206+、ARG1+、PD-L1 + 等免疫抑制型 TAMs 比例升高,CD86+、MHC-II + 等促炎型 TAMs 比例降低;
- 抗肿瘤免疫减弱:肿瘤浸润淋巴细胞(TILs)数量减少,IFNγ+CD8+T 细胞(关键杀伤性 T 细胞)比例下降,调节性 T 细胞(免疫抑制细胞)比例升高。
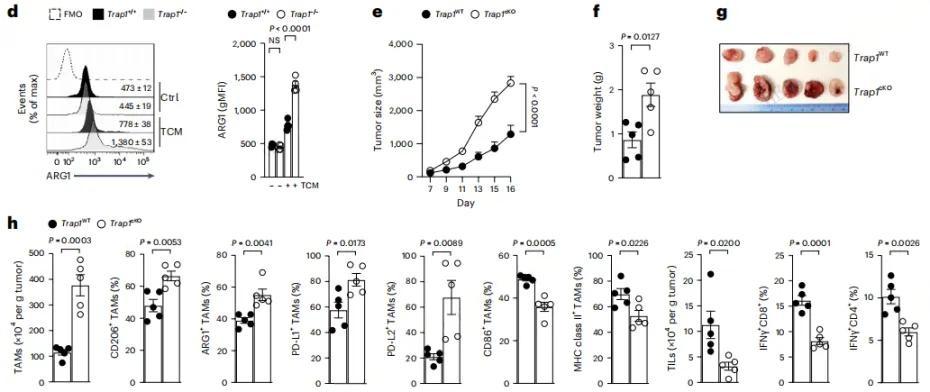
进一步研究发现,TRAP1 敲除的 TAMs 对 CD8+T 细胞功能具有显著抑制作用,可明显降低 CD8+T 细胞的增殖能力,并减少其 IFNγ 与颗粒酶 B(GZMB)的分泌量;而通过回补 TRAP1 的表达,不仅能逆转 TAMs 的免疫抑制表型,还可有效恢复 CD8+T 细胞的杀伤功能,形成明确的功能挽救效应。
二、TIM4–AMPK–TRAP1–α-KG–JMJD3信号轴
进一步机制研究揭示:
- TAMs 高表达磷脂酰丝氨酸(PS)受体 TIM4,且 AMPK 磷酸化水平显著高于非肿瘤巨噬细胞;
- TME 中的 PS、缺氧等信号通过结合 TIM4 激活 AMPK,激活的 AMPK 可磷酸化热休克因子 1(HSF1)的 Ser121 位点,抑制其核移位,进而阻断 TRAP1 转录;
- 敲低 AMPKα(Prkaa1)或阻断 TIM4,可恢复 TRAP1 表达并减少 TAMs 免疫抑制标志物表达。
同时,TRAP1 敲除可使 TAMs 在线粒体功能与结构上发生显著改变,具体表现为:
- 线粒体含量与质量提升:线粒体 DNA(mtDNA)与核 DNA(nDNA)的比值升高,且线粒体质量及膜电位均显著增加;
- 呼吸功能增强:电子传递链(ETC)复合体 I–IV 的活性显著增强,进而推动基础氧消耗率(OCR)与备用呼吸容量明显升高;
- 结构优化与效率提升:线粒体嵴密度增加,最终使 TAMs 的整体代谢效率显著增强。
代谢层面,TRAP1 缺失通过调控关键代谢通路为 TAMs 免疫抑制表型提供支撑:
- 重塑代谢流:TRAP1 缺失可促进谷氨酰胺分解代谢,增加 α- 酮戊二酸(α-KG)生成;同时增强琥珀酸脱氢酶(SDH)活性、减少琥珀酸积累,最终导致 α-KG / 琥珀酸比值显著升高;
- 调控表观遗传与基因表达:α-KG 作为组蛋白去甲基化酶 JMJD3 的关键辅酶,其积累可增强 JMJD3 介导的 H3K27me3 去甲基化作用,进而启动免疫抑制相关基因(Mrc1、Arg1)的转录。
JMJD3 作为 TRAP1 下游关键因子的功能被证实:
- 体内层面:巨噬细胞特异性 JMJD3 敲除(Jmjd3cKO)可抑制肿瘤生长,逆转 TAMs 免疫抑制表型,并增强 TILs 的浸润与功能;
- 机制层面:无论是敲低 JMJD3 还是用 GSK-J4 抑制其活性,都能阻止 TRAP1 缺失导致的 CD206、ARG1 高表达,直接印证 JMJD3 在 TRAP1 调控通路中的下游表观遗传调控作用。
三、靶向 TRAP1 通路:逆转 TAMs 免疫抑制、重塑抗肿瘤免疫
基于 TRAP1 调控通路,研究团队验证了两种核心治疗策略的有效性:
- 靶向 TIM4 阻断 TRAP1 下调:对黑色素瘤荷瘤小鼠使用抗 TIM4 抗体,可显著恢复 TAMs 中 TRAP1 的表达,减少免疫抑制性 TAMs 比例,同时增加 TILs 浸润及 IFNγ+T 细胞比例,最终实现肿瘤生长抑制与小鼠生存期延长;
- 靶向 JMJD3 阻断表观遗传重编程:JMJD3 抑制剂 GSK-J4 单独使用即可抑制肿瘤生长,与抗 TIM4 抗体联合使用时,能协同重塑肿瘤微环境(TME),进一步增强抗肿瘤免疫效果。
此外,在 Trap1cKO 小鼠中,抗 TIM4 治疗无法抑制肿瘤生长,证实 TRAP1 是 TIM4 信号下游的关键效应分子,且靶向 TIM4 的治疗效果依赖 TRAP1 的功能恢复。
四、研究总结与启示
- 机制层面:该研究明确 TRAP1 是调控 TAMs 免疫抑制功能的核心分子,首次揭示肿瘤可通过 TIM4–AMPK 信号通路下调 TRAP1,进而驱动 TAMs 线粒体代谢重编程与 JMJD3 介导的表观遗传修饰,最终构建免疫抑制性肿瘤微环境(TME)的完整分子机制。
- 应用层面:研究证实,靶向 TRAP1 通路关键节点(如 TIM4、JMJD3)能有效逆转 TAMs 免疫抑制表型、打破肿瘤免疫逃逸,为新型癌症免疫治疗药物的研发提供了可靠的理论支撑与实验依据。
Zhao H, Park J, Wang Y, Chou YJ, Li L, Raines LN, Hsu M, Lin CC, Cao W, Ouyang Y, Chen HY, Zheng L, Li Z, Huang AY, Ho PC, Lio CJ, Huang SC. Cancer suppresses mitochondrial chaperone activity in macrophages to drive immune evasion. Nat Immunol. 2025 Oct 29. doi: 10.1038/s41590-025-02324-2. Epub ahead of print. PMID: 41162642.












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


