T细胞作为适应性免疫系统的核心组成部分,其功能激活、增殖分化及效应发挥均依赖精密的代谢调控。代谢重编程作为T细胞适应生理或病理状态的关键机制,指细胞根据功能需求与环境变化,动态调整代谢途径以满足能量供应和生物大分子合成需求,这一过程贯穿T细胞活化至效应执行的全周期,是调控免疫应答强度与方向的核心枢纽。
一、 T细胞激活与代谢重编程的启动
静止状态下的T细胞处于低代谢水平,主要通过氧化磷酸化(OXPHOS)产生少量ATP,维持基本生命活动。当T细胞通过TCR受体识别抗原呈递细胞呈递的抗原肽-MHC复合物后,激活信号快速传导至细胞内,引发能量和物质需求的急剧上升——为支持细胞增殖、效应分子合成及功能分化,T细胞必须启动代谢重编程,从静止期的"节能代谢模式"切换为活化期的"高效合成代谢模式"。这一转换过程由PI3K-Akt-mTOR、AMPK等多条信号通路协同调控,确保代谢调整与功能需求精准匹配。
二、 T细胞代谢重编程的核心途径
(一)糖代谢重编程:有氧糖酵解的核心作用
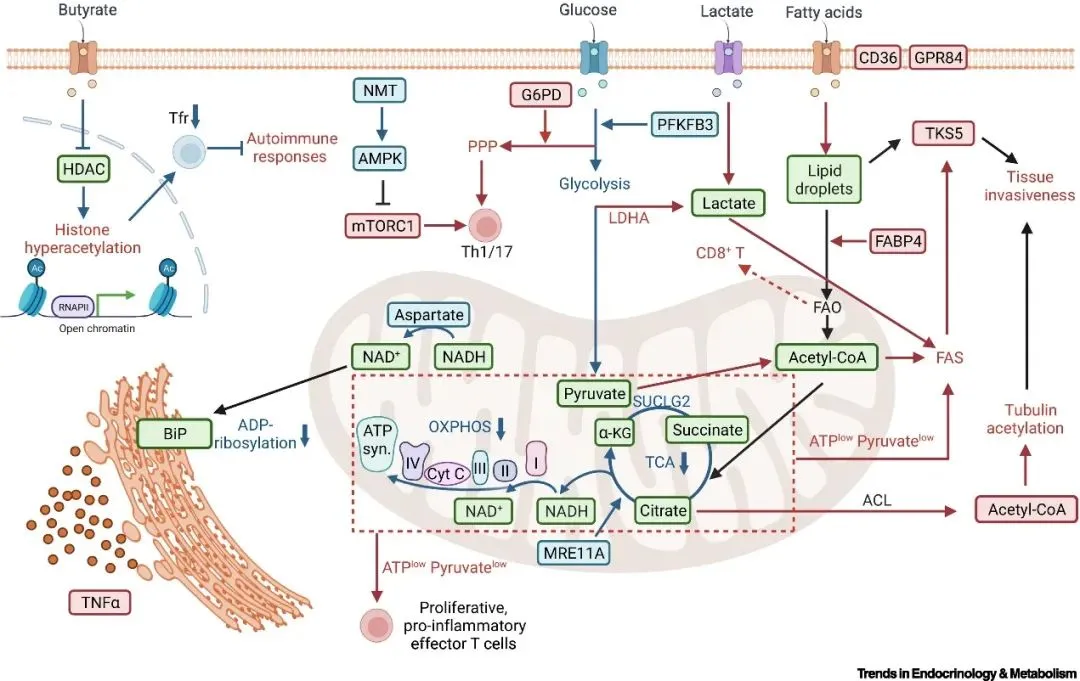
激活后的T细胞糖代谢发生显著重塑,最关键的特征是有氧糖酵解的强势激活——即使在氧气充足的条件下,T细胞也优先将葡萄糖转化为乳酸,同时糖酵解速率大幅提升。这一过程并非简单的能量供应方式改变,而是通过快速产生ATP满足即时能量需求,同时生成葡萄糖-6-磷酸、丙酮酸等中间产物,为核酸、蛋白质等生物大分子合成提供前体。其中,葡萄糖-6-磷酸脱氢酶(G6PD)介导的磷酸戊糖途径(PPP)尤为关键,可生成NADPH和核苷酸合成原料,支撑T细胞的快速增殖。此外,部分活化T细胞也会同步增强线粒体氧化代谢活性,形成"糖酵解为主、氧化代谢为辅"的双重供能模式,保障持续的功能执行。
(二)氨基酸代谢重编程:氮源供应与信号调控的双重支撑
氨基酸代谢是T细胞代谢重编程的重要环节,为细胞提供关键的氮源和碳源。谷氨酰胺作为核心营养物质,被激活的T细胞大量摄取后,经谷氨酰胺酶催化转化为谷氨酸,进而参与三羧酸循环(TCA)、蛋白质合成等多条代谢途径,是维持T细胞增殖和效应功能的必需物质。同时,精氨酸等氨基酸的摄取量显著增加,不仅参与蛋白质合成,更通过调控mTORC1等信号通路,进一步放大代谢重编程效应,形成"氨基酸供应-信号激活-代谢增强"的正反馈循环。
(三)脂代谢重编程:结构合成与信号调控的双重功能
脂代谢的动态调整直接影响T细胞的功能状态。激活后的T细胞通过上调CD36等脂质转运蛋白,增加脂肪酸的摄取,同时激活脂肪酸合成酶(FAS)、乙酰辅酶A羧化酶(ACC)等关键酶类,增强内源性脂肪酸合成。这些脂质既可以通过β-氧化进入线粒体产生ATP,为长期免疫应答提供能量;也可用于合成细胞膜磷脂等结构成分,支撑T细胞的快速增殖与形态重塑。此外,脂质代谢产物还可作为信号分子,调控T细胞分化方向,例如促进Th1/Th17等效应T细胞亚群的形成,影响免疫应答的类型。
三、 代谢重编程与T细胞功能的精准调控
T细胞的代谢表型与功能状态高度关联,形成"代谢-功能"的双向调控网络。糖代谢活跃的T细胞通常倾向于分化为增殖能力强、炎症因子分泌旺盛的效应T细胞(如CD8+细胞毒性T细胞、Th1/Th17细胞),其有氧糖酵解产生的乳酸等代谢产物还可通过调节肿瘤微环境等方式,增强免疫杀伤效率;而依赖脂肪酸氧化(FAO)的T细胞则更易形成记忆T细胞,通过维持线粒体稳态和代谢可塑性,实现长期免疫记忆功能。 代谢重编程的异常调控还与疾病发生密切相关。若糖代谢过度激活可能导致T细胞功能亢进,引发自身免疫性疾病;而肿瘤微环境中T细胞的代谢受限(如葡萄糖匮乏、乳酸堆积)则会导致其功能耗竭,削弱抗肿瘤免疫应答。因此,靶向T细胞代谢重编程关键分子(如PFKFB3、LDHA、FAS等)调节代谢途径,已成为免疫相关疾病治疗的潜在方向。
四、T 细胞代谢重编程机制研究的核心蛋白指标
T 细胞代谢重编程涉及糖、氨基酸、脂类三大代谢途径及信号与表观调控,核心蛋白指标的表达或活性变化,直接反映其代谢模式切换与功能状态,具体关键蛋白如下:
| 代谢类别 | 核心蛋白 | 功能描述 |
| 糖代谢相关 | PFKFB3 | T 细胞激活后上调,催化生成果糖 - 2,6 - 二磷酸以激活糖酵解,推动有氧糖酵解速率提升,关联效应 T 细胞增殖与炎症因子分泌。 |
| LDHA | 有氧糖酵解标志蛋白,将丙酮酸转化为乳酸以维持糖酵解运转,乳酸积累可调控肿瘤微环境中 T 细胞功能。 | |
| G6PD | 磷酸戊糖途径限速酶,生成 NADPH 与核苷酸合成前体,为 T 细胞增殖提供核酸原料,连接糖代谢与生物大分子合成。 | |
| SUCLG2 | 参与三羧酸循环,功能异常致琥珀酸堆积,影响线粒体呼吸链效率,调控 T 细胞代谢可塑性(如效应与记忆 T 细胞分化切换)。 | |
| Cyt C | 线粒体呼吸链关键蛋白,反映线粒体功能完整性与 T 细胞能量供应稳定性,表达模式随代谢模式切换调整。 | |
| 氨基酸代谢相关 | GLS(谷氨酰胺酶) | 催化谷氨酰胺分解为谷氨酸,激活后 T 细胞上调其表达以增强谷氨酰胺代谢,为三羧酸循环供碳源,维持氧化还原平衡,是效应 T 细胞功能必需蛋白。 |
| mTORC1 | 氨基酸充足时激活的信号蛋白,调控糖酵解(如上调 PFKFB3)、脂合成相关酶表达,促进 T 细胞向效应态分化,活性异常致代谢紊乱与功能失衡(如自身免疫反应、免疫耗竭)。 | |
| 脂代谢相关 | CD36 | 跨膜脂质转运蛋白,激活后 T 细胞上调其表达以增加脂肪酸摄取,为 β- 氧化供能(如记忆 T 细胞稳态维持)或细胞膜磷脂合成(支撑增殖),与代谢表型(糖酵解型 vs 氧化代谢型)密切相关。 |
| FABP4 | 胞内脂质转运蛋白,参与脂肪酸运输利用,调控脂质信号分子生成,影响 T 细胞分化(如促进 Th17 细胞分化)与组织浸润能力。 | |
| FAS | 脂肪酸合成限速酶,效应 T 细胞上调其表达以增强脂肪酸合成,用于细胞膜合成与脂滴储存,活性受 mTORC1 调控,抑制后致 T 细胞增殖受阻、效应功能下降。 | |
| ACC | 催化乙酰 - CoA 转化为丙二酰 - CoA(脂肪酸合成前体),影响脂肪酸合成速率,丙二酰 - CoA 抑制脂肪酸 β- 氧化,维持 “合成 vs 分解” 代谢平衡,调控代谢模式切换。 | |
| 信号与表观调控相关 | AMPK | 能量感知蛋白,T 细胞能量匮乏时激活,抑制 mTORC1 与脂合成,促进脂肪酸 β- 氧化以维持代谢稳态,与 mTORC1 形成 “拮抗平衡”,共同调控代谢选择与功能状态。 |
| HDAC | 表观调控蛋白,通过调节组蛋白乙酰化水平,调控糖酵解、脂代谢相关酶(如 LDHA、FAS)基因表达,影响代谢重编程,其抑制剂可重塑表观遗传状态以调整 T 细胞代谢与免疫功能。 |
五、T细胞研究实验服务
深入解析 T 细胞代谢重编程机制,离不开精准、高效的多维度检测技术支撑。LabEx 作为覆盖基因、蛋白、细胞及组织水平的一站式生物标志物发现平台,凭借 30 + 成熟技术平台(包括单细胞测序、空间多组学、流式检测、蛋白芯片、多色免疫组化等)与年超 100 万样本的检测经验,可提供从代谢相关蛋白定量、信号通路分析到空间代谢表型解析的全流程服务。无论是糖代谢关键酶(如 PFKFB3、LDHA)、脂代谢调控蛋白(如 CD36、FAS)的精准检测,还是 mTORC1、AMPK 等信号通路的多因子同步分析,LabEx 均能以标准化操作与专业数据分析,助力研究者快速挖掘代谢重编程核心机制、筛选关键标志物。依托务真严谨的服务理念与全面的技术覆盖,LabEx 将为 T 细胞代谢重编程相关研究提供强有力的技术支持,加速基础研究向临床转化的进程。












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


