摘要:
白细胞介素-1(IL-1)作为首个被发现的白细胞介素,是调控先天免疫与炎症反应的关键分子。IL-1家族构成了复杂的细胞因子网络系统,包含配体与受体两大亚家族,通过精密的激活与负向调控机制,参与感染防御、组织修复、代谢平衡等多种生理过程,同时在自身免疫性疾病、心血管疾病、神经退行性病变及癌症等病理状态中发挥核心作用。
一、 IL-1系统的组成与结构特征
IL-1系统是一个由配体、受体及负调控分子构成的复杂网络,各成员通过结构同源性与功能关联性形成协同调控体系。
(一)配体家族分类及功能特性
IL-1家族配体基于功能可分为三类:
1. 激动剂:包括IL-1α、IL-1β、IL-18、IL-33、IL-36α、IL-36β和IL-36γ,这类分子可结合相应受体启动促炎信号传导。其中IL-1α和IL-1β为经典促炎因子,IL-18主要诱导Ⅰ型免疫应答,IL-33偏向调控Ⅱ型免疫反应,IL-36家族则在皮肤、肠道等黏膜组织炎症中发挥关键作用。
2. 受体拮抗剂:包含IL-1Ra、IL-36Ra和IL-38,通过竞争性结合受体阻断激动剂信号,其中IL-1Ra与IL-1R1的亲和力高于IL-1本身,是首个被发现的关键负调控分子。
3. 抗炎细胞因子:仅IL-37一种,通过多重机制抑制炎性细胞因子产生,对先天免疫与适应性免疫均具有负向调控作用。 配体分子的结构具有共性特征:多数以无信号肽的前体形式合成,需经蛋白酶水解加工获得活性。例如IL-1β前体需通过NLRP3炎症小体激活Caspase-1实现成熟,而IL-33则可被中性粒细胞蛋白酶、肥大细胞蛋白酶等切割为超活性形式。部分配体(如IL-1α、IL-33、IL-37)具有核定位信号,可进入细胞核调控基因表达,属于"双功能"细胞因子。
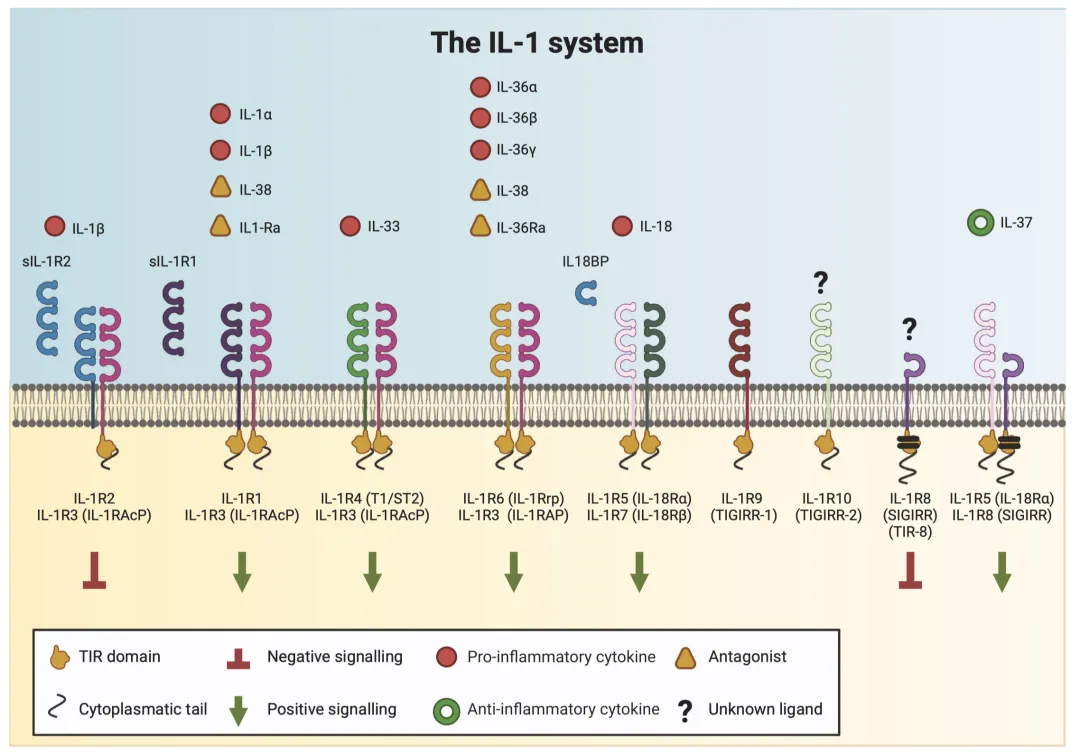
(二)受体家族的结构与信号传导
IL-1受体(ILR)家族包含11种成员,均具有细胞外免疫球蛋白样结构域和细胞内TIR结构域,后者是通过MyD88适配体启动信号传导的关键。根据功能可分为:
1. 信号受体:如IL-1R1、IL-1R4(ST2)、IL-1R5(IL-18Rα)等,与配体结合后招募辅助受体(如IL-1R3)形成复合体,激活NF-κB和MAPKs(p38、JNKs、ERKs)信号通路,诱导炎症相关基因表达。
2. 诱饵受体:如IL-1R2、IL-18BP,高亲和力结合配体但缺乏功能性TIR结构域,无法传递信号,从而竞争性抑制激动剂与信号受体结合。
3. 负调节受体:如IL-1R8(SIGIRR/TIR8),通过干扰TIR结构域适配分子招募,抑制NF-κB和JNK通路激活,同时作为IL-37的受体链参与抗炎信号传导。
二、 IL-1家族的核心免疫调控功能
IL-1家族成员通过调控髓系细胞功能、训练性先天免疫、淋巴细胞极化等过程,在先天免疫与适应性免疫的协同作用中扮演关键角色。
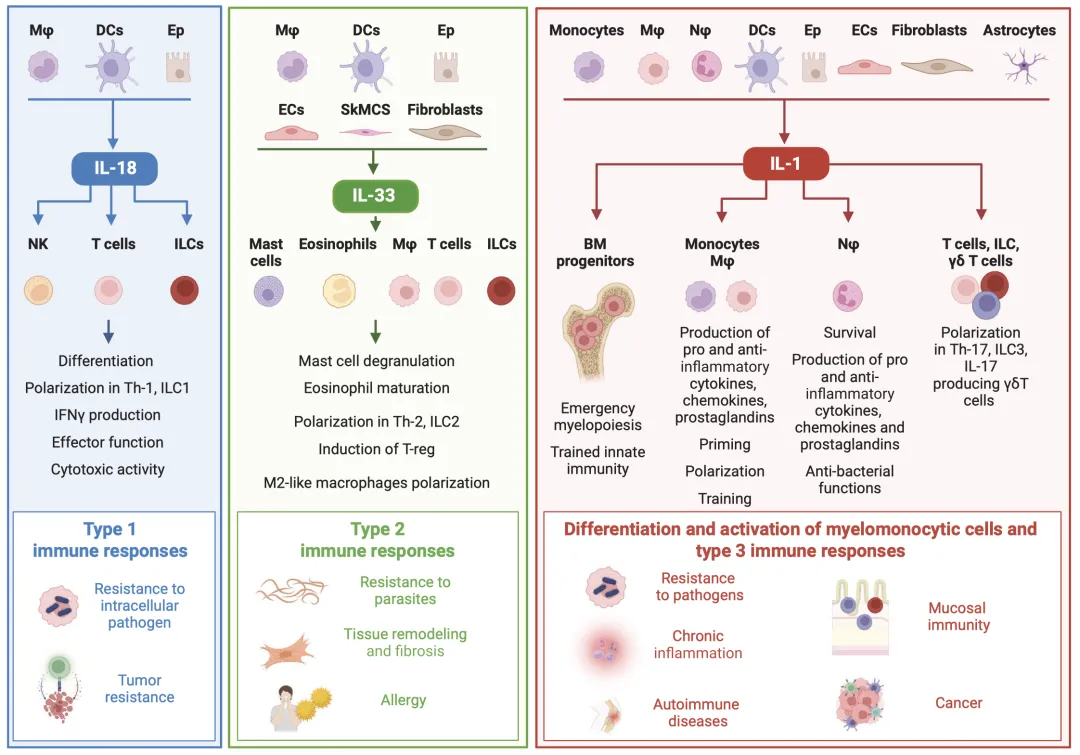
(一)对髓系细胞与先天免疫的调控
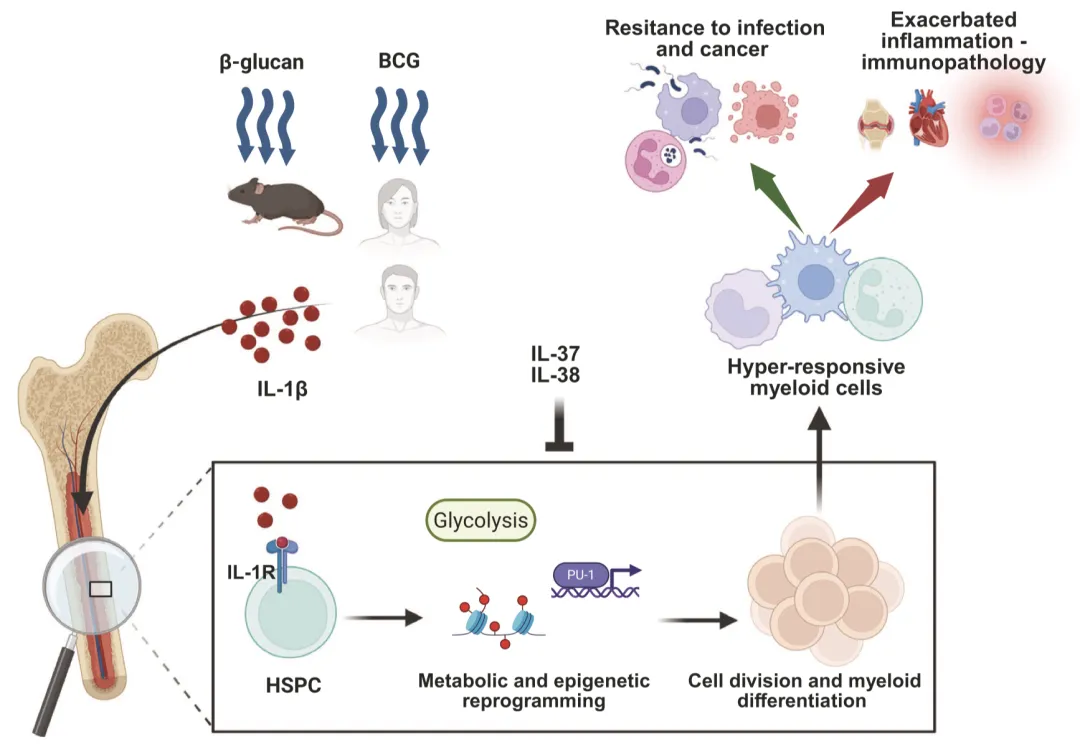
髓系细胞(单核细胞、巨噬细胞、中性粒细胞)是IL-1家族成员的主要产生者与效应细胞。IL-1β可诱导单核细胞自身分泌IL-1,通过激活AKT/mTOR/HIF-1α信号通路引发代谢重编程,增强糖酵解活性,从而诱导训练性先天免疫——这一过程通过表观遗传修饰实现先天免疫细胞的长期功能重编程,增强后续感染防御能力。 中性粒细胞在炎症刺激下可通过炎症小体依赖和非依赖机制产生IL-1β,同时表达IL-1Ra和IL-1R2形成自调控环路。在感染状态下,中性粒细胞来源的IL-1β不仅参与抗菌防御,还可招募其他免疫细胞放大炎症反应,但过度激活则会导致组织损伤。
(二)对淋巴细胞极化的调控
IL-1家族成员通过选择性调控先天性淋巴细胞(ILCs)和T细胞亚群分化,定向塑造免疫应答类型:
1. Ⅰ型免疫应答:IL-18与IL-15协同驱动ILC1和Th1细胞产生IFNγ,增强抗细胞内病原体感染和抗肿瘤免疫。
2. Ⅱ型免疫应答:IL-33与IL-25共同促进ILC2和Th2细胞分泌IL-4、IL-5、IL-13,参与寄生虫清除、过敏反应及组织修复。
3. Ⅲ型免疫应答:IL-1β与IL-23协同激活ILC3和Th17细胞产生IL-17和IL-22,增强黏膜免疫和抗菌防御,但异常激活则参与自身免疫性疾病发生。 此外,IL-1是Th17细胞分化的关键驱动因子,IL-37可诱导调节性T细胞(Tregs)生成,IL-38则负向调控Th17细胞功能,这些调控机制共同维持免疫平衡。
(三)负反馈调节机制
IL-1系统的负向调控是避免炎症过度激活的关键,主要通过四种途径实现:
1. 受体拮抗剂(IL-1Ra、IL-36Ra)竞争性结合受体,阻断信号复合体形成;
2. 诱饵受体(IL-1R2、IL-18BP)捕获配体,降低游离配体浓度;
3. 负调节受体(IL-1R8)直接抑制信号传导;
4. 抗炎细胞因子(IL-37、IL-38)通过多重机制抑制炎性细胞因子产生。 这些负调控分子的缺陷会导致炎症失控,例如IL-1Ra基因缺陷(DIRA)可引发严重全身性炎症,IL-36Ra缺陷(DITRA)则与银屑病样皮炎相关。
三、 IL-1家族在疾病中的病理作用
IL-1系统的失调或过度激活是多种炎症相关性疾病的核心发病机制,涉及感染、代谢性疾病、自身免疫病、神经退行性病变及癌症等多个领域。
(一)感染与炎症相关疾病
在感染性疾病中,IL-1家族成员通过激活炎症反应清除病原体,但过度激活则会导致免疫病理损伤。例如SARS-CoV-2感染可激活NLRP3炎症小体,导致IL-1β和IL-18大量释放,引发细胞因子风暴和急性呼吸窘迫综合征(ARDS)。在细菌感染中,IL-1β和IL-18通过招募白细胞、增强效应功能发挥防御作用,但IL-1R8缺陷会导致炎症过度激活,加重组织损伤。 在无菌性炎症中,IL-1家族响应组织损伤释放的内源性危险信号(如尿酸、胆固醇结晶),参与心肌梗死、缺血性脑卒中的病理过程。心肌梗死后,缺血导致的细胞死亡激活NLRP3炎症小体,IL-1β和IL-18促进心肌重构,最终诱发心力衰竭。
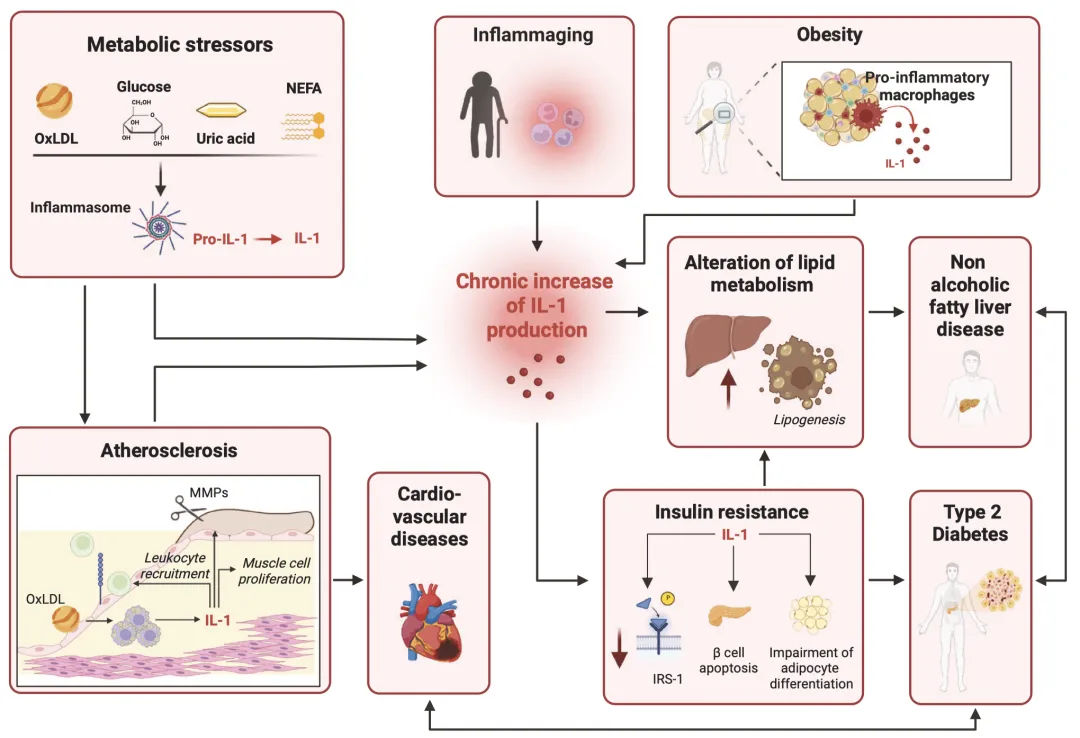
(二)代谢性与心血管疾病
IL-1β是代谢紊乱与心血管疾病的关键纽带。肥胖、高血糖等代谢应激可激活炎性小体,导致IL-1β持续升高,通过抑制胰岛素受体底物1(IRS-1)磷酸化引发胰岛素抵抗,促进2型糖尿病发生。同时,IL-1β可促进肝细胞脂质新生,加速非酒精性脂肪肝病(NAFLD)进展;在动脉粥样硬化中,IL-1α、IL-1β和IL-18通过促进内皮细胞活化、平滑肌细胞增殖及斑块不稳定,加剧血管损伤。 IL-18在代谢平衡中具有双重作用,其缺乏会导致食欲调节异常和肥胖,但过度激活则会促进动脉粥样硬化。IL-33和IL-37则展现出保护作用,IL-33可通过激活ILC2细胞增强胰岛素分泌,IL-37则减轻脂肪组织炎症,改善胰岛素抵抗。
(三)自身免疫与自身炎症性疾病
IL-1家族成员的异常激活是自身免疫病和自身炎症性疾病的核心驱动因素。NLRP3获得性功能突变导致IL-1β过度产生,与冷蛋白相关周期性综合征(CAPS)相关;IL-36家族异常激活参与银屑病、炎症性肠病和类风湿关节炎的发病,IL36Ra基因多态性与严重银屑病密切相关。 IL-33/ST2轴在过敏性疾病中发挥关键作用,哮喘患者支气管黏膜IL-33表达升高,与疾病严重程度正相关;IL-18在IL-23存在时可促进IL-17产生,参与Th17驱动的自身免疫病理过程。
(四)神经退行性病变与癌症
在阿尔茨海默病(AD)中,β淀粉样蛋白(Aβ)可激活星形胶质细胞释放IL-1β并激活NLRP3炎症小体,加剧神经炎症和神经元死亡;帕金森病(PD)中,α-突触核蛋白(aSyn)激活NLRP3炎症小体,IL-1参与多巴胺能神经元退行性病变。 在癌症中,IL-1家族成员呈现双重作用:IL-18通过诱导IFNγ产生增强抗肿瘤免疫,而IL-33驱动的Ⅱ型免疫反应则促进肿瘤进展;IL-1β通过增强肿瘤侵袭、血管生成及化疗耐药性支持肿瘤发展,而IL-38则通过维持免疫抑制状态促进肿瘤逃逸。
四、 IL-1因子检测服务
IL-1 家族的深度研究与临床转化,离不开精准高效的多维度检测技术支撑。LabEx作为多组学与多因子检测领域的专业服务商,凭借 30 + 项核心技术平台,为 IL-1 家族研究提供了从基因、蛋白、细胞到组织水平的全链条技术解决方案。其涵盖的单细胞测序、MSD 电化学发光、Luminex 多因子检测、抗体芯片、空间多组学等关键技术,可实现 IL-1 家族分子的定量检测、表达定位及通路分析,配合标准化实验室流程与百万级样本检测经验,为研究数据的可靠性提供了有力保障。
未来,IL-1 家族研究将聚焦于分子调控网络解析、生物标志物筛选及靶向药物研发。LabEx 可依托技术优势,为基础研究到临床转化提供精准支撑,助力挖掘 IL-1 家族在疾病中的潜在价值。期待通过科研与技术服务的深度结合,持续拓展 IL-1 家族研究边界,推动炎症相关性疾病诊断治疗的创新发展,为人类健康贡献力量。
LabEx多款现货Panel支持IL-1因子检测,欢迎咨询~
| Panel | 乐备实官网货号 | 技术平台 | 检测指标 |
| 人炎症10因子Panel | LXMH10-1 | MSD | IFN-γ,IL-1β,IL-2,IL-4,IL-6,IL-8,IL-10,IL-12p70,IL-13,TNF-α |
| 人炎症10因子Panel | LXLBH10-1 | Luminex | IL-1 β/IL-1F2,IL-2,IL-4,IL-6 ,IL-8/CXCL8,IL-10,IL-12 p70,IL-13,TNF-α,IFN-γ |
| 小鼠炎症10因子Panel | LXMM10-1 | MSD | IFN-γ,IL-1β,IL-2,IL-4,IL-5,IL-6,IL-10,IL-12p70,KC/GRO,TNF-α |
| 小鼠炎症10因子Panel | LXLBM10-1 | Luminex | IL-1 β/IL-1F2,IL-2,IL-4,IL-5,IL-6 ,IL-10,IL-12p70,CXCL1/GRO/α/KC/CINC-1,IFN-γ,TNF-α |
| 大鼠炎症10因子Panel | LXLBR10-1 | Luminex | IL-1 β/IL-1F2,IL-2,IL-4,IL-5,IL-6 ,IL-10,IL-12p70,CXCL1/GRO/α/KC/CINC-1,IFN-γ,TNF-α |
| 小鼠细胞因子-23因子Panel | LXLBM23-1 | Luminex | Eotaxin/CCL11,G-CSF,GM-CSF,IFN-γ,IL-10,IL-12(p40),IL-12(p70),IL-13,IL-17A,IL-1α,IL-1β,IL-2,IL-3,IL-4,IL-5,IL-6,IL-9,GRO-α (Gro-a/KC/CXCL1),MCP-1/CCL2,MIP-1α/CCL3,MIP-1β,RANTES,TNF-α |
| 大鼠细胞因子-23因子Panel | LXLBR23-1 | Luminex | G-CSF,GM-CSF,GRO/KC,IFN-γ,IL-1α,IL-1β,IL-2,IL-4,IL-5,IL-6,IL-7,IL-10,IL-12 (p70),IL-13,IL-17A,IL-18,M-CSF,MCP-1,MIP-1α,MIP-3α,RANTES,TNF-α,VEGF |
| 小鼠趋化因子-31因子Panel | LXLBM31-1 | Luminex | BCA-1/CXCL13,CTACK/CCL27,ENA-78/CXCL5,Eotaxin/CCL11,Eotaxin-2/CCL24,Fractalkine/CX3CL1,GM-CSF,I-309/CCL1,IFN-γ,IL-1β,IL-2,IL-4,IL-6,IL-10,IL-16,IP-10/CXCL10,I-TAC/CXCL11,KC/CXCL1,MCP-1/CCL2,MCP-3/CCL7,MCP-5/CCL12,MDC/CCL22,MIP-1α/CCL3,MIP-1β/CCL4,MIP-3α/CCL20,MIP-3β/CCL19,RANTES/CCL5,SCYB16/CXCL16,SDF-1α/CXCL12,TARC/CCL17,TNF-α |
| 人细胞因子-46因子Panel | LXLRH46-1 | Luminex | CCL2/JE/MCP-1,CCL3/MIP-1 alpha,CCL4/MIP-1 beta,CCL5/RANTES,CCL11/Eotaxin,CCL19/MIP-3 beta,CCL20/MIP-3 alpha,CD40 Ligand/TNFSF5,CXCL1/GRO alpha/KC/CINC-1,CXCL2/GRO beta/MIP-2/CINC-3,CXCL10/IP-10/CRG-2,EGF,FGF basic/FGF2/bFGF,Flt-3 Ligand/FLT3L,G-CSF,GM-CSF,Granzyme B,IFN-alpha 2/IFNA2,IFN-beta,IFN-gamma,IL-1 alpha/IL-1F1,IL-1 beta/IL-1F2,IL-1ra/IL-1F3,IL-2,IL-3,IL-4,IL-5,IL-6,IL-7,IL-8/CXCL8,IL-9,IL-10,IL-12 p70,IL-13,IL-15,IL-17/IL-17A,IL-17E/IL-25,IL-33,Lymphotoxin-alpha/TNF-beta,PD-L1/B7-H1,PDGF-AA,PDGF-AB/BB,TGF-alpha,TNF-alpha,TRAIL/TNFSF10,VEGF |












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


