随着CRISPR-Cas9基因编辑体系与mRNA技术的突破性进展,基因治疗领域的研究重心已从“基因编辑工具的优化与靶向性编辑策略探索”,转向“基因递送系统的高效性、靶向性及生物相容性提升”的核心攻关。
基因递送载体作为介导外源基因进入靶细胞的关键工具,其靶向识别效率、外源基因装载容量、体内免疫原性水平及规模化制备的稳定性,直接决定了基因药物能否实现“精准靶向递送、持续稳定表达、生物安全可控”的核心研究目标,更是当前限制基因治疗从基础研究向临床转化的核心技术瓶颈。
一、 基因递送系统的核心评价维度
一款优质的基因递送系统需满足"递得准、留得住、没风险"的核心目标,行业内主要通过四大维度进行综合评估:
靶向性:能否跨越生物屏障,精准定位靶组织或靶细胞,减少脱靶效应;
装载量:可稳定携带外源基因的最大长度,直接决定其对大型基因治疗的适配性;
免疫原性:引发机体免疫反应的强度,影响重复给药可行性与治疗安全性;
生产成本:规模化制备的技术成熟度与经济可行性,是临床转化的关键考量。
这四大维度相互制衡,构成了载体选择的核心决策框架,不存在适用于所有场景的"万能载体",仅存在匹配具体需求的"最优解"。
二、 病毒载体:高效递送的天然利器
病毒载体凭借亿万年进化形成的核酸递送机制,成为基因治疗中高效递送的标杆,已在多款获批药物中得到验证。根据其生物学特性与临床应用场景,主流病毒载体可分为四类:
(一)腺相关病毒(AAV)
AAV是目前临床转化最成熟的病毒载体之一,核心优势在于免疫原性极低且宿主范围广泛,可同时感染分裂细胞与非分裂细胞。通过不同血清型的选择,AAV可实现精准组织靶向——AAV8对肝脏具有高度特异性,AAV2则更倾向于靶向骨骼肌,这种天然靶向性使其在局部治疗中具备独特优势。 在临床应用中,AAV载体已取得突破性成果,全球已有十余款相关药物获批上市,在脊髓性肌萎缩症(SMA)、血友病B等遗传性疾病治疗中展现出明确疗效。其局限性主要在于装载量有限(约4.7kb),难以承载大型基因,限制了其在复杂遗传病治疗中的应用。不过,通过载体串联技术,目前已实现多个AAV载体对长片段基因的高效递送,一定程度上突破了这一瓶颈。
(二)腺病毒(AdV)
腺病毒以高转染效率和大容量装载(可达36kb)为核心优势,可容纳多基因表达盒,适合复杂治疗方案的递送。但其显著短板是免疫原性较强,易引发机体炎症反应,这一特性限制了重复给药的可行性,但在肿瘤治疗中反而成为优势——溶瘤腺病毒可通过激发局部免疫反应,实现对肿瘤细胞的双重杀伤。 在应用场景上,腺病毒的发展路径呈现多元化:在肿瘤治疗中,可作为溶瘤病毒直接杀伤肿瘤细胞,或递送p53等抑癌基因;在疫苗领域,阿斯利康、强生的COVID-19疫苗验证了其快速转化潜力;在联合治疗中,AdV与非病毒载体的组合策略已成为研究热点,通过AdV快速转染肿瘤细胞表达治疗基因,配合其他载体激活免疫细胞,强化治疗效果。
(三)慢病毒(LV)
慢病毒的核心特性是可将外源基因稳定整合至宿主基因组,实现治疗基因的长期、持续表达,这一特性使其成为需要终身治疗的遗传性疾病的理想选择。其宿主细胞范围广泛,尤其适合干细胞、神经元等难转染细胞的修饰,在细胞治疗领域占据核心地位。 在临床转化中,慢病毒是CAR-T疗法的主流载体,通过介导CAR基因转染T细胞,赋予其持续杀伤肿瘤细胞的能力;在血液系统疾病治疗中,经慢病毒修饰的造血干细胞可使β-地中海贫血患者摆脱输血依赖,血红蛋白水平长期维持正常。慢病毒的主要风险在于潜在插入突变风险,虽概率极低,但仍需在临床应用中进行长期安全性监测。
(四)逆转录病毒(RV)
作为早期开发的整合型载体,逆转录病毒具有免疫原性低的优势,但局限性十分显著:仅能感染分裂期细胞,且整合位点偏好性差,致癌风险相对较高。随着慢病毒技术的发展,逆转录病毒已逐渐被替代,目前仅在少数血液疾病的自体治疗中有限应用。
三、 非病毒载体:安全可控的后起之秀
随着对治疗安全性要求的提升,非病毒载体凭借低免疫原性、无整合风险、制备灵活等优势,成为基因递送领域的重要发展方向,尤其在mRNA疗法、儿童疾病治疗等场景中展现出独特价值。主流非病毒载体包括以下四类:
(一)脂质纳米颗粒(LNP)
LNP是近年来关注度最高的非病毒载体,更是mRNA疗法的核心递送工具。其核心结构为脂质双分子层,可有效保护核酸免受核酸酶降解,通过优化脂质组成(如阳离子胆固醇与阳离子辅助脂质的组合,即LNP++),可实现靶向性突破,目前已实现肺/肝递送比4.8:1的精准靶向效果。
(二)聚合物载体
以聚乙烯亚胺(PEI)、聚乳酸-羟基乙酸共聚物(PLGA)为代表的聚合物载体,凭借生物相容性好、可降解、免疫原性低且无整合风险的核心优势,在特殊人群与特殊部位治疗中具有不可替代的价值。其中,PLGA的生物可降解性使其适合儿童及中枢神经系统疾病治疗,可减少长期蓄积带来的安全风险。 聚合物载体的主要挑战在于转染效率低于病毒载体,且部分材料存在一定细胞毒性。为解决这一问题,研究人员通过化学修饰、靶向分子偶联等技术手段,不断优化聚合物的结构与性能,力求实现转染效率与安全性的平衡,目前已在局部治疗场景中取得初步进展。
(三)裸核酸
裸核酸是最简单的基因递送形式,仅由裸露的DNA或RNA组成,核心优势在于制备简单、成本极低,无需复杂的载体修饰与制备工艺。但其局限性也十分突出:易被核酸酶降解,且转染效率极差,仅能在特定场景中应用——如肌肉注射疫苗通过局部滞留实现短期低水平基因表达,或眼部局部治疗通过避开全身核酸酶环境发挥作用。
(四)细菌载体
细菌载体是一类具有靶向治疗潜力的新型载体,以减毒沙门氏菌为代表,其核心特性是可靶向肿瘤缺氧微环境,并同时激发机体免疫应答,实现"治疗+免疫激活"的双重效果。在结直肠癌等实体瘤治疗中,细菌载体可穿透肿瘤组织屏障,精准定植并释放治疗基因,展现出独特的应用前景。 目前,细菌载体仍处于临床前研究阶段,主要挑战在于减毒后仍存在感染风险,且靶向性与安全性的平衡尚未完全解决。随着基因工程技术的发展,通过改造细菌的毒力基因与靶向元件,有望进一步提升其临床应用的可行性。
四、 载体选择的核心逻辑与临床适配原则
基因治疗载体的选择本质是多因素综合决策的过程,需结合疾病类型、治疗目标、靶细胞特性及临床应用需求等维度建立科学逻辑,以下为三大典型临床场景的载体适配原则:
(一)疾病导向的载体选择
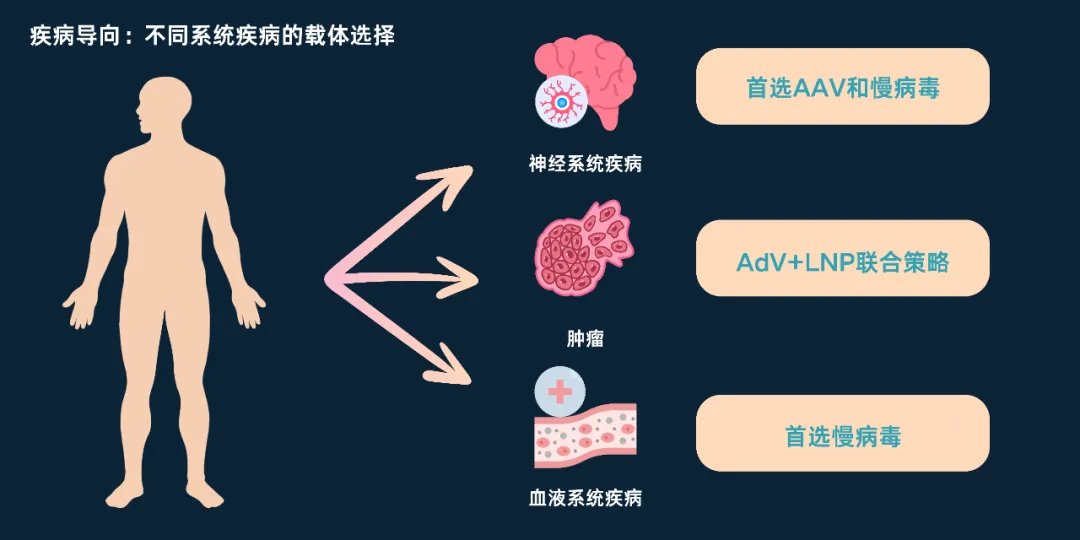
神经系统疾病:血脑屏障的存在与神经细胞的非分裂特性,决定了AAV和慢病毒为首选载体。AAV的低免疫原性适合鞘内注射,在SMA治疗中已验证疗效;慢病毒的整合特性则适合终身治疗需求,为帕金森病等神经退行性疾病提供了新的治疗方向。
肿瘤:血液肿瘤治疗以慢病毒为核心载体的CAR-T技术为主,已形成成熟的临床应用体系;实体瘤治疗则呈现多元化策略,溶瘤腺病毒的直接杀伤、AAV的肝靶向局部治疗、AdV与LNP的联合策略均在探索中,其中联合策略通过协同作用强化抗肿瘤效果,成为研究热点。
血液系统疾病:慢病毒是造血干细胞修饰的首选载体,其整合特性确保治疗基因在造血干细胞分化过程中稳定遗传,在β-地中海贫血、白血病等疾病治疗中已实现摆脱输血依赖或长期缓解的临床目标。
(二)表达需求导向的载体选择
短期表达需求:腺病毒与LNP适配性最佳。腺病毒可在数小时内启动基因表达,适合肿瘤免疫治疗、急性感染等需要快速起效的场景;LNP的安全性更优,适用于血友病急性出血等蛋白替代治疗,两者均无整合风险,表达持续时间为数周至数月。
长期整合需求:慢病毒是遗传性疾病的首选,可实现一次治疗终身获益;若顾虑整合风险,AAV的附加体表达模式(在非分裂细胞中可持续表达数年)是理想替代方案。
大片段基因递送:腺病毒(36kb装载量)可满足多数大片段基因需求;对于超大型目的基因(150kb以上),疱疹病毒是更优选择;而通过AAV载体串联技术,也可实现长片段基因的高效递送。
五、 技术发展趋势与未来展望
基因递送系统的技术迭代始终围绕"提升效率、增强靶向、降低风险、控制成本"四大核心目标展开。在病毒载体领域,AAV的衣壳进化、腺病毒的免疫原性降低、慢病毒的安全性优化将持续推进,进一步拓展其临床应用边界;在非病毒载体领域,LNP的多器官靶向技术、聚合物载体的智能修饰、细菌载体的减毒与靶向优化将成为研究重点,有望突破现有技术瓶颈。 从临床转化视角看,载体联合策略与个性化载体设计将成为重要发展方向——如针对特定肿瘤的AdV+LNP联合治疗、穿越血脑屏障的AAV变体、适配肺部疾病的LNP递送系统等,这些精准化技术方案将推动基因治疗向更广泛的疾病领域拓展。 作为基因治疗的"最后一公里",基因递送系统的技术突破直接决定了基因药物的临床价值。随着技术平台的成熟与规模化生产技术的进步,载体的生产成本将逐步降低,技术可及性将不断提升。未来,通过多学科交叉融合,基因递送系统将实现从"适用"到"精准适配"的跨越,为更多遗传病、肿瘤、感染性疾病提供治愈性治疗方案,推动基因治疗进入普惠化时代。












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


