一、摘要与引言
肺癌是全球范围内发病率位居第二且癌症相关死亡率最高的恶性肿瘤,其复杂的肿瘤生态系统涵盖多种免疫细胞类型。研究表明,骨髓来源细胞,尤其是巨噬细胞,在疾病进展过程中扮演关键角色。为进一步探究肺腺癌(LUAD)与肺鳞癌(LUSC)肿瘤微环境的细胞构成与分子特征,本研究整合单细胞转录组测序与空间转录组技术,对25例未经治疗患者的约90万个细胞进行了系统性分析。
研究发现,肿瘤微环境中抗炎表型巨噬细胞与自然杀伤细胞及T细胞之间呈现显著的负相关关系,且肿瘤内部自然杀伤细胞的细胞毒性功能明显减弱。尽管LUAD与LUSC在主要细胞类型组成上较为相似,但在多种免疫检查点分子共表达模式方面存在显著差异。此外,研究进一步揭示了肿瘤相关巨噬细胞发生转录重编程的证据,表现为其向胆固醇输出表型转化,并呈现出与胎儿发育阶段相似的铁离子外排相关转录特征。
本研究构建的多组学数据资源,为深入解析肿瘤相关巨噬细胞的高分辨率分子图谱提供了重要基础,进一步阐明了其在肿瘤微环境中的功能调控机制,并为针对肿瘤免疫微环境的新型治疗策略开发提供了理论依据。
二、样本采集与多组学数据构建
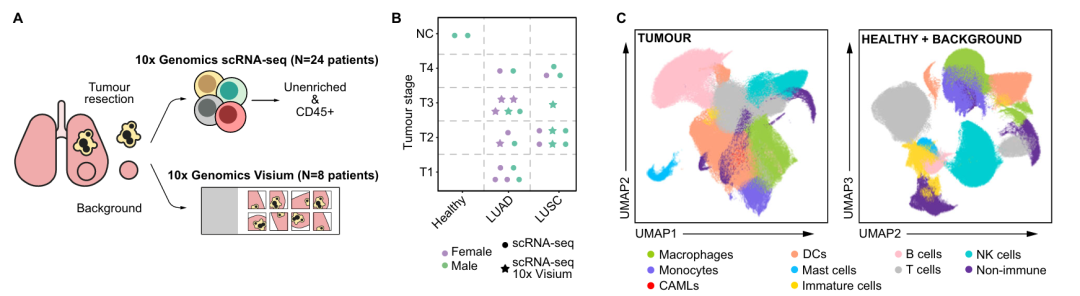
为系统揭示非小细胞肺癌(NSCLC)主要亚型——肺腺癌(LUAD)和肺鳞癌(LUSC)中免疫及非免疫细胞群体的异质性及其空间组织结构,本研究收集了25例未接受术前治疗患者的手术切除肺组织样本,其中包括13例LUAD、8例LUSC以及4例未进一步分类的肺癌样本。同时,研究纳入了2例健康捐献者的肺组织作为正常对照。所有样本均包含肿瘤区域及其匹配的癌旁非肿瘤组织。
通过流式分选技术富集CD45⁺免疫细胞,并去除红细胞以保留非免疫细胞群体,进而完成单细胞RNA测序。此外,从上述队列中选取8例患者(涵盖肿瘤与癌旁组织)制作组织切片,采用10x Genomics Visium平台进行空间转录组分析,共计获得36张有效切片数据。经过严格的质量控制与标准化分析流程,最终建立了包含近90万个高质量细胞的单细胞及空间转录组整合图谱。
三、肿瘤微环境的细胞多样性及功能状态解析
单细胞转录组分析鉴定出具有典型转录特征的多个细胞类群,涵盖髓系细胞、淋巴细胞以及非免疫细胞。与癌旁组织相比,肿瘤组织在免疫及非免疫细胞组成上呈现显著差异。肿瘤组织中成纤维细胞与淋巴管内皮细胞的比例显著下降,而上皮细胞群体表现出更高异质性,提示其由突变肿瘤细胞与正常细胞混合组成,且肿瘤转化驱动了上皮细胞状态的多样化。此外,肿瘤组织中单核细胞与未成熟髓系细胞比例显著降低,而树突状细胞与B细胞总体比例升高。
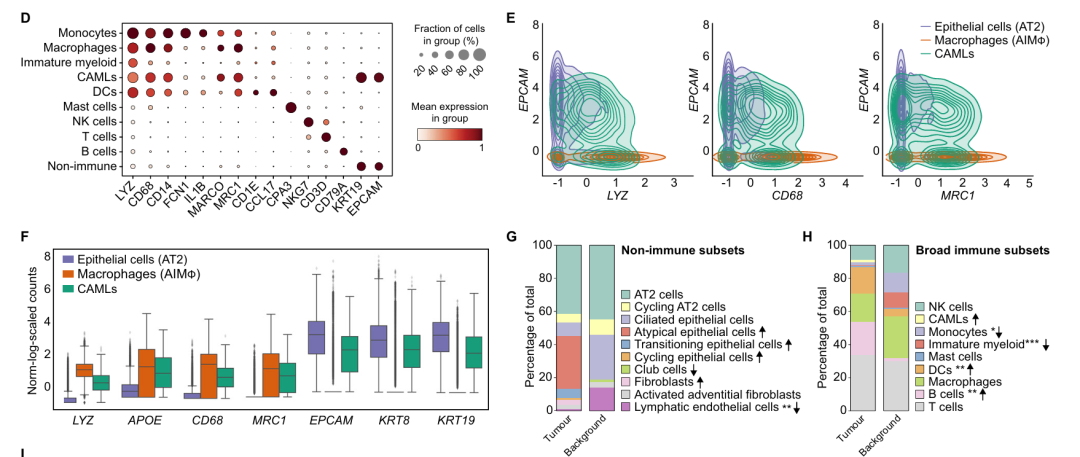
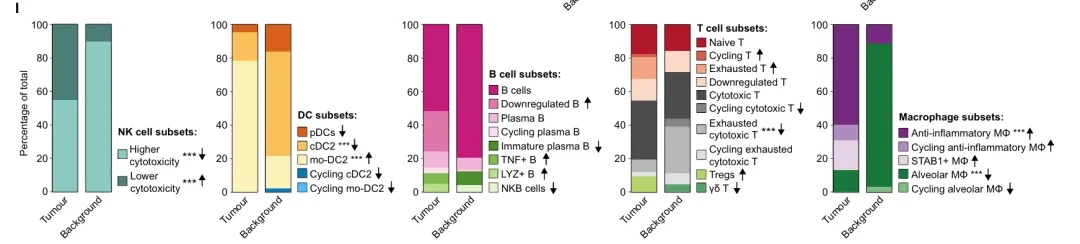
通过对主要细胞类群进行亚聚类分析,共鉴定出46种细胞亚型,并揭示了关键功能群体的变化:肿瘤组织中低细胞毒性表型的自然杀伤细胞比例升高;调节性T细胞明显积累,而耗竭型细胞毒性T细胞比例下降;肿瘤内高度异质性的抗炎型巨噬细胞比例上升。值得注意的是,其中一类具有循环特征的STAB1⁺巨噬细胞亚群的比例,与T细胞及自然杀伤细胞的频率呈显著负相关,提示其在抑制细胞毒性淋巴细胞浸润中的关键作用。此外,在肿瘤组织中成功鉴定出一类同时表达髓系与上皮标志的“癌症相关巨噬细胞样细胞”,其独特转录谱并非由技术伪影所致。
四、肺腺癌与肺鳞癌细胞互作网络的异质性及其治疗意义
尽管LUAD与LUSC在肿瘤微环境的细胞构成上高度相似,但基于配体-受体互作的分析发现,二者在细胞间通信网络上存在本质差异。LUAD中推断出的特异性互作对数量显著多于LUSC。更为重要的是,多种免疫检查点分子在两种亚型中存在差异共表达模式,例如TIM3、DNAM1–TIGIT轴在LUAD中更活跃,而CD96–NECTIN1在LUSC中更普遍。本研究未在互作网络中检测到显著的PD1–PDL1信号,提示其他免疫检查点(如CTLA4、TIGIT、LILRB1/2和TIM3)可能具有更重要的靶向治疗潜力。
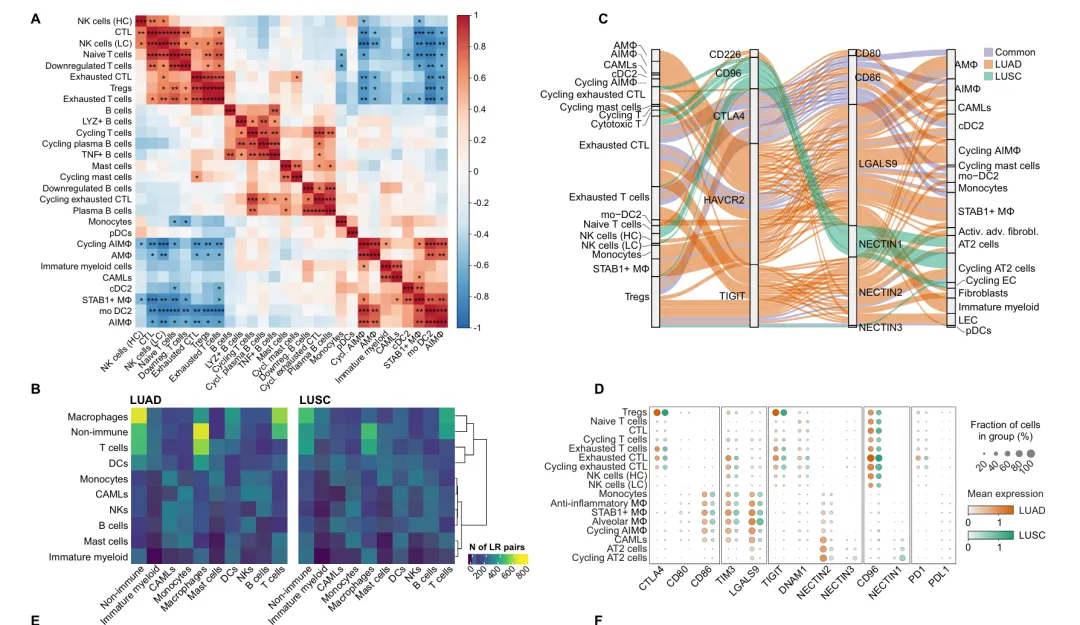
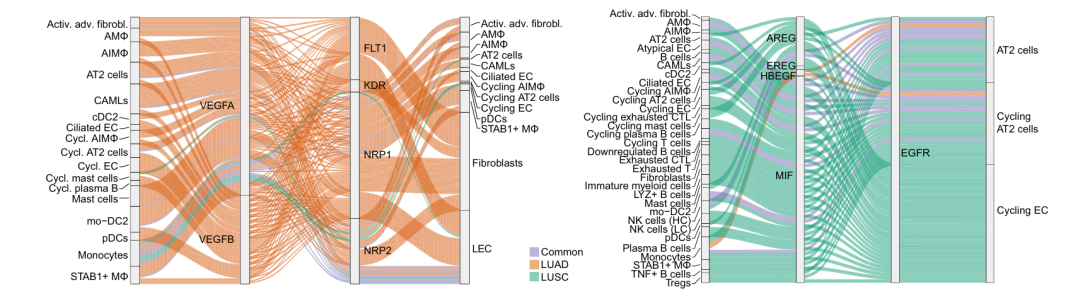
此外,研究揭示了亚型特异的促血管生成信号(VEGF通路受体在LUAD成纤维细胞中高表达)与上皮生长信号(EGFR配体通路在LUSC中更活跃)的差异。同时,识别出多个与三级淋巴结构形成相关的共刺激信号分子对,为理解患者预后差异提供了线索。这些发现系统阐明了两种肺癌亚型在微环境通信网络层面的异同,为开发精准免疫治疗策略提供了新的分子依据。
五、总结
本研究通过整合单细胞及空间转录组学,系统描绘了非小细胞肺癌主要亚型的肿瘤免疫微环境高分辨率图谱。主要发现包括:1)LUAD与LUSC具有高度相似的细胞组成,但细胞间相互作用网络存在显著差异;2)肿瘤微环境中存在复杂的免疫抑制生态,其特征为抗炎巨噬细胞的扩增及其与细胞毒性淋巴细胞功能的负相关关系;3)肿瘤相关巨噬细胞经历了独特的转录重编程;4)两种亚型在免疫检查点、血管生成及上皮生长信号网络方面呈现差异化表达模式,提示了超越PD1/PDL1的潜在治疗靶点。
综上所述,本研究构建的多组学资源,不仅深化了对非小细胞肺癌免疫微环境异质性与免疫抑制机制的理解,也为基于肿瘤亚型及微环境特征设计下一代免疫联合疗法提供了关键的数据支持和理论框架。
六、空间组学服务哪里有?
LabEx为您提供前沿、全面的空间组学整体解决方案。我们基于10x Genomics Visium、Nanostring GeoMx DSP及多重荧光成像等先进技术平台,能够将组织样本中完整的形态学信息与高通量转录组或蛋白组数据精准结合,在保留原始空间位置的同时,揭示细胞类型、基因表达及信号通路的原位分布图谱。
|
服务类型 |
种属 |
Panel说明 |
|
空间蛋白检测 |
人 |
使用NGS 平台在空间水平同时分析570+蛋白靶标.支持添加额外40个蛋白靶标涵盖77条功能通路.覆盖肿瘤研各个方面 |
|
应用领域 |
免疫调控/炎症、肿瘤/免疫研究、细胞功能研究、T细胞研究、信号通路研究等 |
|
|
人全转录组图谱(WTA) |
人 |
人全转录组图谱覆盖人的全转录组,可以在在单个组织切片中同时分析 18,000 多个基因的 RNA 表达。 |
|
小鼠全转录组图谱(Mu WTA) |
小鼠 |
小鼠全转录组图谱覆盖所有小鼠品系的全转录组,可以在在单个组织切片中同时分析21,000 多个基因的 RNA 表达。 |
|
癌症转录组图谱(CTA) |
人 |
癌症转录组图谱用于对肿瘤生物学、肿瘤微环境和免疫反应进行全面分析,可以在在单个组织切片中同时分析 1,800 多个基因的RNA表达。 |
|
犬癌症图谱 |
犬 |
犬癌症图谱用于研究犬对癌症以及免疫生态学治疗的免疫反应,可以在单个组织切片中同时分析1,962多个基因的 RNA 表达。 |
|
空间多组学数据分析 |
不限 |
提供标准化及定制化数据分析,包括箱型图、散点图、火山图、条形图等多种展示 |












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


