一、引言
肝细胞癌是全球范围内致死率位列第三的恶性肿瘤,其发病机制复杂,与肿瘤微环境的高度异质性密切相关。近年来,以单细胞RNA测序和空间转录组学为代表的高通量技术,为深入解析肝脏生理、病理状态下的细胞多样性、空间结构及互作网络提供了革命性工具。本文在总结该领域最新进展的基础上,系统梳理了单细胞与空间转录组学在肝脏发育、功能分区、疾病机制以及肿瘤异质性研究中的应用,并对技术整合的未来方向进行展望。
 scRNA-seq工作流程的主要步骤和最常用技术的比较
scRNA-seq工作流程的主要步骤和最常用技术的比较
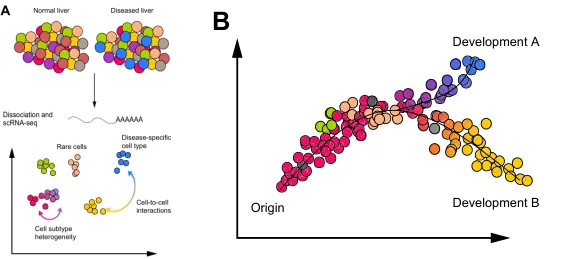 单细胞RNA测序分析研究肝脏病理生理
单细胞RNA测序分析研究肝脏病理生理
二、单细胞RNA测序揭示肝细胞癌干细胞的分子与功能异质性
原文信息
英文标题:Single cell analysis reveals cancer stem cell heterogeneity in hepatocellular carcinoma
发表杂志:Hepatology, 2018
影响因子:14.079
实验材料:流式分选HuH1/HuH7细胞系肝细胞群体;分选肝肿瘤细胞P1
实验方法:免疫荧光染色、流式分选、Smart-seq、10x Genomics scRNA-seq
研究背景
肝细胞癌的肿瘤内异质性在一定程度上源于肝癌干细胞的持续存在。然而,由于不同细胞表面标志物所定义的肝癌干细胞群体在致癌驱动机制上可能存在差异,这为明确其分子靶向治疗策略带来了挑战。本研究基于10x Genomics单细胞转录组测序平台,对分选的HuH1/HuH7细胞系以及肝肿瘤组织样本(P1)中的细胞进行高分辨率转录组分析,并结合免疫荧光染色与流式分选技术,在单细胞水平整合转录组学与功能学数据,系统评估肝癌干细胞的异质性程度。
研究内容与结论
研究结果表明,肝癌干细胞在单细胞层面存在显著的表型、功能及转录异质性。不同肝癌干细胞亚群具备独立的分子特征,且其差异表达的基因与肝癌患者预后密切相关,提示这些亚群在推动肿瘤内异质性及疾病进展中具有重要作用。本研究为深入理解肝癌干细胞亚群的多样性提供了新的视角,其揭示的分子异质性进一步强调了该类细胞在肿瘤异质性形成、预后判断及靶向治疗中的关键意义。
 10x肝实质细胞转录图谱
10x肝实质细胞转录图谱
三、基于多组织单细胞测序的肝细胞癌免疫微环境动态图谱
原文信息
英文标题:Landscape and Dynamics of Single Immune Cells in Hepatocellular Carcinoma
发表杂志:Cell, 2019
影响因子:38.637
实验材料:16例肝细胞癌患者(男13例,女3例),分选自肿瘤、癌旁肝、淋巴结、外周血及腹水的CD45+细胞
实验方法:scRNA-seq(10x Genomics)、Smart-seq2、流式分选
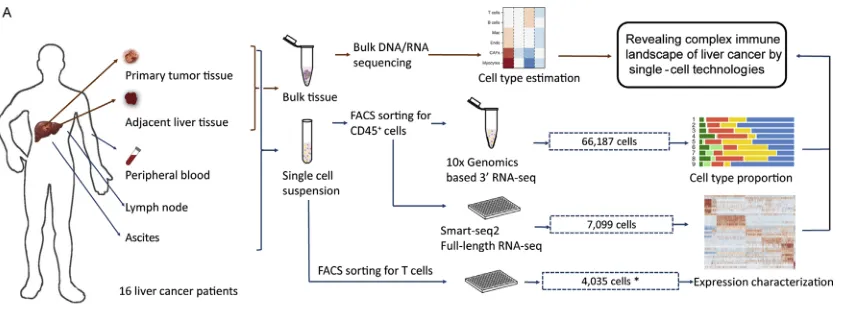
研究背景
在肿瘤免疫学研究中,癌旁组织与外周血常被用作主要对照,而对其他与免疫密切相关的组织或病理部位(如腹水)的关注则相对不足。腹水作为肝细胞癌患者常见的病理产物,其形成往往与不良预后相关,但其中免疫细胞的组成特性及其与肝癌发展的关联尚未被充分阐明。为系统解析肝癌的免疫微环境,本研究从16例肝细胞癌患者中,获取了包括肿瘤组织、癌旁肝组织、引流淋巴结、外周血以及腹水在内的五类样本,并分选出CD45+免疫细胞进行高分辨率单细胞转录组测序,旨在全面描绘肝癌免疫细胞类型、分子表达特征,以及不同组织间免疫细胞的动态分布与功能联系。
研究结论
研究发现,LAMP3+树突状细胞可能代表一类成熟态的传统树突状细胞,具备从肿瘤组织向淋巴结迁移的潜在能力。该细胞亚群表达多种免疫调控相关配体,显示出调节不同淋巴细胞亚群功能的潜力。在肿瘤相关巨噬细胞中,存在具有不同转录状态的亚群,其中特定TAM群体与患者不良预后显著相关,并提示SLC40A1与GPNMB基因可能参与其炎症调控功能。此外,研究证实腹水中的髓系细胞和淋巴细胞分别主要来源于肿瘤局部和血液循环。本研究所揭示的CD45+免疫细胞在多组织间的动态分布与功能异质性,为深入理解肝细胞癌的免疫景观增添了新的维度。
 肝癌中CD45 +免疫细胞的景观
肝癌中CD45 +免疫细胞的景观
四、单细胞与空间转录组学在肝脏生理病理及细胞互作研究中的新进展
原文信息
英文标题:Single-cell genomics and spatial transcriptomics: Discovery of novel cell states and cellular interactions in liver physiology and disease biology
发表杂志:Hepatology 2020
影响因子:20.582
研究结论
单细胞RNA测序的早期重要应用之一是研究小鼠与人类肝脏的组织分区。然而,该技术在应用于肝脏生理学研究时面临的主要挑战,是如何将单细胞水平RNA数据与其在组织中的空间位置信息相整合。为此,目前已开发出多种针对性的测序策略与生物信息学分析方法,从而推动了对肝脏分区的全新认识。例如,通过结合单细胞RNA测序与单分子RNA荧光原位杂交技术,研究者实现了对小鼠肝脏分区的高分辨率空间转录组分析。相关进展表明,不仅可从单细胞数据中推断空间分布信息,也可通过原位空间转录组学精确鉴定肝细胞与肝窦内皮细胞等细胞类型在肝脏中的区域化分布特征。
此外,单细胞RNA测序技术也成功应用于:鉴定肝脏发育与再生过程中的祖细胞群;描绘慢性肝病与肝硬化阶段非实质细胞的表型变化;阐明肝癌上皮细胞与肿瘤微环境间的相互作用机制;以及揭示肝细胞癌内部肿瘤微环境的异质性。这些研究拓展了对肝脏生理与病理状态下细胞状态多样性及细胞间通讯网络的理解。
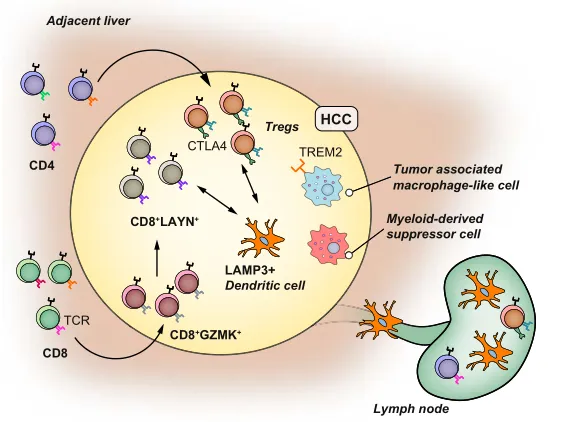 scRNA-seq了解肝细胞癌的肿瘤微环境
scRNA-seq了解肝细胞癌的肿瘤微环境
五、基于单细胞转录组学解析肝脏实质与非实质细胞谱系的早期发育轨迹
原文信息
英文标题:Single-cell transcriptomics reveals early emergence of liver parenchymal and non-parenchymal cell lineages
发表杂志:Cell 2020
影响因子:38.637
实验材料:小鼠胚胎15个样本,涵盖E7.5(内胚层祖细胞)、E8.75(内胚层肠管道)、E9.5(肝内胚层)及E10.5(肝内胚层)四个发育阶段
实验方法:scRNA-seq(10x Genomics)、流式分选、免疫荧光
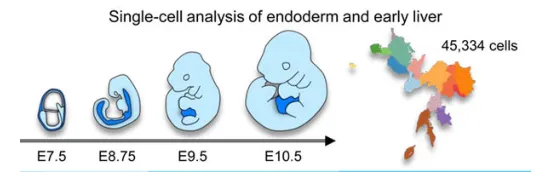
研究背景
肝脏作为一高度复杂的多功能器官,其构成细胞来源于内胚层及中胚层。目前,对于这些细胞如何在发育过程中有序组织并形成功能必需的多种实质细胞与非实质细胞,以及它们如何从各自祖细胞起源、并在肝脏形成过程中产生相互作用,仍缺乏系统性认识。这一知识缺口限制了对肝脏发育机制的深入理解。
研究内容与结论
本研究通过单细胞转录组测序技术,对小鼠胚胎从E7.5至E10.5四个关键发育时期的15个样本进行分析,系统解析了肝脏细胞谱系的早期分化过程。研究发现,在肝脏发育早期,内皮细胞、间充质细胞及肝细胞已呈现出明显的多样性,并进一步构建了完整的内皮细胞与肝细胞谱系的发育时间图谱。该研究为理解肝脏从内胚层和中胚层起源逐步建立细胞谱系的过程提供了全面、高分辨率的单细胞发育图谱,揭示了肝实质与非实质细胞谱系在胚胎早期的动态出现与分化轨迹。
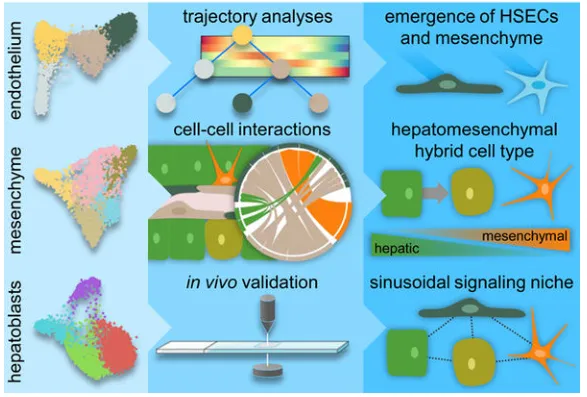 scRNA-seq显示小鼠内胚层和中胚层肝细胞谱系
scRNA-seq显示小鼠内胚层和中胚层肝细胞谱系
六、总结
在多细胞器官如肝脏中,组织稳态依赖于不同细胞类型间精细协调的相互作用。单细胞技术虽能揭示分子异质性,但缺乏空间背景则难以阐明细胞群体如何协同调控组织功能。通过整合空间转录组学、单细胞基因表达及染色质可及性数据,可以构建高分辨率的多组学图谱,揭示细胞谱系与特定功能区域(如损伤、修复与重塑区)的关联,这是在传统单细胞分析中难以实现的。
综上所述,结合空间与单细胞转录组策略,显著提升了在转录组与表观基因组层面对肝脏细胞组成和功能的空间解析能力。这些技术为系统描绘肝脏生理与病理状态下的细胞图谱、解析疾病机制、发现新的生物标志物与治疗靶点提供了强大的工具与框架,并将持续推动肝脏生物学研究与精准医疗的发展。












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


