一、文献背景概述
该研究发表于2025 年 4 月,刊载于国际民族药理学领域权威期刊《Journal of Ethnopharmacology》(影响因子 5.4),文章标题为 “Lianhua qingke alleviates cigarette smoke induced cellular senescence in COPD mice by regulating the Sp1/SIRT1/HIF-1α pathway”。研究团队由北京大学人民医院(中医科、呼吸与危重症医学科)、山西医科大学胸腔疾病研究所、临汾市中心医院、河北省中西医结合医药研究院等多单位联合组成,核心研究聚焦中药复方连花清咳(LHQK)在慢性阻塞性肺疾病(COPD)中的治疗机制,尤其围绕细胞衰老调控通路展开深入探索。
二、摘要解读
该研究旨在阐明连花清咳(LHQK)治疗 COPD 的潜在机制,重点关注其抗细胞衰老作用。研究采用香烟烟雾(CS)暴露构建 COPD 小鼠模型,通过肺功能检测、组织病理学分析、细胞因子定量及分子生物学实验,系统评估 LHQK 对 COPD 小鼠肺部炎症、黏液分泌及细胞衰老的影响。结果显示,LHQK 含 41 种关键活性成分,口服给药可显著逆转 COPD 小鼠肺功能下降、抑制肺部炎症与黏液分泌、减轻肺气肿及肺组织病理损伤;同时,LHQK 能降低肺组织及循环系统中衰老相关分泌表型(SASP)水平,下调 SA-β-gal、miR-125a-5p、p21、p27、p53 等衰老标志物表达。网络药理学与分子实验证实,LHQK 可通过上调 Sp1 与 SIRT1 表达、抑制 HIF-1α,最终调控 Sp1/SIRT1/HIF-1α 通路缓解 COPD 小鼠细胞衰老,为 LHQK 作为 COPD 辅助治疗药物提供了实验依据。
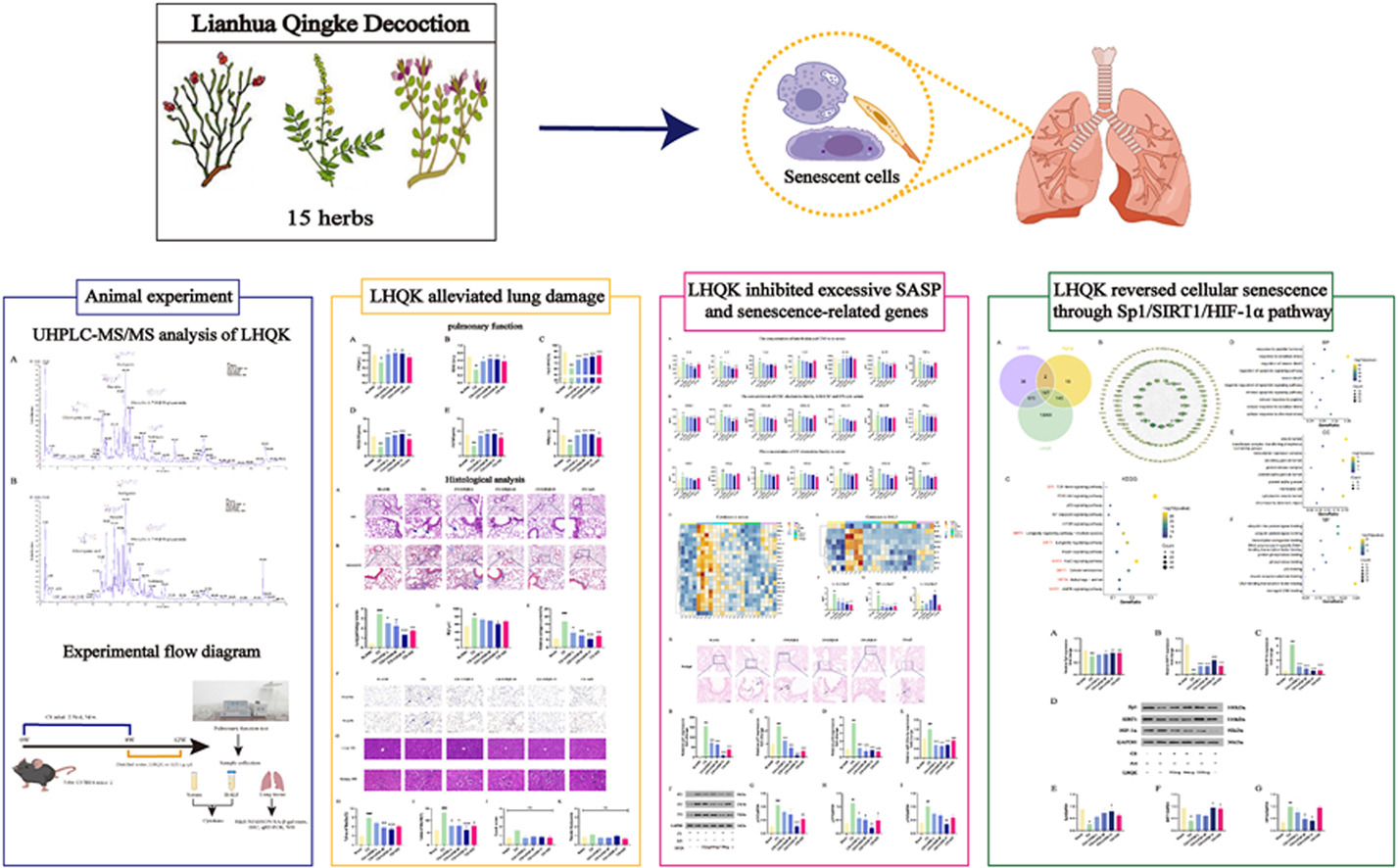
三、研究思路与结果解析
(一)连花清咳(LHQK)活性成分鉴定
研究思路
采用超高效液相色谱 - 串联质谱(UHPLC-MS/MS)技术,对 LHQK 提取物进行成分分析,明确其核心活性成分,为后续机制研究提供物质基础。
实验结果
通过 UHPLC-MS/MS 检测(图 1 为正负离子模式下的质谱色谱图),共鉴定出 LHQK 中的 41 种关键化合物,包括没食子酸、绿原酸、黄芩苷、牛蒡苷元、汉黄芩素等(详细信息见表 2)。这些成分中,部分已被报道具有抗炎、抗氧化及抗细胞衰老活性(如汉黄芩素通过抑制 CDK9/p53 通路缓解肺纤维化,牛蒡苷通过调控 p38/p53/p21 通路抑制肺泡上皮细胞衰老),为 LHQK 的药理作用提供了成分支撑。
结果总结
LHQK 含多种已知具有抗炎抗衰活性的成分,其整体药理作用可能是多成分协同调控的结果,为后续在 COPD 模型中的疗效验证奠定物质基础。
(二)LHQK 改善 COPD 小鼠体重下降与肺功能损伤
研究思路
构建 8 周香烟烟雾暴露的 COPD 小鼠模型,随后给予不同剂量 LHQK(低剂量 0.332 g/kg、中剂量 0.664 g/kg、高剂量 1.328 g/kg)及阳性药阿奇霉素(AZI,32.25 mg/kg)干预 4 周,通过动态监测体重变化及检测肺功能关键指标,评估 LHQK 对 COPD 小鼠整体状态及肺功能的保护作用。
实验结果
- 体重变化:香烟烟雾暴露导致小鼠持续体重下降,而 LHQK 高剂量组与 AZI 组小鼠体重在干预后显著回升(p<0.01,图 2B),提示 LHQK 可改善 COPD 小鼠的整体营养状态与疾病消耗。
- 肺功能指标:与空白组相比,模型组小鼠肺功能显著受损,表现为用力肺活量(FVC)、0.1 秒用力呼气量(FEV0.1)、FEV0.1/FVC 比值、50% 用力呼气流量(FEF50)、25%-75% 用力呼气中期流量(FEF25-75)及呼气峰流速(PEF)均显著降低;而 LHQK 以剂量依赖性方式逆转上述指标下降(p<0.05,图 2C-H),且高剂量组效果接近阳性药,表明 LHQK 可有效缓解 COPD 小鼠的气流受限症状。
结果总结
LHQK 能改善 COPD 小鼠的体重消耗,显著恢复肺功能,且具有剂量依赖性,验证了其对 COPD 的整体治疗效果。
(三)LHQK 抑制 COPD 小鼠气道炎症、重塑与黏液分泌
研究思路
通过组织病理学染色(H&E、Masson)观察肺组织病理改变,免疫组化(IHC)检测气道黏液蛋白(Muc5ac、Muc5b)表达,同时评估肝肾功能以验证 LHQK 的安全性,明确 LHQK 对 COPD 小鼠肺部病理损伤的改善作用。
实验结果
- 肺组织病理:H&E 染色显示,模型组小鼠肺组织出现肺泡壁断裂融合、肺泡腔扩大、炎症细胞浸润(图 3A 蓝色箭头),病理损伤评分显著升高;Masson 染色显示气道周围及间质胶原沉积增加,提示气道重塑(图 3B);LHQK 干预后,肺组织病理损伤评分降低、平均线性截距(MLI,评估肺气肿程度)减小、胶原沉积比例下降,且呈剂量依赖性(p<0.05,图 3C-E),表明 LHQK 可减轻肺气肿与气道重塑。
- 黏液分泌:IHC 结果显示,模型组小鼠肺组织中 Muc5ac(病理性黏液蛋白)与 Muc5b(生理性黏液蛋白)表达均显著升高(p<0.001,图 3F);LHQK 以剂量依赖性方式抑制二者表达,尤其对 Muc5ac 的抑制更显著(图 3H-I),提示 LHQK 可调节气道黏液分泌平衡,减少病理性黏液潴留。
- 安全性验证:H&E 染色显示,各剂量 LHQK 组小鼠肝、肾组织无明显病理损伤,Suzuki 评分(肝损伤)与肾小管损伤评分均无显著差异(p>0.05,图 3G、J、K),证实 LHQK 在有效剂量范围内安全性良好。
结果总结
LHQK 可通过减轻肺部炎症、抑制气道重塑、调节黏液分泌平衡改善 COPD 病理损伤,且无明显肝肾毒性,具备临床转化潜力。
(四)LHQK 缓解 COPD 小鼠 SASP 过度分泌与慢性炎症
研究思路
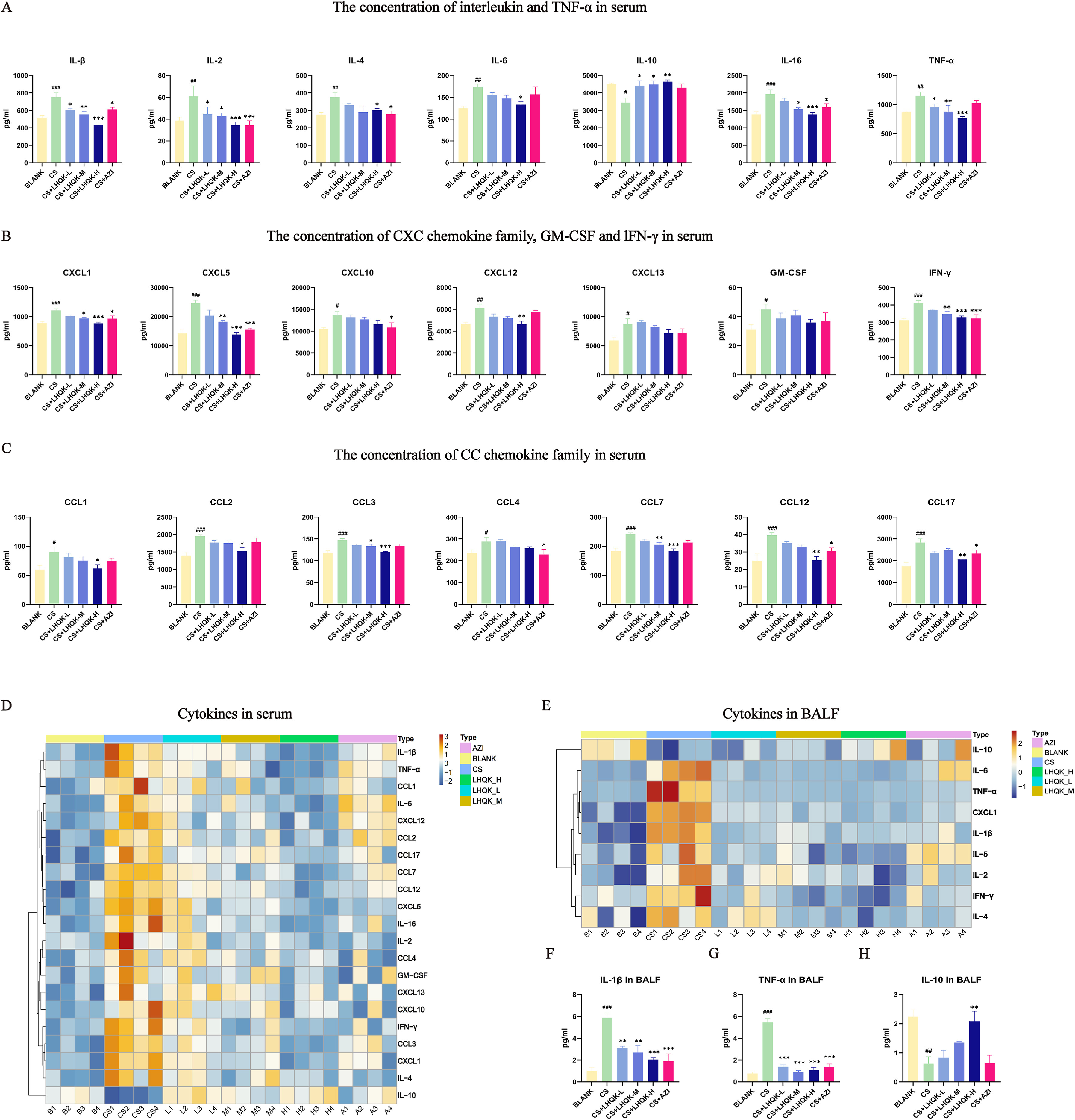
采用乐备实提供的多因子检测技术(Luminex 平台检测血清细胞因子、MSD 平台检测支气管肺泡灌洗液(BALF)细胞因子),量化 LHQK 对 COPD 小鼠循环及肺部炎症微环境中 SASP 因子的调控作用,明确其抗炎机制。
实验结果
- 血清炎症因子:模型组小鼠血清中 IL-1β、TNF-α、IL-2、IL-4、IL-6 等促炎细胞因子,以及 CXCL1/CXCL5/CXCL10(CXC 趋化因子家族)、CCL1-CCL4/CCL7/CCL12/CCL17(CC 趋化因子家族)等趋化因子水平显著升高,而抑炎因子 IL-10 降低;LHQK 以剂量依赖性方式降低促炎因子与趋化因子水平,恢复 IL-10 表达(p<0.05,图 4A-D),且效果优于阳性药 AZI(AZI 对部分 SASP 因子无显著调控作用)。
- BALF 炎症因子:MSD 检测结果与血清趋势一致,LHQK 可显著降低 BALF 中 IL-1β、TNF-α 水平,升高 IL-10 水平(p<0.05,图 4E-H),提示 LHQK 可同时调控肺部局部与全身炎症反应。
结果总结
LHQK 通过抑制 SASP 因子(促炎细胞因子、趋化因子)过度分泌、恢复抑炎因子平衡,缓解 COPD 小鼠的慢性炎症状态,且调控范围优于传统抗生素 AZI。
(五)LHQK 下调 COPD 小鼠衰老相关标志物表达
研究思路
通过 SA-β-gal 染色(细胞衰老经典标志物)、qRT-PCR(检测衰老相关基因 mRNA)及 Western blot(检测衰老相关蛋白),从细胞、基因、蛋白三个层面验证 LHQK 对 COPD 小鼠肺组织细胞衰老的抑制作用。
实验结果
- SA-β-gal 活性:模型组小鼠肺组织中 SA-β-gal 阳性细胞(蓝色染色)显著增多,LHQK 干预后阳性细胞数量以剂量依赖性方式减少(图 5A),直接证实 LHQK 可抑制肺组织细胞衰老。
- 衰老相关基因与 miRNA:qRT-PCR 结果显示,模型组小鼠肺组织中 p21、p27、p53(细胞周期阻滞基因,衰老标志物)及 miR-125a-5p(衰老相关 miRNA)的 mRNA 表达显著升高(p<0.001,图 5B-E);LHQK 可剂量依赖性下调上述基因与 miRNA 表达(p<0.001)。
- 衰老相关蛋白:Western blot 结果与基因表达趋势一致,模型组小鼠肺组织中 p21、p27、p53 蛋白水平显著升高,LHQK 干预后蛋白表达量显著降低(p<0.05,图 5F-I)。
结果总结
LHQK 可从细胞表型(SA-β-gal)、基因(p21/p27/p53/miR-125a-5p)及蛋白(p21/p27/p53)层面抑制 COPD 小鼠肺组织细胞衰老,为其抗 COPD 机制提供了关键证据。
(六)LHQK 通过 Sp1/SIRT1/HIF-1α 通路调控细胞衰老
研究思路
结合网络药理学(筛选 LHQK、衰老、COPD 的共同靶点与通路)与分子生物学实验(qRT-PCR、Western blot 检测通路关键分子),明确 LHQK 调控 COPD 细胞衰老的核心信号通路。
实验结果
- 网络药理学预测:Venn 图分析筛选出 LHQK、衰老、COPD 的 147 个共同靶点(图 6A),PPI 网络分析显示这些靶点主要富集于氧化应激、DNA 结合转录因子结合等生物学过程(图 6B);KEGG 富集分析显示,147 个靶点显著富集于 12 条衰老相关通路,其中 Sp1、SIRT1、HIF-1α 为核心靶点,且 Sp1/SIRT1/HIF-1α 通路被预测为关键调控通路(图 6C-F)。
- 通路分子验证:qRT-PCR 结果显示,模型组小鼠肺组织中 Sp1、SIRT1 的 mRNA 表达显著降低,HIF-1α 的 mRNA 表达显著升高(p<0.001,图 7A-C);Western blot 结果显示,模型组 Sp1、SIRT1 蛋白表达降低,HIF-1α 蛋白表达升高,LHQK 可剂量依赖性逆转上述分子的异常表达(p<0.05,图 7D-G)。
结果总结
网络药理学与分子实验共同证实,LHQK 通过上调 Sp1 与 SIRT1 表达、抑制 HIF-1α,调控 Sp1/SIRT1/HIF-1α 通路,最终抑制 COPD 小鼠肺组织细胞衰老,这是其抗 COPD 的核心机制。
四、乐备实(LabEx)关联检测技术与产品
乐备实(LabEx)的 Luminex 多因子检测技术与 MSD 超灵敏检测技术,精准量化了 COPD 小鼠血清及支气管肺泡灌洗液中 SASP 因子、促炎细胞因子及趋化因子水平,为明确连花清咳调控慢性炎症与细胞衰老的作用提供了关键数据支撑。
对应产品货号
| 产品货号 | 产品名称 | 检测指标 |
|---|---|---|
| LXLBM31-1 | 小鼠趋化因子-31因子Panel | BCA-1/CXCL13,CTACK/CCL27,ENA-78/CXCL5,Eotaxin/CCL11,Eotaxin-2/CCL24,Fractalkine/CX3CL1,GM-CSF,I-309/CCL1,IFN-γ,IL-1β,IL-2,IL-4,IL-6,IL-10,IL-16,IP-10/CXCL10,I-TAC/CXCL11,KC/CXCL1,MCP-1/CCL2,MCP-3/CCL7,MCP-5/CCL12,MDC/CCL22,MIP-1α/CCL3,MIP-1β/CCL4,MIP-3α/CCL20,MIP-3β/CCL19,RANTES/CCL5,SCYB16/CXCL16,SDF-1α/CXCL12,TARC/CCL17,TNF-α |
| LXMM10-1 | 小鼠炎症10因子Panel | IFN-γ,IL-10,IL-2,IL-4,IL-5,IL-6,TNF-α,KC/GRO,IL-1β,IL-12p70 |
参考文献:
Zhang, Yixin et al. “Lianhua qingke alleviates cigarette smoke induced cellular senescence in COPD mice by regulating the Sp1/SIRT1/HIF-1α pathway.” Journal of ethnopharmacology vol. 348 (2025): 119831. doi:10.1016/j.jep.2025.119831













 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


