疼痛作为全球范围内重大的健康负担,影响着近30%的人口,不仅给患者带来身心痛苦,更造成巨大的社会经济损失。当前临床常用的阿片类药物、非甾体抗炎药等治疗手段,因存在成瘾性、胃肠道损伤、疗效有限等问题,难以满足临床需求。深入探索疼痛发生发展的分子机制,挖掘新型精准治疗靶点,成为疼痛医学领域的研究热点。近年来,趋化因子CXCL13及其特异性受体CXCR5组成的信号通路,被证实在多种疼痛类型中发挥关键调控作用,为疼痛治疗开辟了全新方向。本文基于文章《CXCL13/CXCR5: a new target for pain treatment》(Sun S, Sun Y, Shen J, et al. CXCL13/CXCR5: a new target for pain treatment. Int J Surg. 2025 Sep 1;111(9):6318-6329. ),系统解析CXCL13/CXCR5通路在疼痛中的作用机制、核心优势及应用前景。
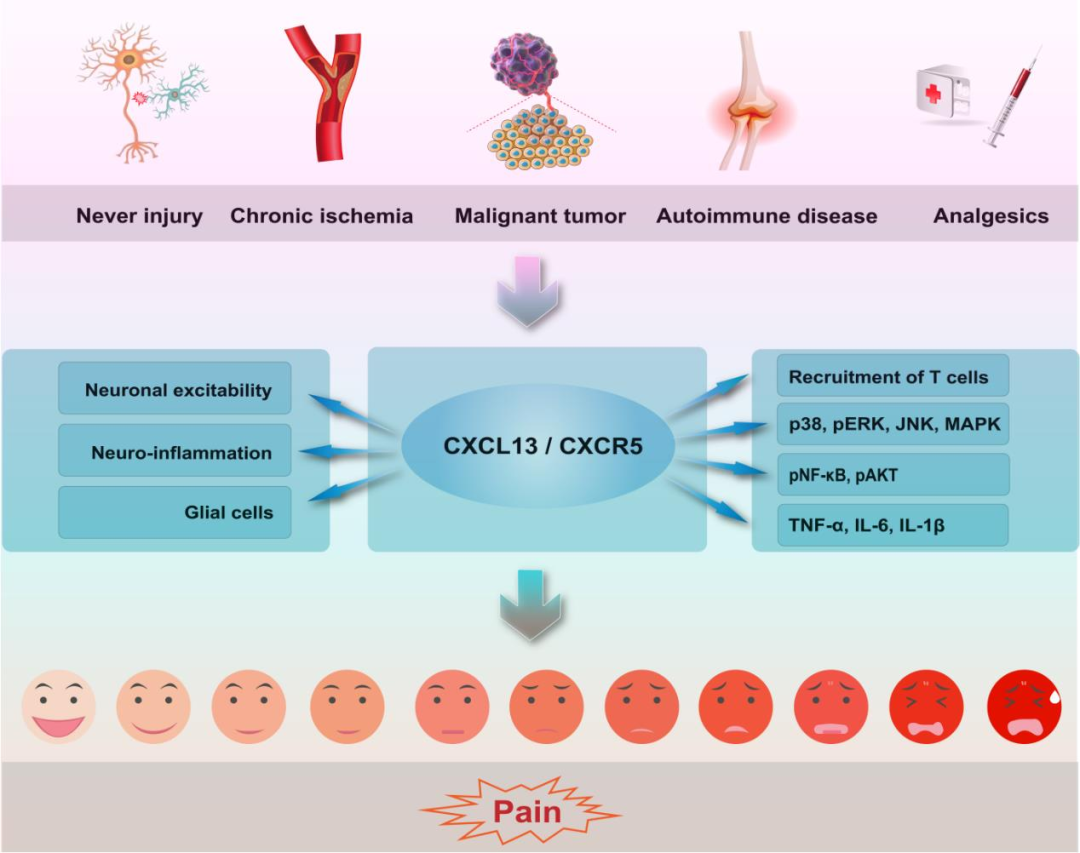
图 1:CXCL13/CXCR5 通路通过不同机制参与多种疼痛模型
一、CXCL13/CXCR5通路的生物学基础
趋化因子是一类具有趋化活性的小分子分泌蛋白家族,根据结构特征可分为CXC、CC、CX3C和C四大亚家族,广泛参与免疫调节、细胞迁移、炎症反应等多种生理病理过程。CXCL13作为CXC亚家族成员,最初被发现主要调节B细胞和T细胞的归巢与活化,近年来研究证实其在神经系统损伤与修复中同样具有重要作用。 CXCR5是CXCL13的主要受体,属于G蛋白偶联受体超家族,主要表达于免疫细胞、神经元及神经胶质细胞表面。在生理状态下,CXCL13/CXCR5通路在中枢神经系统中低水平表达;而在神经损伤、炎症、肿瘤等病理条件下,该通路在脊髓、背根神经节(DRG)、脑脊液等疼痛相关区域显著上调,通过激活下游信号 cascade 参与疼痛的发生与维持。值得注意的是,CXCL13与CXCR5的结合具有高度特异性,同时CXCL13也可与CXCR3等受体交叉结合,这种受体混杂性为其功能多样性提供了基础,也为后续研究带来了新的探索空间。
二、CXCL13/CXCR5通路在不同类型疼痛中的核心作用
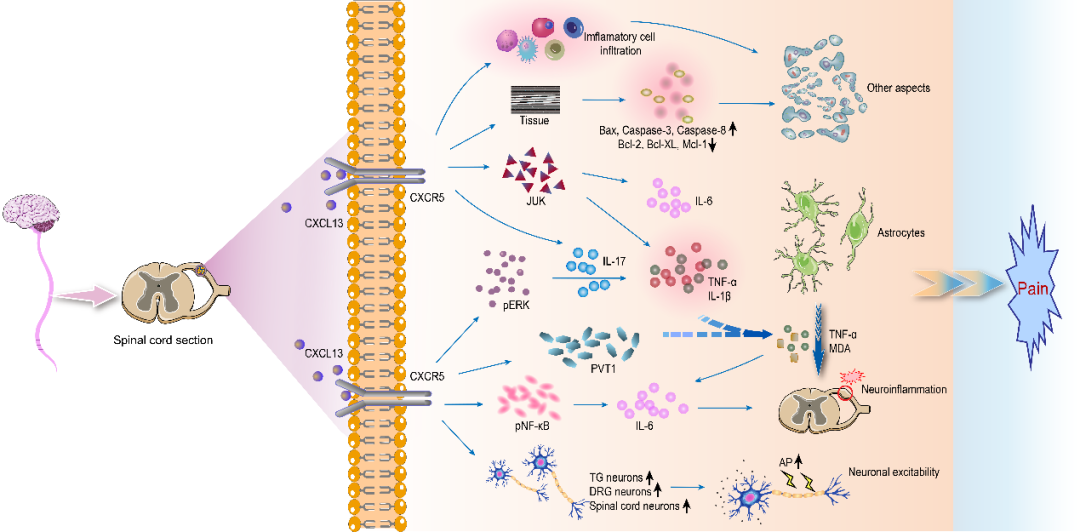
图 2:CXCL13/CXCR5 通路介导疼痛
(一)伤害性疼痛
伤害性疼痛是机体对潜在有害刺激的保护性反应,其过度激活会导致痛觉过敏。研究表明,局部给予CXCL13可呈剂量依赖性诱导热痛觉过敏和机械异常性疼痛,而使用CXCL13中和抗体或siRNA则能显著减轻这类疼痛反应。在脊髓神经结扎(SNL)模型中,CXCL13/CXCR5通路的激活是伤害性疼痛发生的关键环节,CXCR5基因敲除小鼠的疼痛超敏反应持续降低,证实该通路在伤害性疼痛信号传递中的不可或缺性。
(二)炎症性疼痛
炎症性疼痛由组织损伤或感染引发,伴随免疫细胞浸润和炎症因子释放。CXCL13/CXCR5通路通过放大炎症信号参与该类疼痛的维持:在完全弗氏佐剂(CFA)诱导的炎症模型中,DRG神经元中CXCL13 mRNA水平显著升高,通过激活CXCR5增强Nav1.8钠通道介导的神经元兴奋性,进而诱导痛觉过敏;而CXCR5缺陷小鼠的炎症性疼痛症状明显减轻。此外,在类风湿性关节炎、间质性膀胱炎等炎症相关疼痛模型中,CXCL13/CXCR5通路的上调与IL-6、TNF-α、IL-1β等促炎因子的释放密切相关,使用CXCL13选择性抑制剂TAK-799可通过抑制炎症级联反应缓解疼痛。
(三)病理性疼痛
病理性疼痛由神经系统损伤或功能异常引起,包括神经病理性疼痛、癌痛、糖尿病相关疼痛等,是临床治疗的难点。在SNL诱导的神经病理性疼痛模型中,脊髓神经元中CXCL13表达增加,脊髓星形胶质细胞中CXCR5表达上调,两者相互作用激活神经胶质细胞,放大中枢敏化;将CXCL13 siRNA显微注射到DRG中可有效减轻机械异常性疼痛和热痛觉过敏。 在骨癌疼痛模型中,CXCL13作为长链非编码RNA的下游靶标,通过CXCR5依赖性机制调节痛觉过敏的发生与维持;在2型糖尿病小鼠模型中,CXCL13/CXCR5通路的激活与糖尿病神经病变疼痛密切相关,抑制该通路可改善小鼠的触觉异常疼痛。这些研究表明,CXCL13/CXCR5通路是多种病理性疼痛的共同调控节点,具有广泛的治疗潜力。
三、CXCL13/CXCR5通路介导疼痛的分子机制
(一)调节神经元兴奋性
神经元兴奋性异常增高是疼痛发生的核心机制之一。CXCL13/CXCR5通路主要通过调控钠通道功能增强神经元兴奋性:在DRG神经元中,CXCR5与Nav1.8钠通道高度共表达,CXCL13结合CXCR5后可通过p38 MAPK信号通路增加Nav1.8电流密度,使神经元对刺激的反应性增强;在中枢层面,该通路可促进前扣带回皮层(ACC)神经元的兴奋性突触传递,增加自发性兴奋性突触后电流(sEPSCs)的频率和幅度,参与疼痛相关厌恶情绪的调控。
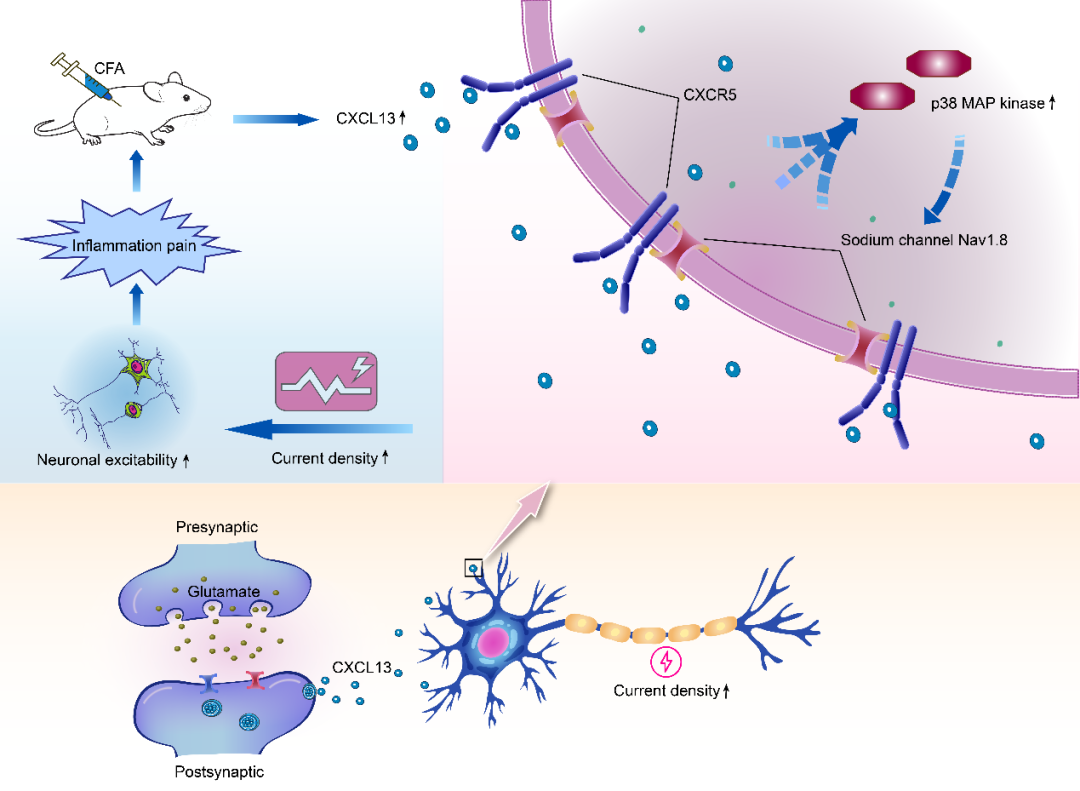
图 3:Nav1.8 通道通过 CXCL13/CXCR5 通路导致神经元过度兴奋和疼痛超敏
(二)驱动神经炎症反应
神经炎症是慢性疼痛的关键驱动因素,CXCL13/CXCR5通路通过激活多条炎症信号通路发挥作用:一方面,该通路可激活NF-κB、ERK、JNK等转录因子,促进促炎细胞因子(IL-6、TNF-α、IL-1β)的产生和释放,形成炎症放大循环;另一方面,CXCL13可通过上调主要组织相容性复合体I类(MHC I)分子,吸引CD8+ T细胞浸润到DRG神经元,加重神经功能障碍。在慢性缺血后疼痛模型中,STAT3抑制剂可通过减少CXCL13的过度产生减轻疼痛,证实STAT3-CXCL13-NF-κB通路在神经炎症相关疼痛中的关键作用。
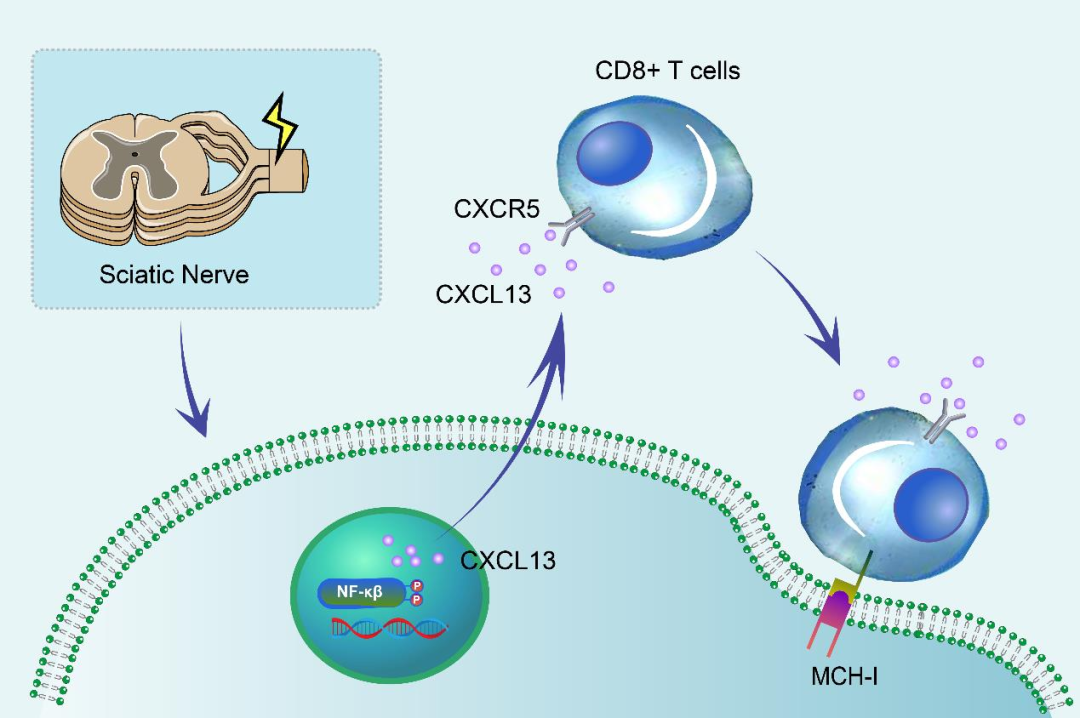
图 4:坐骨神经损伤后 DRG 感觉神经元中 NF-κB 激活通过 CXCL13/CXCR5 通路引发神经炎症
(三)调控神经胶质细胞活化
神经胶质细胞(星形胶质细胞和小胶质细胞)的激活是中枢敏化的重要基础。CXCL13/CXCR5通路可直接激活星形胶质细胞:在脊髓损伤模型中,鞘内注射CXCL13可显著增加星形胶质细胞标志物GFAP的表达,而下调CXCL13则能减少星形胶质细胞激活,改善神经功能并减轻痛觉过敏。此外,该通路还可通过星形胶质细胞-小胶质细胞相互作用间接激活小胶质细胞,促进ATP、CCL2等信号分子的释放,进一步放大疼痛信号。研究发现,CXCR5缺陷小鼠在神经损伤后小胶质细胞激活明显减少,证实胶质细胞活化依赖于CXCL13/CXCR5通路的调控。
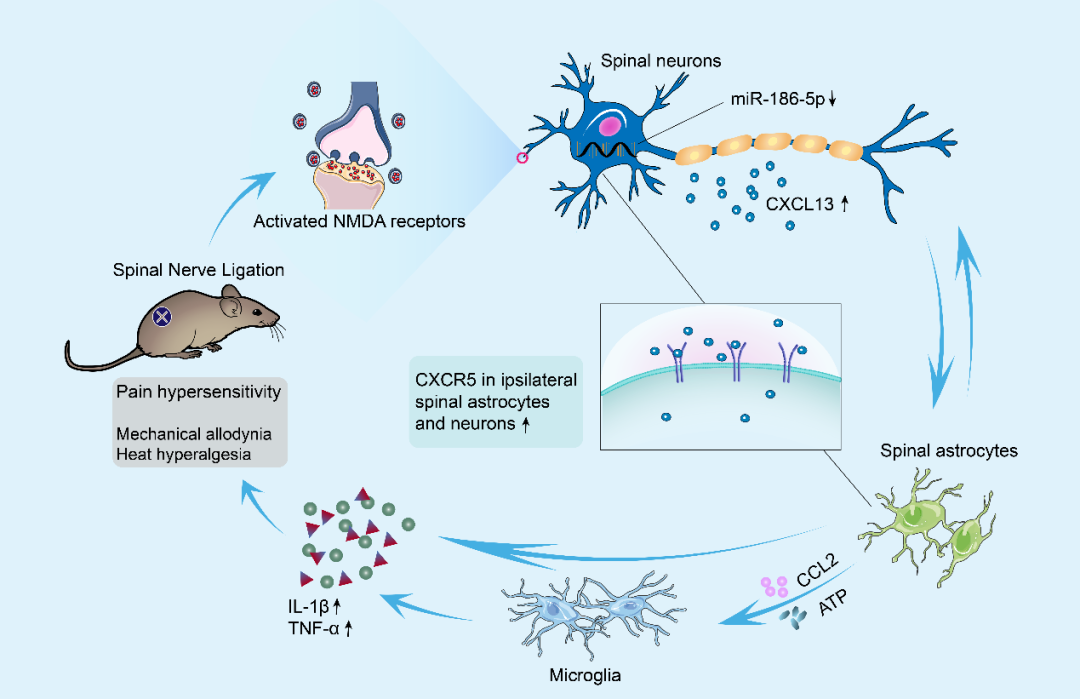
图 5:脊髓神经结扎后脊髓神经元 - 神经胶质细胞相互作用通过 CXCL13/CXCR5 通路导致神经病理性疼痛
四、CXCL13/CXCR5通路作为疼痛治疗靶点的优势与挑战
(一)核心优势
与传统疼痛治疗靶点(如Nav1.7)相比,CXCL13/CXCR5通路具有显著的临床转化优势:首先,该通路在疼痛相关区域(脊髓、DRG、脑脊液)特异性上调,而在正常组织中低表达,这种高度组织特异性可最大程度降低药物脱靶效应,避免传统药物的中枢副作用和心脏毒性;其次,CXCL13/CXCR5通路通过多机制调控疼痛(神经元兴奋性、神经炎症、胶质细胞活化),靶向该通路可实现多维度镇痛,有望解决单一机制靶点疗效有限的问题;最后,临床前研究证实,基因敲除或药物抑制该通路可显著减轻多种疼痛模型的症状,且未观察到明显的毒性反应,为后续药物研发提供了良好的安全性基础。
(二)面临挑战
尽管CXCL13/CXCR5通路展现出巨大的治疗潜力,但仍存在一些亟待解决的问题:一是通路调控的复杂性,CXCL13可与CXCR3等受体交叉结合,且可能通过β-arrestins介导的非GPCR信号通路发挥作用,这些非经典机制增加了药物设计的难度;二是转化医学差距,动物模型中证实有效的干预策略在人类临床应用中可能面临疗效差异,需要更多临床数据支撑;三是长期安全性考量,CXCL13/CXCR5通路在免疫调节中具有重要作用,长期抑制可能导致免疫功能受损、感染易感性增加等风险,需在疗效与安全性之间寻求平衡。
五、未来研究方向与应用前景
未来针对CXCL13/CXCR5通路的研究应聚焦以下几个关键方向:一是深入阐明该通路与其他疼痛相关通路(如CXCL12/CXCR4、CCL2/CCR2)的相互作用及交叉对话,探索联合靶向治疗的可能性,以实现更高效的镇痛效果;二是开发高特异性的通路调节剂,包括CXCL13中和抗体、CXCR5拮抗剂等,同时优化药物递送系统,提高药物在疼痛相关区域的富集度;三是验证CXCL13/CXCR5作为疼痛生物标志物的潜力,通过检测脑脊液或血液中CXCL13的表达水平,为疼痛的诊断、预后评估及个体化治疗提供依据;四是拓展该通路在特殊人群(如老年患者、糖尿病患者)疼痛中的研究,明确其在不同临床场景下的作用差异。 随着对CXCL13/CXCR5通路机制研究的不断深入,该通路有望成为疼痛精准治疗的核心靶点,为开发新型非成瘾性镇痛药提供重要理论基础。未来通过多学科交叉融合,整合免疫学、神经学、药理学等领域的技术优势,有望突破传统疼痛治疗的瓶颈,为广大疼痛患者带来新的治疗希望。












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


