一、研究背景与核心问题
胃癌是全球最常见的恶性肿瘤之一,死亡率高居癌症相关死因的第二位。目前,手术联合围手术期化疗(尤其是以5-氟尿嘧啶为基础的方案)是提高患者生存率的重要策略。然而,化疗抵抗 的出现是限制疗效、导致治疗失败的主要临床障碍。因此,深入阐明5-FU耐药的分子机制,对于改善胃癌患者预后具有重要意义。
近年来研究发现,肿瘤细胞与肿瘤微环境(TME)中其他组分之间的相互作用,在化疗抵抗发展中起着关键作用。肿瘤相关巨噬细胞 作为TME中数量最多的免疫细胞群体,可通过分泌多种细胞因子与趋化因子,深刻影响肿瘤对治疗的反应。本研究旨在探讨TAMs与胃癌细胞化疗抵抗表型之间的相互作用,并揭示其核心分子机制,为逆转耐药提供新思路。
二、巨噬细胞浸润及M2极化在胃癌化疗抵抗中的作用
首先,为探究巨噬细胞在胃癌中的分布特征及其与化疗反应的关系,研究者通过免疫组化检测了接受5-FU新辅助化疗患者组织标本中巨噬细胞标志物CD68的表达水平。结果显示,与病理反应良好组相比,无病理反应组组织中巨噬细胞浸润数量显著增多,提示巨噬细胞在胃癌化疗抵抗的发生与发展中可能具有重要作用。
为构建体外化疗抵抗模型,研究团队将亲本胃癌细胞MKN45与HGC27长期暴露于浓度递增的5-FU中,成功建立两种5-FU耐药细胞系MKN45-R与HGC27-R。CCK-8实验表明,5-FU能以剂量依赖方式抑制细胞活力。进一步检测显示,耐药细胞中化疗抵抗相关蛋白P-gp与抗凋亡蛋白Bcl-2表达显著升高,而促凋亡蛋白Bax则明显下调。这些结果共同证实,通过持续药物诱导可成功建立具有稳定耐药表型的胃癌细胞模型。
接下来,为模拟肿瘤微环境中巨噬细胞与胃癌细胞间的相互作用,研究将人单核细胞系THP-1诱导分化为未极化巨噬细胞(M0),并分别与耐药细胞(MKN45-R、HGC27-R)及其亲本细胞进行非接触式共培养48小时,由此获得源自5-FU敏感微环境(MS)和5-FU抵抗微环境(MR)的肿瘤相关巨噬细胞(图1A)。通过RT-qPCR分析发现,与M0相比,MS与MR组中M1型相关基因(CD86、TNF-α、IL-12)表达均出现下调,且MR组的下调程度显著高于MS组(图1B、C)。相反,M2型相关基因(CD163、CD206、IL-10、Arg-1、VEGF-A)表达则呈上调趋势,且在MR组中表达水平显著高于MS组(图1B、C)。流式细胞术结果进一步证实,与M0相比,MS与MR中M1型巨噬细胞比例降低,而M2型比例增高(图1D)。
综上,该部分实验表明,胃癌细胞具有调控巨噬细胞向M2表型极化的能力,且化疗抵抗细胞在此过程中表现出更强的诱导作用。这提示肿瘤细胞化疗抵抗特性可能与微环境中M2型巨噬细胞的极化密切相关。
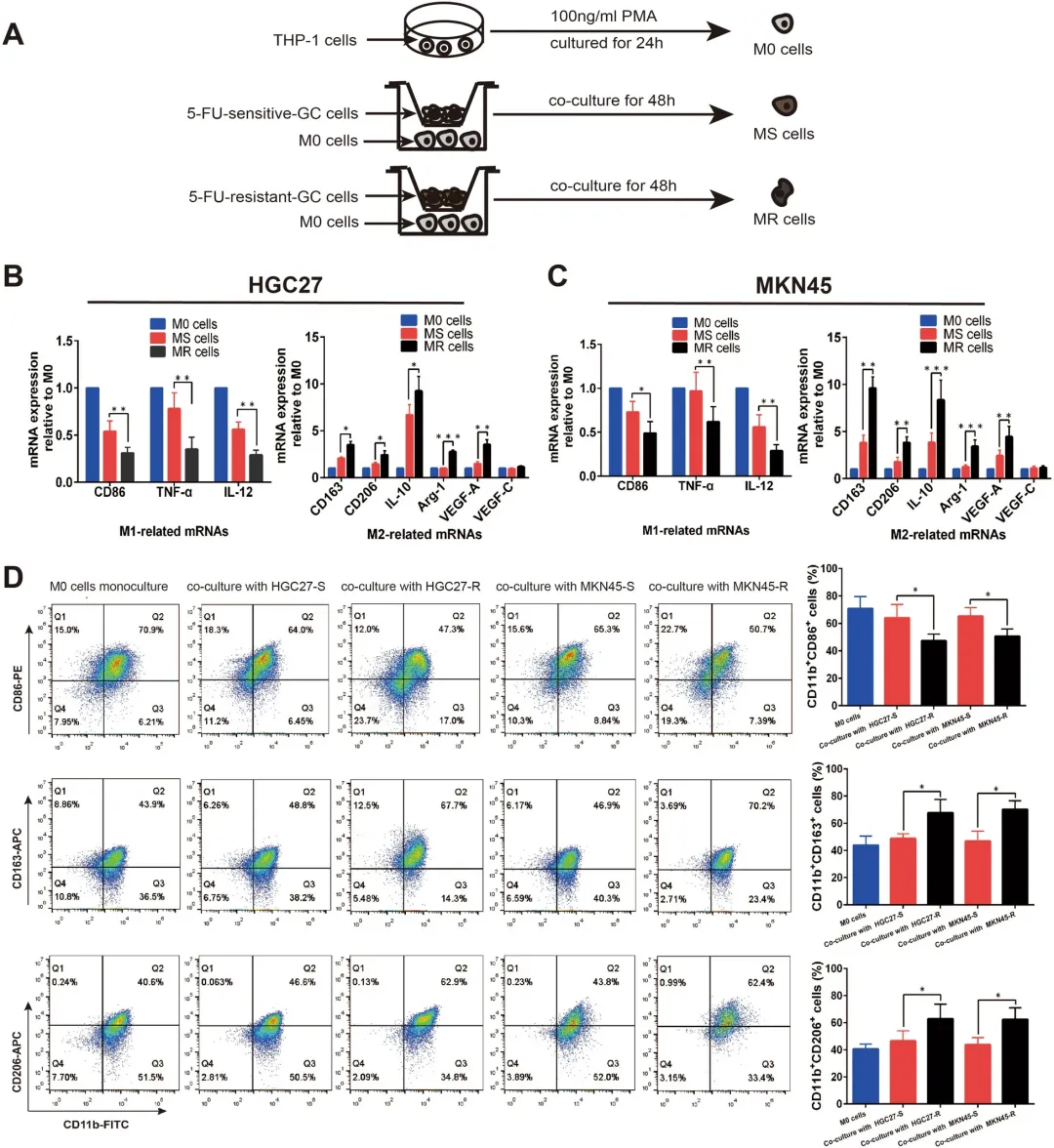 图1 共培养的胃癌细胞诱导巨噬细胞极化为 M2 表型。
图1 共培养的胃癌细胞诱导巨噬细胞极化为 M2 表型。
三、肿瘤相关巨噬细胞对胃癌细胞5-FU耐药性的促进作用
为探究不同表型巨噬细胞对胃癌细胞化疗敏感性的影响,研究者在非接触式共培养体系中,将胃癌细胞分别与不同来源的巨噬细胞共培养48小时后,移除巨噬细胞并收集胃癌细胞进行分析(图2A)。通过CCK-8法检测5-FU对胃癌细胞的半数抑制浓度(IC₅₀)发现,与未共培养组相比,与MS及MR来源的巨噬细胞共培养均能提高HGC27-S和MKN45-S细胞的IC₅₀值(图2B、C)。进一步比较显示,MR巨噬细胞对胃癌细胞5-FU耐药性的促进作用显著强于MS巨噬细胞(图2D、E)。
为阐明其潜在机制,研究采用流式细胞术检测5-FU诱导的细胞凋亡。结果显示,与单独培养或与MS巨噬细胞共培养的胃癌细胞相比,与MR巨噬细胞共培养的胃癌细胞凋亡率显著降低(图2F、G)。Western blot分析进一步表明,与MR巨噬细胞共培养后,胃癌细胞中耐药相关蛋白P-gp及抗凋亡蛋白Bcl-2的表达水平显著上调,而促凋亡蛋白Bax的表达则明显下调(图2H、I)。
综合以上结果可得出结论:5-FU耐药性胃癌细胞能够有效诱导巨噬细胞向M2表型极化,而此类M2型巨噬细胞可进一步通过调控凋亡相关蛋白表达,增强胃癌细胞对5-FU的化疗抵抗能力,形成促进耐药的正反馈环路。
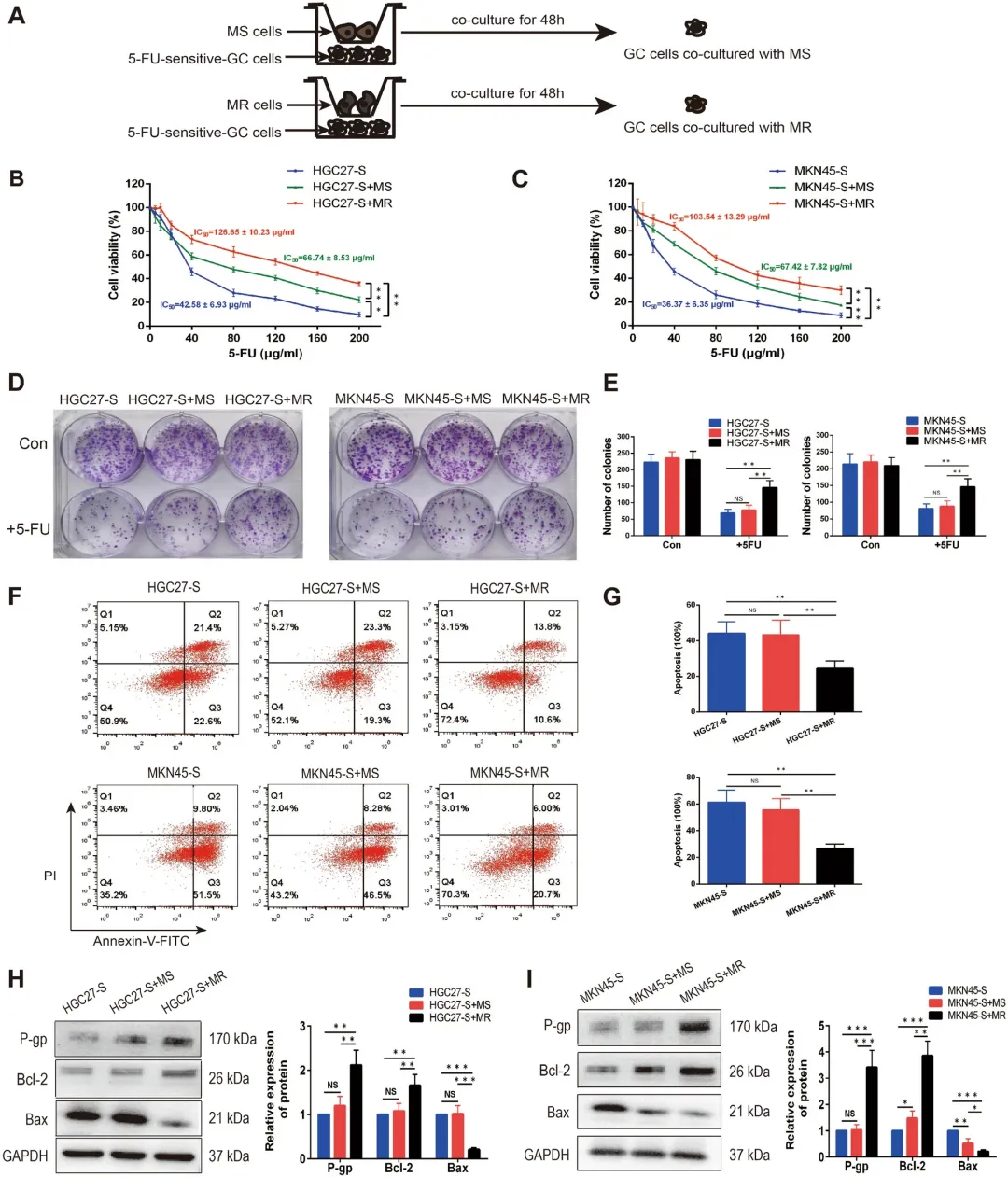 图2 共培养M2极化的巨噬细胞增强胃癌细胞5- Fu抵抗性。
图2 共培养M2极化的巨噬细胞增强胃癌细胞5- Fu抵抗性。
四、M2型巨噬细胞通过分泌CXCL5激活PI3K/AKT/mTOR通路增强胃癌细胞5-FU耐药
基于前期观察到的不同巨噬细胞亚型对胃癌细胞耐药性影响的差异,研究人员推测其可能与分泌细胞因子的水平不同相关。为此,通过RT-qPCR对11种常见细胞因子进行筛选分析,结果发现仅有CCL18与CXCL5的表达变化趋势与前述功能表型相符。由于CXCL5在MS与MR巨噬细胞中的转录水平显著高于CCL18,研究选择CXCL5作为后续重点研究对象,以验证其在介导胃癌细胞5-FU耐药中的作用。
为明确CXCL5的功能,研究者分别使用重组人CXCL5蛋白(rhCXCL5)或CXCL5中和抗体处理5-FU敏感型胃癌细胞,并在单独培养或与MR巨噬细胞共培养条件下,评估细胞对不同浓度5-FU的敏感性。CCK-8实验结果显示,与MR巨噬细胞共培养或添加rhCXCL5均可显著提高胃癌细胞的5-FU耐受性;而使用CXCL5中和抗体则可有效逆转由MR巨噬细胞介导的耐药增强效应。上述结果提示,M2极化巨噬细胞来源的CXCL5是参与调控胃癌细胞5-FU耐药的关键趋化因子。
目前研究普遍认为,细胞凋亡抵抗是导致化疗耐药的重要原因之一,而5-FU的主要抗肿瘤机制正是诱导肿瘤细胞凋亡。因此,实验进一步探究了M2型巨噬细胞是否通过调控凋亡途径介导5-FU耐药。凋亡检测显示,与MR巨噬细胞共培养或添加rhCXCL5均可显著降低胃癌细胞的凋亡比例,而CXCL5中和抗体则能削弱MR巨噬细胞对凋亡的抑制作用(图3A、B)。Western blot分析进一步表明,MR巨噬细胞共培养或外源性rhCXCL5处理均可上调抗凋亡蛋白Bcl-2表达、下调促凋亡蛋白Bax表达;而CXCL5中和抗体则能显著逆转上述蛋白表达变化(图3C、D)。
已有研究表明,PI3K/AKT/mTOR信号通路在调控细胞增殖、凋亡及化疗抵抗中发挥关键作用。为进一步阐明其在该过程中的作用,研究者检测了该通路关键蛋白的磷酸化水平。结果发现,与MR巨噬细胞共培养或添加rhCXCL5均可显著提升磷酸化PI3K、AKT及mTOR的表达水平,而使用CXCL5中和抗体则可明显抑制该通路的激活。
综合以上结果表明,M2型巨噬细胞通过分泌CXCL5,可有效激活PI3K/AKT/mTOR信号通路,抑制胃癌细胞凋亡,从而增强其对5-FU的化疗抵抗能力。
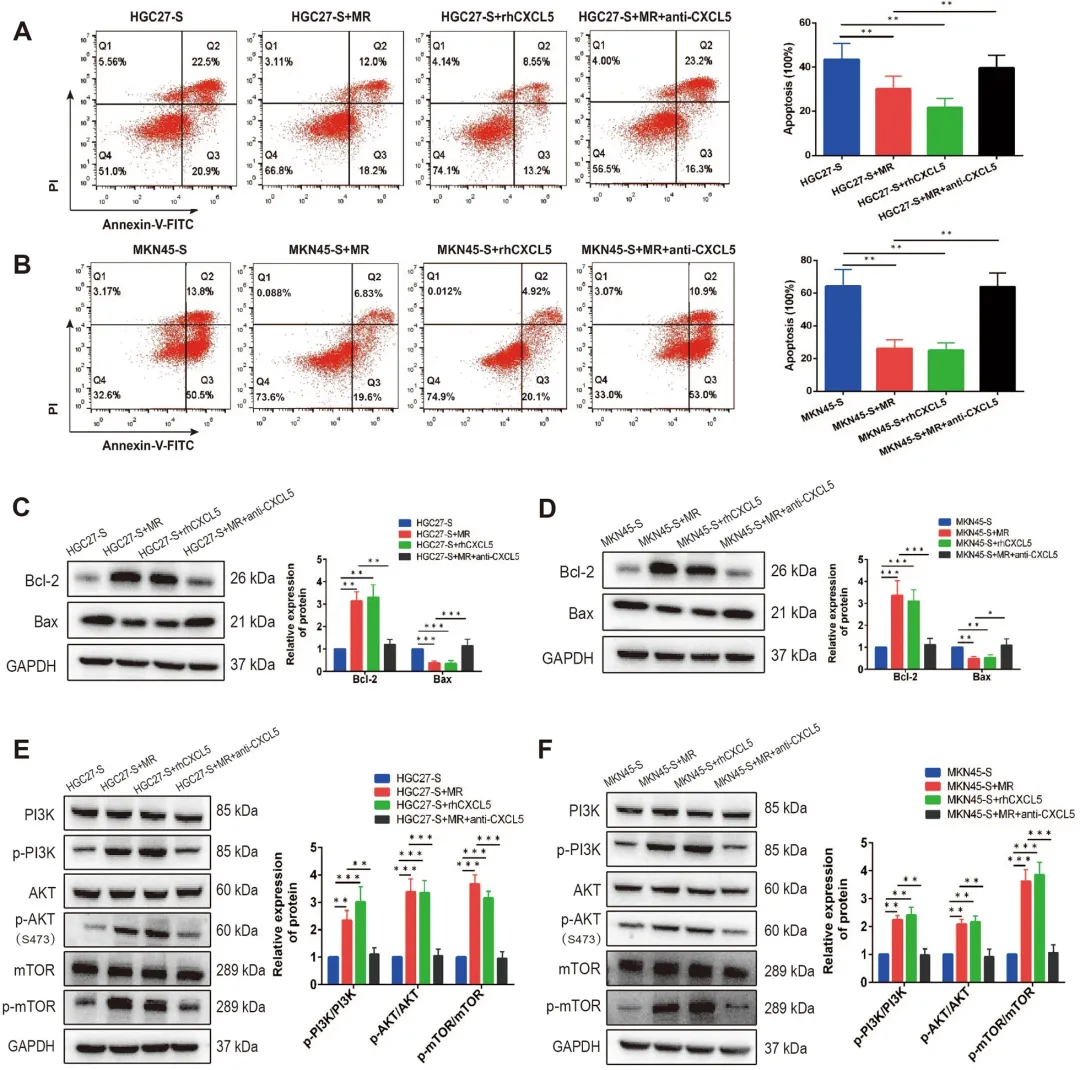 图3 M2极化的巨噬细胞通过激活胃癌细胞CXCL5/PI3K/AKT/mTOR通路抑制细胞凋亡,增加5-Fu耐药性。
图3 M2极化的巨噬细胞通过激活胃癌细胞CXCL5/PI3K/AKT/mTOR通路抑制细胞凋亡,增加5-Fu耐药性。
五、CXCL5介导的恶性循环及其临床预后价值
研究还发现,CXCL5在TME中扮演着募集和“教育”更多巨噬细胞的作用:
MR巨噬细胞因其高分泌CXCL5,对单核细胞的趋化能力更强。
在临床样本中,肿瘤组织高表达CXCL5与M2型巨噬细胞(CD163⁺/CD206⁺)的高浸润程度呈正相关。
这形成了一个恶性循环:耐药细胞诱导M2巨噬细胞 → M2巨噬细胞分泌CXCL5 → CXCL5募集更多单核细胞并促其分化为M2巨噬细胞 → 进一步强化耐药微环境。
更重要的是,临床生存分析显示,肿瘤组织中CXCL5高表达的胃癌患者,其总生存期显著短于低表达患者。这提示CXCL5不仅是一个功能分子,也可能成为预测患者化疗反应和预后的潜在生物标志物。
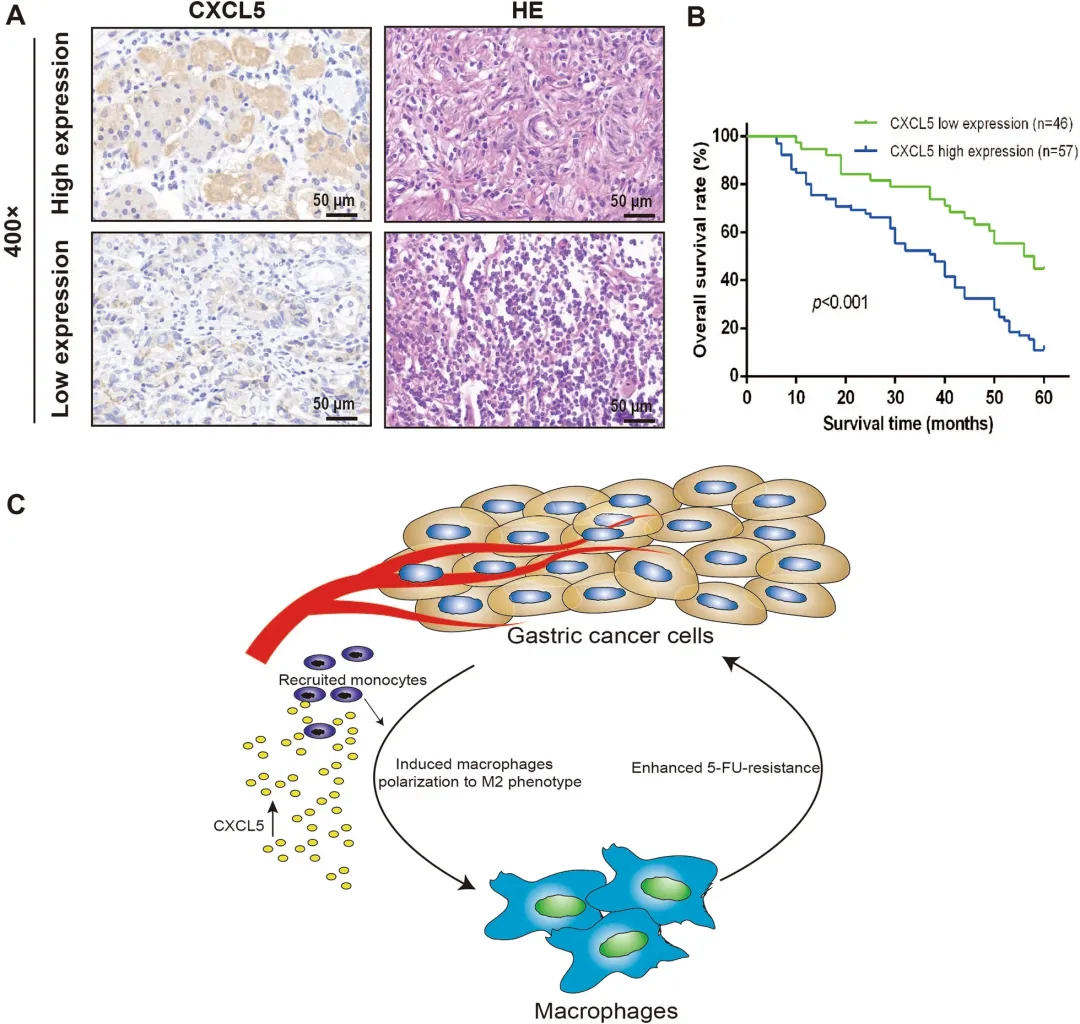 图4 CXCL5在胃癌组织中的高表达与患者的不良预后相关。(C)显示巨噬细胞如何与胃癌细胞相互作用以促进胃癌化疗抵抗微环境发展的图形摘要。
图4 CXCL5在胃癌组织中的高表达与患者的不良预后相关。(C)显示巨噬细胞如何与胃癌细胞相互作用以促进胃癌化疗抵抗微环境发展的图形摘要。
六、研究总结与转化意义:靶向TAMs-CXCL5轴作为逆转胃癌化疗抵抗的潜在策略
综上所述,本研究揭示化疗抵抗性胃癌细胞能够更有效地诱导巨噬细胞向M2表型极化,而此类M2型肿瘤相关巨噬细胞(TAMs)又可进一步强化胃癌细胞的化疗抵抗能力,从而在TAMs与胃癌细胞之间形成自我维持的正反馈环路(图4C)。在这一相互作用中,TAMs来源的CXCL5发挥核心介导作用:一方面,CXCL5可募集外周单核细胞并在肿瘤微环境中促进其分化为M2型巨噬细胞;另一方面,CXCL5通过激活胃癌细胞内的PI3K/AKT/mTOR信号通路,抑制细胞凋亡,从而增强其对5-FU的化疗抵抗性。
这些结果表明,针对TAMs的调控及阻断TAMs与胃癌细胞之间的相互作用,可能成为逆转化疗抵抗、改善患者预后的潜在治疗方向。具体而言,靶向CXCL5信号轴或干预PI3K/AKT/mTOR通路,有望打破TAMs与肿瘤细胞间的恶性循环,为临床治疗化疗抵抗性胃癌提供新的策略。
七、CXCL5趋化因子检测服务哪里有?
LabEx为您提供专业、精准的CXCL5趋化因子检测服务。作为CXC趋化因子家族的重要成员,CXCL5(又称ENA-78)在中性粒细胞趋化、血管生成、炎症反应及肿瘤进展中发挥关键作用。
| 货号 | Panel名称 | 种属 | 检测指标 |
| LXLTM36-1 | 小鼠细胞因子/趋化因子-36因子Panel | Mouse | GM-CSF,IFN gamma,IL-1 beta,IL-2,IL-4,IL-5,IL-6,IL-12p70,IL-13,IL-18,TNF alpha,IL-9,IL-10,IL-17A (CTLA-8),IL-22,IL-23,IL-27,G-CSF (CSF-3),IFN alpha,IL-3,IL-15/IL-15R,IL-28,IL-31,IL-1 alpha,LIF,ENA-78 (CXCL5),M-CSF,Eotaxin (CCL11),GRO alpha (CXCL1),IP-10 (CXCL10),MCP-1 (CCL2),MCP-3 (CCL7),MIP-1 alpha (CCL3),MIP-1 beta (CCL4),MIP-2,RANTES (CCL5) |
| LXLBH40-1 | 人趋化因子/细胞因子-40因子Panel | Human | 6Ckine/CCL21,BCA-1/CXCL13,CTACK/CCL27,ENA-78/CXCL5,Eotaxin/CCL11,Eotaxin-2/CCL24,Eotaxin-3/CCL26,Fractalkine/CX3CL1,GCP-2/CXCL6,GM-CSF,GRO-α (Gro-a/KC/CXCL1),Gro-β/CXCL2,I-309/CCL1,IFN-γ,IL-1β,IL-2,IL-4,IL-6,IL-8/CXCL8,IL-10,IL-16,IP-10/CXCL10,I-TAC/CXCL11,MCP-1/CCL2,MCP-2/CCL8,MCP-3/CCL7,MCP-4/CCL13,MDC/CCL22,MIF,MIG/CXCL9,MIP-1α/CCL3,MIP-1δ/CCL15,MIP-3α/CCL20,MIP-3β/CCL19,MPIF-1/CCL23,SCYB16/CXCL16,SDF-1α+β/CXCL12,TARC/CCL17,TECK/CCL25,TNF-α |
| LXLBM31-1 | 小鼠趋化因子-31因子Panel | Mouse | BCA-1/CXCL13,CTACK/CCL27,ENA-78/CXCL5,Eotaxin/CCL11,Eotaxin-2/CCL24,Fractalkine/CX3CL1,GM-CSF,I-309/CCL1,IFN-γ,IL-1β,IL-2,IL-4,IL-6,IL-10,IL-16,IP-10/CXCL10,I-TAC/CXCL11,KC/CXCL1,MCP-1/CCL2,MCP-3/CCL7,MCP-5/CCL12,MDC/CCL22,MIP-1α/CCL3,MIP-1β/CCL4,MIP-3α/CCL20,MIP-3β/CCL19,RANTES/CCL5,SCYB16/CXCL16,SDF-1α/CXCL12,TARC/CCL17,TNF-α |












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


