一、概述
FAERS(FDA Adverse Event Reporting System),即美国食品药品监督管理局不良事件报告系统,是美国食品药品监督管理局(FDA)建立并维护的,用于系统收集、管理与分析药品及治疗性生物制品在上市后实际使用过程中所发生的不良事件报告的专项数据库。该数据库构成了FDA药物安全警戒体系的核心数据来源之一,通过对海量自发报告信息的持续监测与深度分析,为识别潜在药品安全风险信号、评估获益-风险平衡以及制定相应风险管理策略提供关键的循证依据。
二、数据概览与核心模块
FAERS数据库的原始报告主要来源于医疗机构专业人员、用药患者或其监护人以及药品生产企业的法定提交。截至最新数据更新,该系统累计收录的独立患者报告已超过1,800万份,涉及各类不良事件记录逾5,400万条。
该数据库遵循季度更新机制,当前已涵盖至2024年第4季度数据,确保了监测信息的时效性与连续性。从数据结构角度分析,FAERS主要由以下七个核心数据模块构成👇:
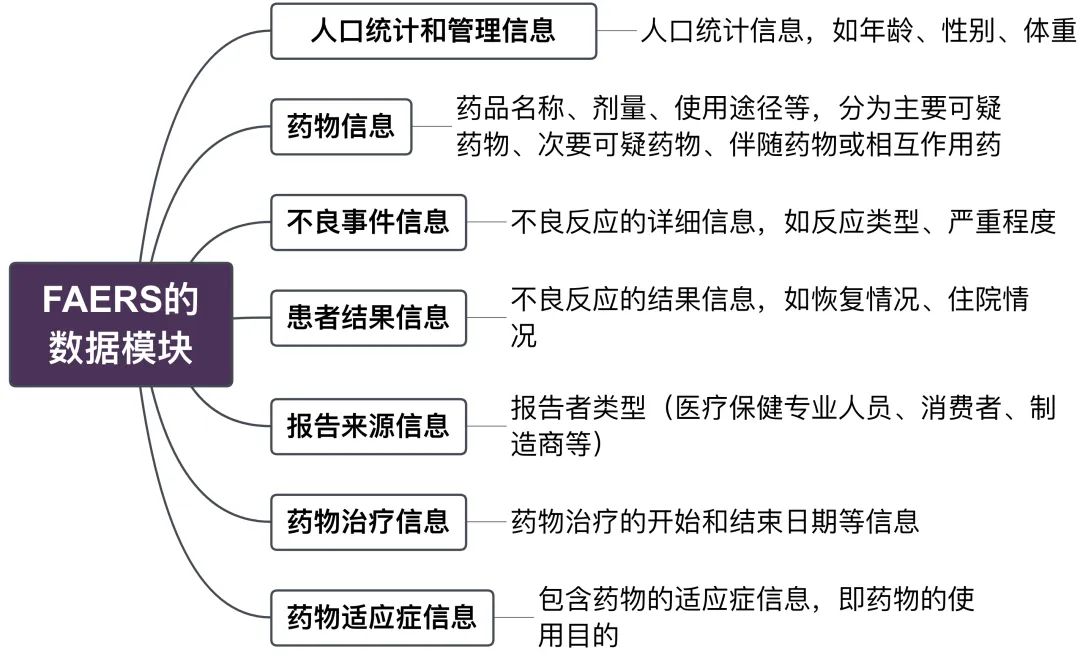
三、常用分析方法
基于FAERS数据库开展药物警戒研究的核心目标,在于通过科学的数据挖掘方法识别潜在药物不良事件信号。其中,以比例失衡分析法(Disproportionality Analysis)及其衍生算法为国际学界普遍采用的量化工具。以下是四种主要分析方法:
✔️ 比例报告比值比(Proportional Reporting Ratio, PRR)
该方法通过计算目标药物中特定不良事件报告的比例,与数据库内所有其他药物中该事件报告比例的比值,来初步评估药物与事件之间是否存在统计意义上的关联。
✔️ 报告比值比(Reporting Odds Ratio, ROR)
此方法通过构建四格表,计算目标药物发生目标不良事件的报告比值,与对照药物(其他所有药物)发生该事件的报告比值之比,进一步量化关联强度,是较常用的信号检测指标。
✔️ 贝叶斯置信传播神经网络(Bayesian Confidence Propagation Neural Network, BCPNN)
作为一种基于贝叶斯统计理论的数据挖掘模型,BCPNN通过计算信息成分(Information Component, IC)及其可信区间,以概率方式评估药物与不良事件之间关联的稳健性。
✔️ 多项伽马泊松收缩估计器(Empirical Bayes Geometric Mean, EBGM)
该方法采用经验贝叶斯框架,通过计算观测报告数与期望报告数的几何均值(即EBGM值),并对结果进行收缩校正,以减少小样本报告带来的随机误差,提高信号检测的稳定性。
以上方法各有其统计假设与适用场景,在实际研究中常结合使用,相互验证,以增强信号发现的可靠性。
四、核心研究方向
基于FAERS数据资源的学术研究,主要聚焦于以下几个关键领域:
💯上市后药品安全性评价
通过对不良事件报告的系统性分析,识别和评估已上市药品潜在的风险信号,为风险控制措施提供证据支持。
💯药物相互作用与安全性研究
探究不同药物联用时可能产生的不良反应模式,旨在发现并阐明具有临床意义的药物-药物相互作用风险。
💯特殊人群用药风险特征分析
针对生理或病理状态特殊的群体(如儿童、妊娠期妇女、老年患者等),分析其药物不良反应的报告特征与潜在风险差异。
💯疾病相关不良事件监测与流行病学分析
利用不良事件报告数据,辅助监测特定疾病或健康事件的流行趋势,并可对报告人群的人口学特征(如性别、年龄分布)进行描述性分析。
💯药物警戒方法学与应用研究
基于真实世界报告数据,开发或验证药物警戒信号检测与风险评估的新方法、新模型,推动药物警戒学科的发展与实践优化。
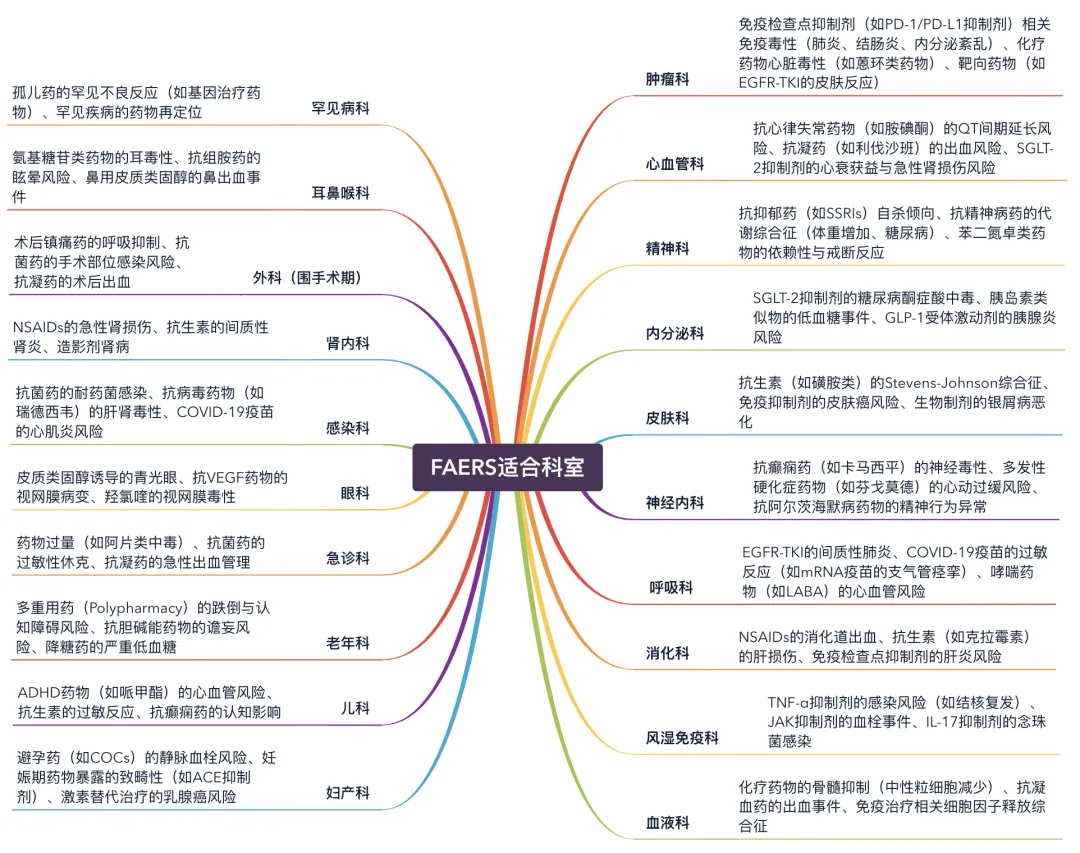
五、跨学科适用性
FAERS数据库作为药物警戒研究的关键工具,其数据具有广泛的适用性,几乎涵盖所有临床医学及药学相关学科领域,可供相关领域的专业研究者开展药品安全性评价和风险信号挖掘工作。下图直观展示了其主要适用科室的范围。












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


