一、巨噬细胞极化机制及其在组织修复中的调控作用
巨噬细胞起源于单核细胞,能够在特定微环境信号或分子因子的诱导下发生功能极化,形成具有不同表型与功能的亚群。其中,经典激活的M1型与替代激活的M2型是两种主要极化方向。在组织损伤初期,巨噬细胞通常极化为M1型,发挥促炎作用,通过分泌多种促炎介质以清除病原体并启动免疫应答;随后,在微环境信号转变的调控下,巨噬细胞往往向M2型转化,转而发挥抗炎及组织修复功能,促进损伤愈合。
巨噬细胞的极化过程常伴随其表面标志物及分泌谱系的特征性变化。M1型巨噬细胞通常高表达CD80、CD86及CD16/32等膜表面分子;而M2型巨噬细胞则高表达精氨酸酶-1(Arg-1)、甘露糖受体(CD206),并倾向于分泌抗炎因子如IL-10,以及趋化因子CCL17、CCL22等。
本文系统综述了在肿瘤微环境、纳米载体介导的作用、以及特定细胞因子与信号通路调控等条件下,巨噬细胞向M2型极化的调控机制,以期为设计促进组织修复的生物材料提供理论依据与应用参考。
二、肿瘤微环境中巨噬细胞极化的调控因素
肿瘤微环境(Tumor Microenvironment, TME)是由肿瘤细胞、免疫细胞(如巨噬细胞、淋巴细胞)、基质细胞(如成纤维细胞、内皮细胞、周细胞)、细胞外基质(Extracellular Matrix, ECM)以及多种可溶性信号分子共同构成的复杂动态系统。其中,肿瘤相关巨噬细胞(Tumor-associated Macrophages, TAMs)作为TME中最主要的浸润性免疫细胞群体之一,在肿瘤进展中发挥关键作用。TAMs通常受到肿瘤源性信号的调控,表现出促进肿瘤免疫逃逸、血管生成、肿瘤生长及转移的功能倾向。
巨噬细胞在TME中具有可塑性,可受局部条件影响而极化为不同功能亚型。一般而言,M1型巨噬细胞具有抗肿瘤活性,而M2型巨噬细胞则常与促肿瘤进展及组织修复相关。在癌症治疗策略中,往往倾向于诱导TAMs向M1型极化以增强肿瘤杀伤作用;而在组织修复的语境下,则需促进其向M2型转化以支持损伤愈合。以下概述TME中调控巨噬细胞向M2型极化的几个关键因素:
✔️酸性pH:TME常呈酸性,低pH条件可诱导巨噬细胞向M2表型极化。
✔️低氧(Hypoxia):肿瘤区域常存在缺氧微环境,低氧可通过稳定缺氧诱导因子-1α(HIF-1α)等途径,促进巨噬细胞向M2型极化。该机制在类风湿性疾病等病理过程中亦有类似表现。
✔️细胞外基质(ECM):ECM的组成与来源对巨噬细胞极化具有调控作用。研究表明,心脏来源的ECM倾向于诱导巨噬细胞向M2型极化,而骨骼来源的ECM则更易促进M1型极化。
✔️可溶性因子:多种信号分子可调控巨噬细胞极化方向,例如BMP4、TGF-β1、eNAMPT、一氧化氮(NO)、NF-κB、CSF1及IL-10等因子,均在特定条件下可促进巨噬细胞向M2表型转化。
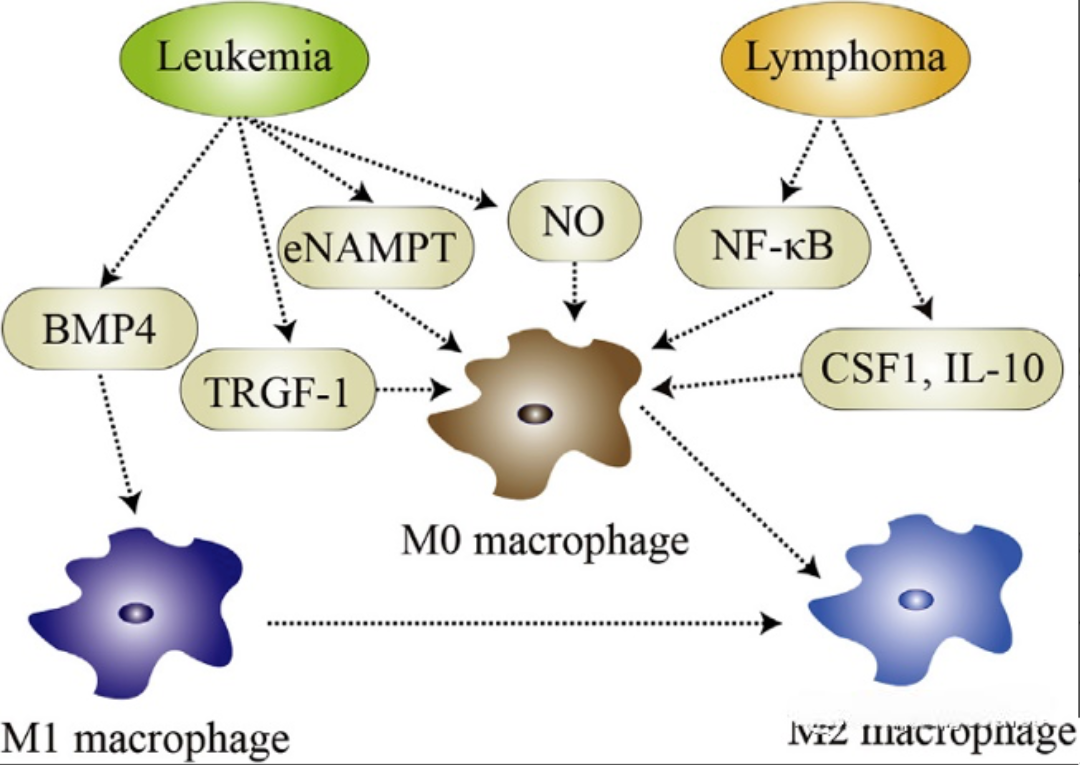 图1 不同因子诱导巨噬细胞向M2亚型极化
图1 不同因子诱导巨噬细胞向M2亚型极化
三、纳米材料理化特性对巨噬细胞极化的调控
巨噬细胞可通过内吞作用摄取纳米载体,这一过程常伴随其极化表型的改变,并影响相关细胞因子与趋化因子的分泌。研究表明,多种纳米载体在体内外实验中均能引发不同程度的炎症或免疫应答。其中,纳米材料的孔径、刚度及表面拓扑结构等理化性质,均可显著影响免疫反应模式及巨噬细胞的极化方向(如图2所示)。
以下就两类典型纳米材料对巨噬细胞极化的调控作用进行阐述:
✔️磁性纳米颗粒
外磁场参数可影响巨噬细胞的极化方向:低频振荡磁场倾向于促进巨噬细胞向M2表型极化,而高频振荡则更易诱导M1表型分化。超顺磁性氧化铁纳米颗粒(SPIONs)作为典型的磁性纳米材料,在研究中被证实能够引导巨噬细胞向M2型极化。
✔️生物活性玻璃
生物活性玻璃(Bioactive Glass, BG)是一类具有促成骨与血管生成功能的生物材料,在组织修复过程中发挥重要作用。其生物活性部分源于降解过程中释放的离子成分(如钙离子、硅酸根离子、磷酸根离子等),这些离子可调节局部微环境,抑制促炎反应并促进巨噬细胞向M2表型极化。
当前研究中,叶酸功能化的生物活性玻璃纳米颗粒(F-BGNs)是常用的功能性BG材料之一。其作用机制可能与抑制细胞内信号通路关键蛋白的磷酸化有关,通过下调促炎分子的表达,进而引导巨噬细胞向M2型转化。
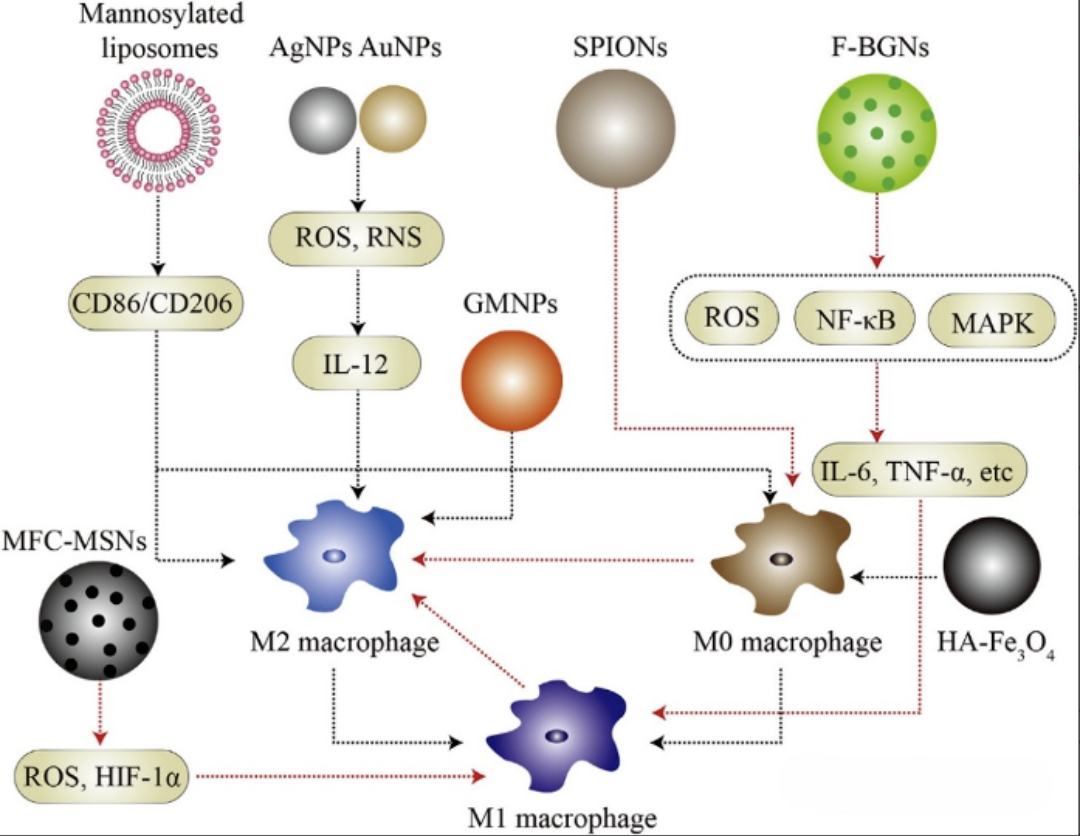 图2 多种纳米载体对巨噬细胞极化的影响(红线-向M2亚型极化;黑线-向M1亚型极化)
图2 多种纳米载体对巨噬细胞极化的影响(红线-向M2亚型极化;黑线-向M1亚型极化)
四、细胞因子与信号通路对巨噬细胞极化的调控机制
细胞因子及相关的信号通路在调控巨噬细胞极化过程中扮演重要角色,其通过精密有序的分子级联反应,影响巨噬细胞表型与功能。以下就两类关键信号通路在巨噬细胞极化中的作用机制进行阐述:
✔️PPAR信号通路
过氧化物酶体增殖物激活受体γ(PPARγ)作为核受体,受特定亲脂性小分子的调控,对巨噬细胞极化具有重要调节作用。研究表明,IL-4因子、mTOR或Sema6D信号通路的激活均可上调PPARγ的表达,进而促进巨噬细胞向M2表型极化。
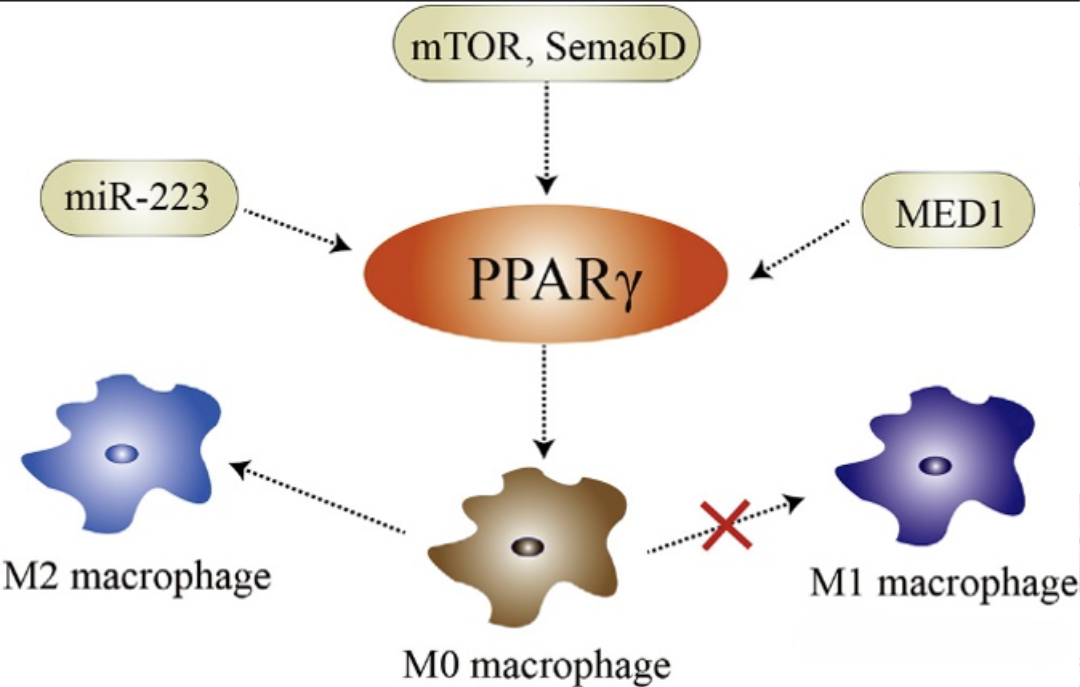 图3核受体PPAR调控巨噬细胞的极化
图3核受体PPAR调控巨噬细胞的极化
✔️NF-κB信号通路
肿瘤相关巨噬细胞(TAMs)可通过NF-κB通路产生多种细胞因子,如IL-10、VEGF、IL-8等,这些因子参与调节血管生成过程。研究指出,在特定条件下抑制NF-κB通路活性,可促进巨噬细胞向M2表型极化,提示该通路在调控巨噬细胞功能极化中具有可调节性。
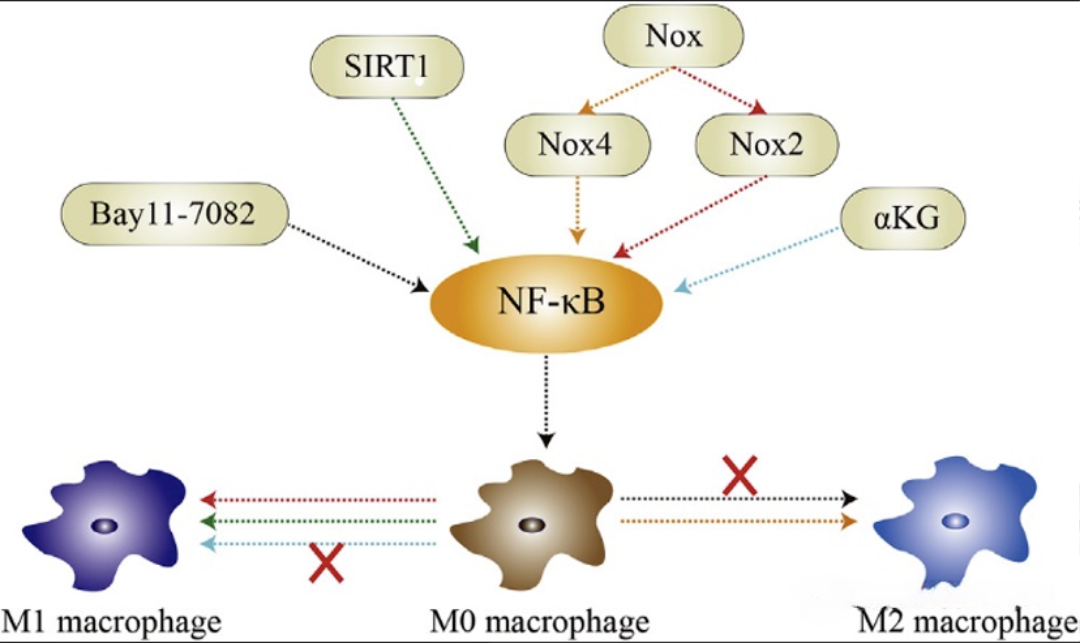 图4 NF-B通路调控巨噬细胞的极化
图4 NF-B通路调控巨噬细胞的极化
五、内吞作用对巨噬细胞极化的调控
巨噬细胞可通过内吞作用,特别是对凋亡细胞的吞噬过程,主动调控自身的极化表型,进而增强其抗炎与组织修复功能。例如,研究表明巨噬细胞在吞噬凋亡的脂肪间充质干细胞后,可下调肿瘤坏死因子α和一氧化氮等促炎介质的产生,同时上调抗炎因子白介素-10的表达,从而促进巨噬细胞向M2表型极化。这一过程体现了内吞作用在调控免疫微环境及引导巨噬细胞功能转化中的重要作用。












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


